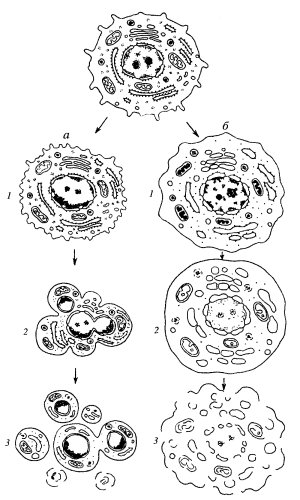
Биология клетки. Размножение организмов
 Скачать 15.49 Mb. Скачать 15.49 Mb.
|
|
Депуринизация (апуринизация) ДНК каждой клетки человека теряет за сутки около 5000 пуриновых остатков вследствие разрыва N-гликозидной связи между пурином и дезоксирибозой (рис. 4-22). Тогда в молекуле ДНК на месте этих оснований образуется участок, лишённый азотистых оснований, названный АП-сайтом (AP-site, или апуриновый сайт). Термин "АП-сайт" используют также в тех случаях, когда из ДНК выпадают пиримидиновые основания и образуются апиримидиновые сайты (от англ, apurinic-apyrimidinic site). Этот тип повреждений устраняет фермент ДНК-инсертаза (от англ, insert - вставлять), который может присоединять к дезоксирибозе основание в соответствии с правилом компле-ментарности. В этом случае нет необходимости разрезать цепь ДНК, вырезать неправильный нуклеотид и репарировать разрыв. Дезаминирование Реакции дезаминирования цитозина и превращение его в урацил (рис. 4-23), аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки. Исправление этого вида спонтанного повреждения происходит в 5 этапов (рис. 4-24). В репарации принимает участие ДНК-N-гликозилаза, гидролизующая связи между аномальным основанием и дезоксирибозой (первый этап), в результате образуется АП-сайт, который распознаёт фермент АП-эндонуклеаза (второй этап). Как только в цепи ДНК возникает разрыв, в работу вступает ещё один 158 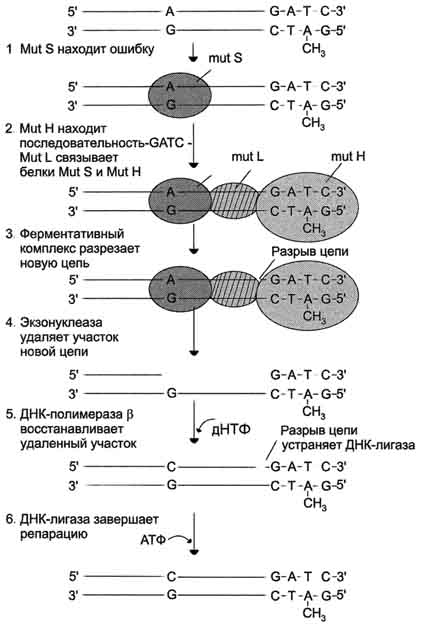 Рис. 4-21. Система репарации ошибок репликации. 1 - белок mut S "узнаёт" некомплементарную пару и присоединяется в этом участке ДНК; 2 - белки mut H взаимодействуют с метилированной по аденину последовательностью материнской цепи -GATC-; завершается формирование ферментативного комплекса после присоединения mut L; 3 - комплекс определяет вновь синтезированную цепь по отсутствию метилированного остатка аденина в последовательности -GATC- и разрывает её; 4 - экзонуклеаза удаляет фрагмент дочерней цепи ДНК, содержащий ошибку; 5 - ДНК-полимераза β по принципу комп-лементарности застраивает брешь; 6 - ДНК-лигаза З'-конец вновь синтезированного фрагмента соединяет с основной цепью и завершает репарацию ошибки. фермент - АП-экзонуклеаза, который отщепляет от цепи дезоксирибозу, лишённую основания (третий этап). В цепи ДНК появляется брешь размером в один нуклеотид. Следующий фермент ДНК-полимераза р к З'-концу разорванной цепи присоединяет нуклеотид по принципу комплементарности (четвёртый этап). Чтобы соединить два свободных конца (3'-конец встроенного нуклеотида и 5'-конец основной цепи), требуется ещё один фермент - ДНК-лигаза (пятый этап). Нерепарйруемо и поэтому опасно дезаминирование метилированного цитозина. Продукт его спонтанного дезамжнирования - тимин, 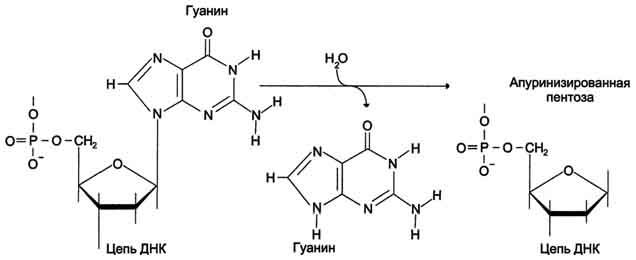 Рис. 4-22. Депуринизация - спонтанное удаление аденина или гуанина. 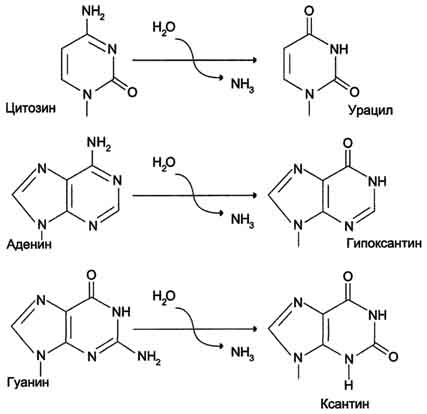 Рис. 4-23. Продукты спонтанного дезаминирования различных оснований ДНК. Все продукты дезаминирования (урацил, гипоксантин, ксантин) нехарактерны для состава ДНК и поэтому довольно легко распознаются ферментами репарации. нормальное для ДНК основание, которое не распознаётся ДНК-N-гликозилазой. Б. Индуцируемые повреждения Индуцируемые повреждения возникают в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы. Образование димеров пиримидиновых оснований Под действием УФО двойная связь между С5 и С6 атомами углерода в составе пиримидиновых оснований (тимине и цитозине) может разрываться. Атомы углерода остаются связанными одной связью. Расстояние между параллельными плоскостями оснований полинуклеотидной цепи, в которых произошёл разрыв., равно примерно 3,4 Удаление пиримидиновых димеров происходит под действием фотолиазы Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В фотолиазе есть участок, либо сам поглощающий фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Таким образом, свет активирует фотолиазу, которая распознаёт димеры в облучённой ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами 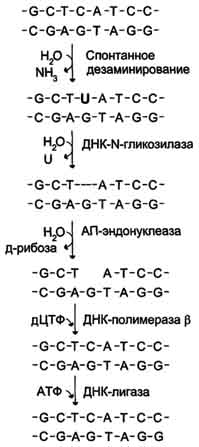 Рис. 4-24. Репарация АП-сайтов с участием ДНК-М-гликозилазы и АП-экзонуклеазы. связи. После этого фермент отделяется от ДНК. Повреждения оснований ДНК химическими мутагенами Азотистые основания в ДНК могут подвергаться разнообразным повреждениям: алкилированию, 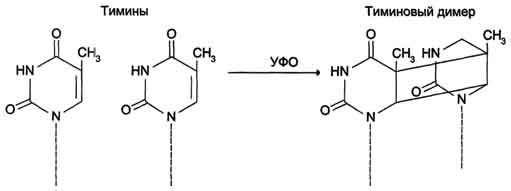 Рис. 4-25. Димер тимина (циклобутановое кольцо). 161 окислению, восстановлению или связыванию основания с формамидными группировками. Репарация начинается с присоединения ДНК-N-гликозилазы к повреждённому основанию. Существует множество ДНК-М-гликозилаз, специфичных к разным модифицированным основаниям. Ферменты гидролитически расщепляют N-гликозидную связь между изменённым основанием и дезоксирибозой, это приводит к образованию АП-сайта в цепи ДНК (первый этап). Репарация АП-сайта может происходить или только при участии ДНК-инсертазы, которая присоединяет к дезоксирибозе основание в соответствии с правилом комплементарности, или при участии всего комплекса ферментов, участвующих в репарации: АП-эндонуклеазы, АП-экзонуклеазы, ДНК-полимеразы β и ДНК-лигазы. В. Дефекты репарационных систем и наследственные болезни Репарация необходима для сохранения нативной структуры генетического материала на протяжении всей жизни организма. Снижение активности ферментов репарационных систем приводит к накоплению повреждений (мутаций) в ДНК. Причиной многих наследственных болезней человека выступает нарушение отдельных этапов процесса репарации. Пигментная ксеродерма У больных в системе репарации снижена активность ферментов, ответственных за удаление неправильных оснований, "застройку" бреши и другие функции. Дефект репарационной системы проявляется в сверхчувствительности к УФ-свету, что приводит к появлению красных пятен на коже, переходящих в незаживающие коросты и нередко в рак кожи. Трихотиодистрофия Заболевание связано с повышенной фоточувствительностью ДНК, вызванной снижением активности фермента, участвующего в удалении димеров тимина. Симптомы заболевания: ломкость волос вследствие нехватки серы в белках волос и их луковиц; часто умственная д физическая отсталость; аномалии кожи и зубов. 20. Проблемы клеточной пролиферации в медицине. Определение пролиферативной активности клеток тканей, органов. Значение метода тимидиновой радиоавтографии в изучении жизненного цикла клетки. Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток. Механизм пролиферации отличается от других механизмов изменения объёма клетки (клеток), например, отёка или апоптоза. Термин в медицине впервые ввел немецкий ученый Вирхов для обозначения новообразования клеток путем их размножения делением. Регулировать интенсивность пролиферации можно стимуляторами и ингибиторами, которые могут вырабатываться и вдали от реагирующих клеток (например, гормонами), и внутри них. Непрерывно пролиферация происходит в раннем эмбриогенезе и по мере дифференцировки периоды между делениями удлиняются. Некоторые клетки, например нервные, не способны к пролиферации. С начала 60-х гг. появились новые взгляды на значение для старения и продолжительности жизни закономерностей клеточной пролиферации. На основании подсчета числа делений фибробластов, высеваемых в культуру ткани от эмбриона человека и от людей в возрасте 20 лет и выше, было сделано заключение о пределе клеточных делений(лимит Хейфлика), которому соответствует видовая длительность жизни. Показано, что фибробласты мыши способны удваивать свою численность 14—28 раз, цыпленка —15—35, человека—40—60, черепахи—72—114 раз. Проверка результатов, о которых идет речь, выявила, что представление об ограниченности числа клеточных делений в индивидуальном развитии является неточным. В опухолях атипичные клетки делятся митотическим способом. В результате деления образуются идентичные измененной клетки. Деление происходит многократно. В итоге опухоль быстро растет. Для оценки пролиферативной активности (интенсивность деления клеток) ткани необходимо определить митотический индекс. Митотический индекс чаще всего определяется соотношением числа клеток, находящихся в митозе, к общему числу учтенных клеток исследуемой ткани. Кроме того, производится подсчет клеток, находящихся на разных стадиях фаз митоза, что позволяет определить относительную длительность различных фаз митоза к проценту от общего количества клеток, вступивших в митоз. Подсчет клеток на разных фазах митотического цикла проводят в нескольких полях зрения, при этом препарат необходимо передвигать последовательно через одно поле в сторону и затем снизу вверх и т.д., чтобы избежать просмотра одного и того же поля дважды. Данные по подсчету клеток по полям зрения заносятся в таблицу по каждой стадии митоза, а затем суммируются. Радиоавтография, определение, история. Метод радиоавтографии основан на введении в исследуемый объект соединения, "меченого" радиоактивным атомом и выявлении места его включения путем фотографической регистрации излучения. Основой получения изображения является воздействие ионизирующих частиц, образующихся при распаде радиоактивного атома, на ядерную фотоэмульсию, содержащую кристаллы галоидного серебра. Открытие метода радиоавтографии напрямую связано с открытием явления радиоактивности. В 1867 году было опубликовано первое наблюдение о влиянии солей урана на галогениды серебра (Niepce de St.Victor). В 1896 году Генри Беккерель наблюдал засвечивание фотопластинки солями урана без предварительной экспозиции на свету. Этот эксперимент считается моментом открытия явления радиоактивности. Радиоавтографию применительно к биологическому материалу впервые использовали Лакассань и Латтье (Lacassagne, Lattes 1924) в 20-х годах прошлого века; гистологический блок от различных органов животных после введения им изотопов прижимали плоской стороной к рентгеновской пластинке и экспонировали. Заранее получали гистологический срез и подвергали стандартной процедуре окраски. Полученный автограф изучали отдельно от среза. Этот метод позволяет оценить интенсивность включения изотопа в биологический образец. В сороковых годах Леблон использовал радиоавтографию для демонстрации распределения изотопа иода в срезах щитовидной железы (Leblond C.P. 1943). Первые попытки сочетать радиоавтографию с электронной микроскопией были сделаны в 50-е годы (Liquir-Milward, 1956). Электронно-микроскопическая радиоавтография представляет собой частный случай обычной радиоавтографии, при котором также подсчитываются зерна серебра и учитывается их распределение. Особеннось метода состоит в применении очень тонкого слоя эмульсии. В настоящее время достигнуто разрешение около 50 нм, что в 10-20 раз выше в сравнении со световой микроскопией. В настоящее время метод радиоавтографии дополнен возможностью автоматической оценки количества зерен серебра с помощью видеоанализаторов. Часто для усиления сигнала метки (как правило это изотопы с высокими энергиями) применяются различные виды сцинтиляторов, нанесенные на пластины (усиливающий экран с фосфорным покрытием), или импрегнированные в эмульсию (PPO) – в таком случае излучение фотонов засвечивает обычную фотопластину или фотопленку. Радиоавтография – один из основных количественных методов изучения метаболических процессов без нарушения целости клетки и клеточных структур, объединяющий принципы морфологического и биохимического анализов. Он позволяет локализовать с помощью радиоактивных изотопов биохимические процессы, протекающие в клетках, и изучать таким образом жизнедеятельность последних. Метод основан на введении в исследуемый объект радиоактивного метаболита («метки») и выявлении места его включения путем фотографической регистрации излучения. Наиболее крупные успехи в изучении клеточного цикла были достигнуты благодаря использованию в радиоавтографии специфического предшественника ДНК – тимидина, меченного тритием. Тритий (Н) — единственный радиоактивный изотоп водорода; период его полураспада равен приблизительно 12,5 г. Возникающие при распаде трития ß-частицы обладают малой энергией и как следствие – небольшой длиной пробега в фотоэмульсии (1-2 мк). Практически это означает, что если в исследуемом биологическом объекте два точечных источника излучения отстоят друг от друга на 1 мк, то на автографе они будут выявлены как два отдельных зерна фотоэмульсии. Тимидин – один из четырех нуклеозидов, участвующих в образовании полинуклеотидной структуры ДНК, который характерен только для молекулы ДНК, вследствие чего он является ее специфическим предшественником. Помимо избирательности в отношении ДНК, к числу достоинств Н-тимидина как меченого индикатора относятся его доступность для тканей, быстрота включения в структуры, синтезирующие ДНК, и кратковременное (не более нескольких минут) пребывание в свободном состоянии в организме животных. Существенным обстоятельством является также стабильность образующейся метки, которая, как будет ясно из дальнейшего, может быть «разбавлена» лишь в ходе последовательных клеточных делений 21. Регуляция клеточной активности. Гибель клеток – как нормальный физиологический процесс Регуляция клеточной активности ????? Гибель (смерть) отдельных клеток или целых их групп постоянно встречается у многоклеточных организмов, также как гибель одноклеточных организмов. Причины гибели, процессы морфологического и биохимического характера развития клеточной смерти могут быть различными. Но все же их можно четко разделить на две категории: некроз (от греч. nekrosis - омертвление) и апоптоз (от греч. корней, означающих «отпадение» или «распадение»), который часто называют программируемой клеточной смертью (ПКС) или даже клеточным самоубийством (рис. 354).
|