химия. Бланк выполнения задания 3
 Скачать 36.42 Kb. Скачать 36.42 Kb.
|
Бланк выполнения задания № 31. Записываются условия задач полностью, без искажений и сокращений. 2. Оформляются подробные решения задач, которые при необходимости подкрепляются формулами, уравнениями реакций, схемами. 3. Записываются ответы к задачам. Задача 1. Рассчитать массу и объем 1024 молекул азота при температуре 2500 С и давлении 170,5 кПа Решение. 1 моль вещества содержит 6,02*1023 (число Авогадро) молекул. Тогда 1024 молекул азота содержатся в 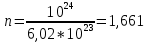 моль азота. моль азота.Молярная масса азота равна 14,007*2 = 28,01 г/моль. Тогда масса 1024 молекул азота равна  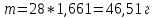 Объём 1024 молекул азота вычислим по уравнению Менделеева – Клапейрона: PV = nRT, отсюда 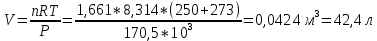 Ответ: 46,51 г; 42,4 л. Задача 2. В какой массе NаОН содержится столько же эквивалентов, сколько и в 140 г КОН? Решение. Молярная масса КОН равна 56 г/моль. В 140 г КОН содержится 140/56 = 2,50 моль. Молярная масса NаОН равна 40 г/моль Тогда масса 2,50 моль NаОН равна 2,50*40 = = 100 г Ответ: 100 г. Задача 3. По порядковому номеру элемента составить электронную формулу его атома. Определить природу элемента и валентные электроны. Указать квантовые числа для трех последних электронов. Охарактеризовать местоположение в периодической таблице Д. И. Менделеева. Сравнить электроотрицательности, атомные радиусы и энергии ионизации между элементом и соседними элементами в группе и периоде. Определить состав атома (количество электронов, протонов и нейтронов). 81, 39. Решение. В соответствии с принципом наименьшей энергии порядок заполнения атомных орбиталей для элемента 81 имеет вид: 1s22s22р63s23р64s23d104р65s24d105p66s24f145d106p1. Так как последним заполняется p-подуровень, то элемент является p-элементом и его валентными электронами будут 6s26p1:
Квантовые числа 6s-электронов: главное n=6; орбитальное l = 0; магнитное ml = 0; спин s = +1/2 и –1/2 соответственно. Квантовые числа 6р-электрона: главное n=6; орбитальное l =1; магнитное ml = –1 (первое из возможных); спин s = +1/2 или –1/2 соответственно. Элемент 81 находится в 13 группе 6 периода Периодической системы элементов, это таллий. В пределах периода энергия ионизации и электроотрицательность возрастают слева направо, поэтому энергия ионизации и электроотрицательность элемента 81 будут выше, чем у элемента 80, но ниже, чем у элемента 82. В пределах группы энергия ионизации и электроотрицательность убывают сверху вниз, поэтому энергия ионизации и электроотрицательность элемента 81 будут ниже, чем у его соседа сверху, но выше, чем у соседа снизу. Атомные радиусы в пределах периода снижаются с увеличением заряда ядра, поэтому радиус атома элемента 81 будет выше, чем у элемента 82, но ниже, чем у элемента 80. В пределах группы атомные радиусы возрастают сверху вниз, поэтому радиус атома нашего элемента 81 будет выше, чем у его соседа сверху, но ниже, чем у соседа снизу. Природный таллий состоит из двух стабильных изотопов: 205Tl и 203Tl . Число протонов и электронов в атомах обоих изотопов равно порядковому номеру элемента 81. Число нейтронов равно разности массового числа и заряда ядра (порядкового номера, или числа протонов). Для 205Tl число нейтронов равно 205 – 81 = 124, а для 203Tl число нейтронов равно 203 – 81 = 122. В соответствии с принципом наименьшей энергии порядок заполнения атомных орбиталей для элемента 39 имеет вид: 1s22s22р63s23р64s23d104р65s24d1. Так как последним заполняется d-подуровень, то элемент является d-элементом и его валентными электронами будут 5s24d1:
Квантовые числа 5s-электронов: главное n=5; орбитальное l = 0; магнитное ml = 0; спин s = +1/2 и –1/2 соответственно. Квантовые числа 4d-электрона: главное n=4; орбитальное l =2; магнитное ml = –2 (первое из возможных); спин s = +1/2 или –1/2 соответственно. Элемент 39 находится в 3 группе 4 периода Периодической системы элементов, это иттрий. В пределах периода энергия ионизации и электроотрицательность возрастают слева направо, поэтому энергия ионизации и электроотрицательность элемента 39 будут выше, чем у элемента 38, но ниже, чем у элемента 40. В пределах группы энергия ионизации и электроотрицательность убывают сверху вниз, поэтому энергия ионизации и электроотрицательность элемента 39 будут ниже, чем у его соседа сверху, но выше, чем у соседа снизу. Атомные радиусы в пределах периода снижаются с увеличением заряда ядра, поэтому радиус атома элемента 39 будет выше, чем у элемента 40, но ниже, чем у элемента 38. В пределах группы атомные радиусы возрастают сверху вниз, поэтому радиус атома нашего элемента 39 будет выше, чем у его соседа сверху, но ниже, чем у соседа снизу. Иттрий — моноизотопный элемент, в природе представлен одним стабильным нуклидом 89Y. Число протонов и электронов в атоме иттрия равно порядковому номеру элемента 39. Число нейтронов равно разности массового числа и заряда ядра (порядкового номера, или числа протонов). Для иттрия число нейтронов равно 89 – 39 = 50. Задача 4. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Написать термохимическое уравнение этой реакции и вычислить ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака (н. у.)? Решение. Термохимическое уравнение реакции: NH3(Г) + HCl(Г) = NH4Cl(KP) + Q Для расчёта теплового эффекта выпишем из термодинамических таблиц стандартные энтальпии образования компонентов реакции: ΔН0обр (NH3(г)) = –45,94 кДж/моль ΔН0обр (HCl(г)) = –92,31 кДж/моль ΔН0обр (NH4Cl(кр)) = –314,22 кДж/моль Тогда в соответствии с законом Гесса изменение энтальпии в ходе реакции равно: ΔН0р = ΔН0обр.NH4Cl + ΔН0обр.Н2 – (ΔН0обр.HCl + ΔН0обр.NH3) ΔН0р = –314,22 – ((-92,31) + (-45,94)) = -175,97 кДж/моль Тогда тепловой эффект реакции равен Q = – ΔН0р = 175,97 кДж/моль Тогда термохимическое уравнение реакции будет выглядеть так: NH3(Г) + HCl(Г) = NH4Cl(KP) + 175,97 кДж/моль 1 моль аммиака при н.у. занимает объём 22,4 л. Тогда при расходе 10 л аммиака выделится теплоты 175,97*10/22,4 = 78,56 кДж Ответ: 78,56 кДж Задача 5. Рассчитать изменение стандартной свободной энергии Гиббса и сделать вывод о направлении процесса при указанной температуре. Рассчитать температуру равной вероятности прямого и обратного процессов. Сделать вывод о направлении процесса выше и ниже этой температуры. СО(г) + Н2О(г) ↔ СО2(г) + Н2(г); 6500 С Решение. Из термодинамических таблиц выписываем стандартные энтальпии образования и стандартные энтропии веществ:
Находим стандартные энтальпию и энтропию реакции СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) ΔН0р = ΔН0обр.СО2 + ΔН0обр.Н2 – (ΔН0обр.СО + ΔН0обр.Н2О) ΔН0р = –393,5 + 0 – ((-110,5) + (-241,8)) = -41,2 кДж/моль ΔS0р = S0СО2 + S0Н2 – (S0СО + S0Н2О) ΔS0р = 213,6 + 130,1 – (197,4 + 189) = -42,7 Дж/(моль*К) Находим стандартную энергию Гиббса: ΔGоp = ΔН0р – T* ΔS0р ΔGоp = -41,2 – (650+298)*(-42,7*10–3) = -0,720 кДж/моль = -720 Дж/моль<0 Следовательно, при температуре 650оС процесс термодинамически возможен. Находим равновесную температуру: 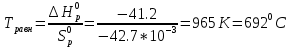 Так как ΔН0р<0 и ΔS0р<0, то прямая реакция возможна при температурах ниже равновесной, то есть прямая реакция возможна до температуры 692 К, а при температуре выше 692 К реакция невозможна. Ответ: ΔGоp = -720 Дж/моль. Реакция возможна при температурах ниже 965 К. Задача 6. При понижении температуры на 200 С скорость гомогенной реакции понизилась в 10 раз. Как изменится скорость данной реакции при увеличении температуры с 70 до 1100 С? Решение. Согласно правилу Вант-Гоффа, отношение констант скорости реакции k2 и k1, определенных при двух различных температурах Т2 и Т1, равно 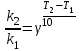 . . Подставим в это уравнение данные из условия задачи и решим его относительно γ: 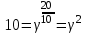 , ,Отсюда γ = 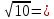 3,162 3,162Тогда при увеличении температуры с 70 до 1100С 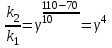 = 102 = 100 = 102 = 100Ответ: Скорость реакции увеличится в 100 раз. |
