Будова твердої речовини. Основні поняття та визначення
 Скачать 1.3 Mb. Скачать 1.3 Mb.
|
|
1.3. Поверхнева енергія Мінімальна енергія, що необхідна для утворення одиниці площі поверхні розділу фаз в умовах постійного об’єму і температури, називається поверхневою енергією чи енергією поверхні розділу. В силу того, що у атомів на поверхні з однієї сторони відсутні сусідні атоми, їх енергія більша, ніж у атомів усередині гратки. Надлишок енергії атомів на поверхні є причиною виникнення поверхневої енергії. Поверхнева енергія відіграє значну роль у процесах нанесення покриття. Поверхнева енергія твердої кристалічної основи, на яку наносять покриття, характеризується анізотропією. Анізотропія визначається розташуванням атомів по гранях кристалів на поверхні неоднаково для граней з різними індексами. Повна поверхнева енергія кристала визначається сумою поверхневих енергій усіх його граней. Теоретичне та експериментальне визначення величини поверхневої енергії є складною задачею. Найбільш достовірні результати дає визначення її через рівняння, що пов’язують теплоту сублімації з ближнім порядком у кристалі. Ця теорія використовується здебільше для оцінки поверхневої енергії металів і оксидів. Мірою сил міжатомного зчеплення твердого тіла може служити енергія зв’язку, або, що те ж саме, енергія атомізації 13 Величину Розглянемо кристал, що містить один моль речовини, з координаційним числом Z. У ньому міститься N атомів, а кількість зв’язків дорівнює 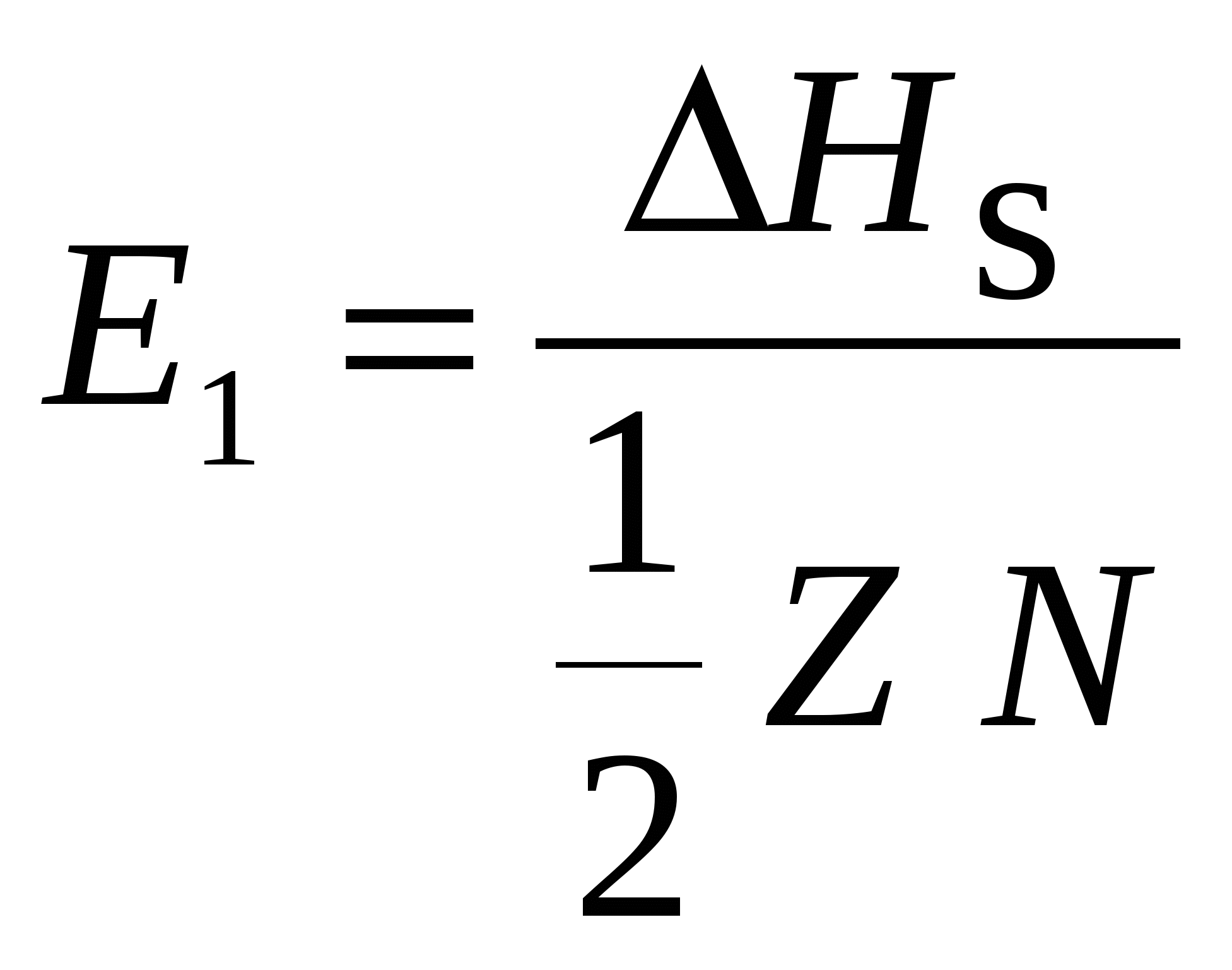 (1.1) (1.1)Розглянемо кристали з ГЦК гратками. Нехай поверхня відколу кристала утворить площину (111). Кожен атом на площині (111) зв’язаний із шістьма сусідніми атомами на цій площині, трьома атомами нижньої площини і з трьома атомами на верхній площині. Тому при утворенні поверхні розриваються по три зв’язки у кожному атомі. Однак при розколюванні утворюються дві поверхні, і кількість розірваних зв’язків на кожний атом дорівнює 3/2. Таким чином, для утворення поверхні на кожний атом необхідно витратити енергію: Якщо на площині (111) міститься 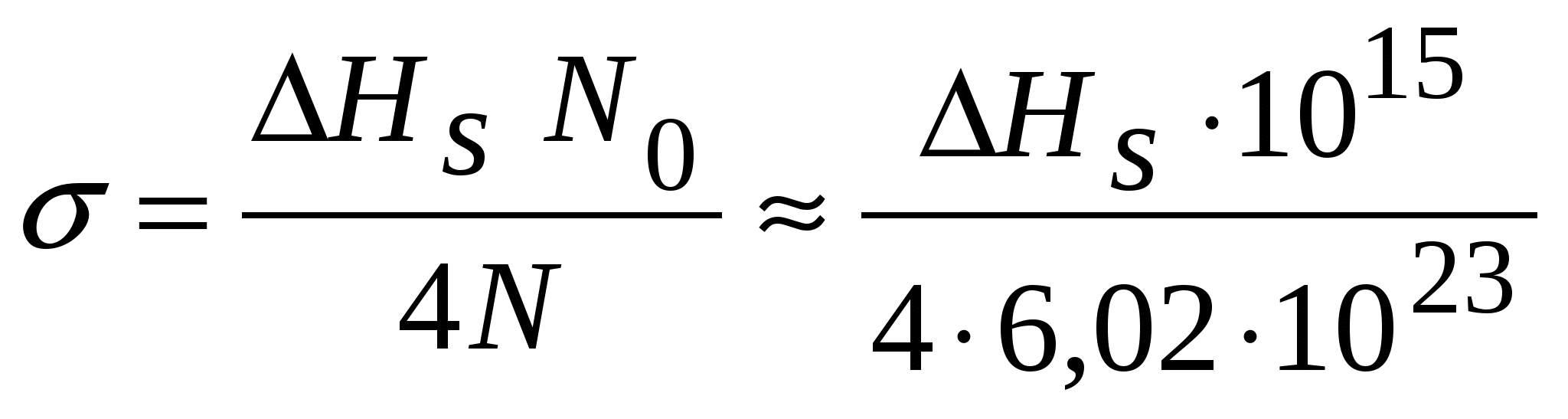 . (1.3) . (1.3)Для типових атомів з діаметром близько 0,3 нм величина При кристалізації і при поліморфних перетвореннях у твердому стані, тобто коли відбувається упорядкування чи перебудування гратки металу, поверхнева енергія змінюється стрибком. Зв’язок між цими величинами виражається залежністю: 14 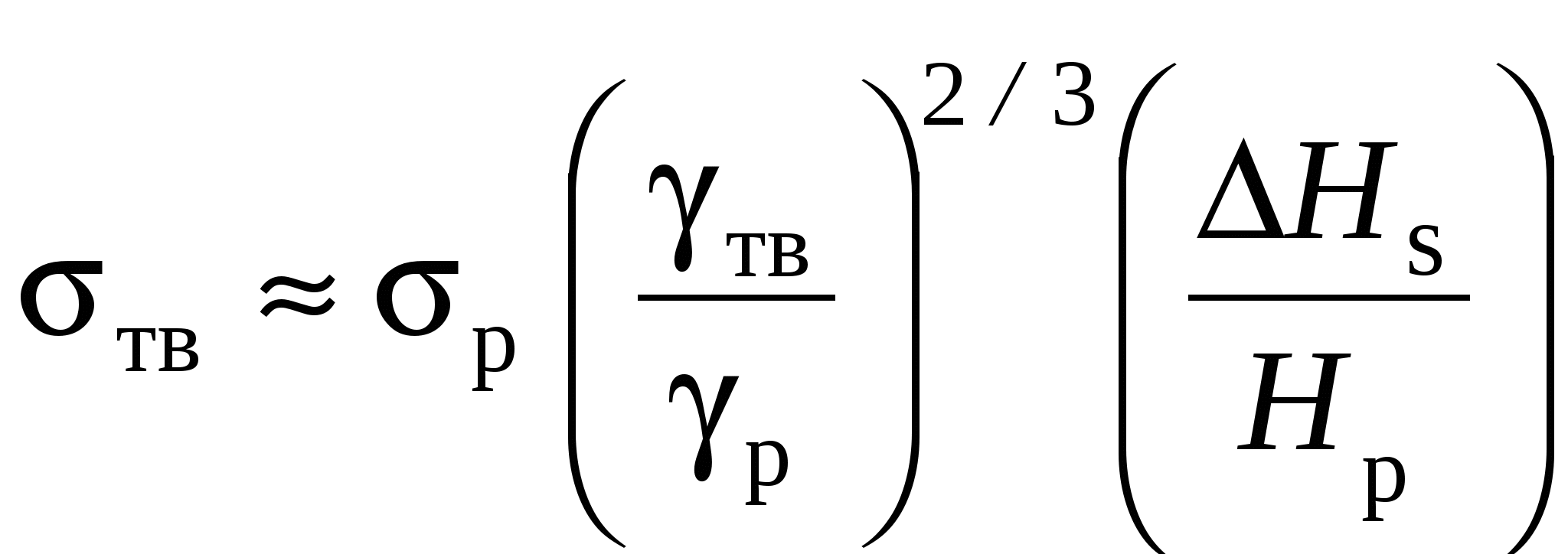 , (1.4) , (1.4) де Для грубих оцінок можна приймати, що при твердінні поверхнева енергія твердого металу Поверхнева енергія – важлива характеристика, від якої залежить протікання багатьох процесів. Вона визначає змочування і адгезію матеріалів у рідкофазних процесах, таких як наплавлення, паяння, оплавлення покриття і його просякання розплавами. Від поверхневої енергії залежать міцність зчеплення, зародження і ріст покриття при його нанесенні вакуумними методами. Вона визначає ймовірність утворення зародків нової фази при фазових переходах у хімічних реакціях і при кристалізації. При рості кристалів ймовірність утворення зародків залежить від того, чи можуть зародки збільшуватися до критичних розмірів, а їх росту перешкоджає, головним чином, загальне збільшення вільної енергії за рахунок поверхневої енергії виникаючих і зростаючих зародків. Змочування твердого тіла характеризується крайовим кутом змочування, що визначається широко відомими термодинамічними рівняннями, які включають поверхневу енергію і енергію поверхні розділу твердої і рідкої фаз. Мимовільне розтікання рідини по поверхні твердого тіла зумовлено зменшенням вільної енергії. Воно відбувається тоді, коли величина поверхневої енергії твердого тіла перевищує суму поверхневої енергії рідини і енергії поверхні розділу між твердим тілом і рідиною. 1.4. Адсорбція Адсорбція – це здатність твердого тіла – адсорбенту – утримувати на своїй поверхні атоми і молекули іншої речовини – адсорбата. Адсорбція відбувається під дією некомпенсованих сил міжатомної взаємодії в поверхневому шарі адсорбенту, які притягають молекули адсорбата з приповерхньої області. Адсорбція зменшує поверхневу енергію адсорбенту і є початковою стадією процесу взаємодії між твердою речовиною і газом. 15 У середньому на 1 Прийнято розрізняти фізичну і хімічну адсорбцію. При фізичній адсорбції адсорбований шар зв’язаний з поверхнею твердого тіла, наприклад, силами Ван-дер-Ваальса, а при хімічній адсорбції (скорочено хемосорбції) – силами хімічних сил зв’язку, що виникають у результаті хімічної взаємодії адсорбата з поверхнею твердого адсорбенту. Існує ряд ознак, за якими прийнято відрізняти хімічну адсорбцію від фізичної. Звичайним критерієм є розходження в теплоті адсорбції. Теплота фізичної адсорбції, зазвичай, не перевершує 40 кДж/моль. Оскільки хімічні зв’язки міцніші, теплота хемосорбції сягає в окремих випадках 400 кДж/моль і більше. Фізична адсорбція оборотна, а хемосорбція в більшості випадків буває необоротною. Фізична адсорбція протікає майже миттєво, як тільки молекули газу стикаються з твердою поверхнєю, і є процесом, який не активується. При хемосорбції реакція може протікати повільно, оскільки пов’язана з визначеною енергією активації. Тому хемосорбцію іноді називають активованою адсорбцією. Однак при взаємодії газів з чистими металевими поверхнями спостерігається дуже швидка хемосорбція. В цих умовах зв’язки атомів на поверхні металу не насичені і хемосорбція протікає без помітної енергії активації. Ще однією відмінністю хемосорбції є її залежність від кристалографічної орієнтації зерен, наявності на поверхні дефектів та ін. Вона починається і переважно розвивається на “активних” місцях і ділянках поверхні. При зменшенні тиску газу фізична адсорбція зменшується. Хемосорбція –менш чутлива до тиску. Крім того, прийнято вважати, що хемосорбція відбувається тільки доти, доки вся поверхня не покриється мономолекулярним шаром адсорбата. При підвищенні температури фізична адсорбція може переходити в хемосорбцію. Для цього необхідно, щоб теплова енергія системи перевищувала енергію активації процесу хемосорбції. При постійній температурі, чим вище тиск чи концентрація речовини, що адсорбується, тим більша її кількість на поверхні твердого тіла. Коли адсорбент контактує з газом, кількість адсорбованої речовини зростає, а концентрація навколишніх його молекул зменшується доти, доки швидкість десорбції не буде дорівнювати швидкості адсорбції, тобто доки не встановиться адсорбційна рівновага. Рівновага може зрушитися. Наприклад, якщо збільшити тиск (чи концентрацію) газу, то кількість адсорбованої речовини зростає до нового рівноважного значення. Якщо ж тиск зменшити, то адсорбент буде виділяти адсорбовану речовину доти, доки знову не встановиться адсорбційна рівновага. 16 Зсув рівноваги використовують у технології покрить для очищення поверхні виробу перед нанесенням покриття. Для очищення поверхні тиск знижують, а основу підігрівають. Насьогодні у спеціальній апаратурі одержують вакуум до Перехід від фізичної до хімічної адсорбції можна проілюструвати на основі схематичної діаграми потенційної енергії розглянутої системи (рис. 1.7). Діаграма дає якісну уяву про зміну енергії такої системи при фізичній і хімічній адсорбції. Точка рівноваги недисоційованої молекули з енергією фізичного зв’язку 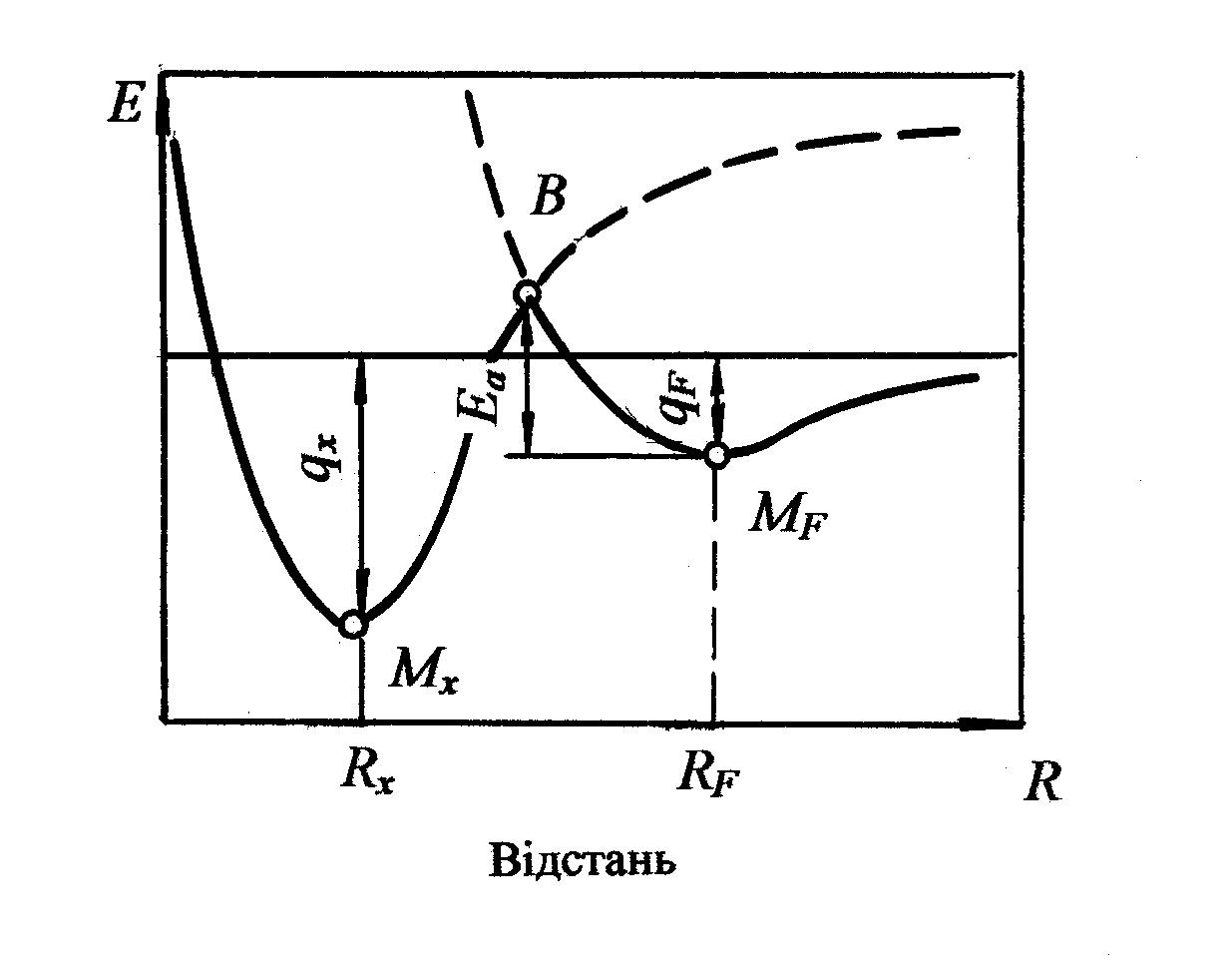 Рис. 1.7. Зміна потенційної енергії системи Е при фізичній і хімічній адсорбції З діаграми видно, що для переходу від стану фізичної адсорбції з енергією чи теплотою адсорбції Для того, щоб від фізичної адсорбції 17 Енергію активації десорбціїтакож можна визначити з діаграми потенційної енергії “адсорбент – речовина, яка адсорбується”. Ця енергія активації дорівнює різниці енергій у точках Типовим прикладом взаємодії газу з поверхнею твердого тіла є окислювання металів. Для більшості металів енергія активації хемосорбції кисню мала. У результаті значної стабільності комплексу адсорбції кисню на металах, енергія активації десорбції в цьому випадку значно вище енергії активації хемосорбції. Останню часто можна не враховувати, і тоді енергія активації десорбції починає дорівнювати енергії (теплоті) адсорбції 1.5. Окислення Речовини і матеріали, які застосовуються у техніці, навіть дуже чисті, завжди містять деяку кількість чужорідних атомів. Ці домішкові атоми, виявляючись на поверхні, відіграють роль хімічних дефектів. Елемент, що є присутнім у металі в невеликих кількостях, часто може концентруватися на поверхні, впливаючи на її стан і енергію. Особливо велика роль хімічних дефектів у процесах окислення металів. Оскільки перебудова поверхні і приповерхнього шару металу не приводить до повної втрати її хімічної активності, в умовах навколишнього середовища метали швидко вкриваються тонким шаром оксидів товщиною від декількох десятків до декількох сотень ангстрем. Блиск металевої поверхні не зникає до товщини плівки оксидів 100 Розміщення металу в досить глибокий вакуум ( Тільки золото, платина, срібло не мають на поверхні оксидних плівок при звичайних температурах. Вони покриті так званим комплексом адсорбції кисню. Комплекс адсорбції відрізняється від оксиду структурою і міцністю хімічних зв’язків і може бути цілком вилучений нагріванням твердого тіла. Властивості металевої поверхні, вкритої шаром адсорбованого кисню, відрізняються від властивостей поверхні металу, вкритої оксидом. Будова адсорбованої плівки двовимірна, тобто атоми кожного виду мають кількість сусідів, що відрізняється від їх кількості в оксидній плівці. 18 Плівку хемосорбованого кисню необхідно розглядати як хімічну речовину з визначеною структурою і термодинамічними . константами, здатну до участі в рівноважних процесах. Дуже важливою особливістю цієї плівки є те, що вона зв’язана з металевою основою. Адсорбована плівка містить у собі не тільки атоми адсорбованої речовини, але і поверхневі атоми металу. Ці атоми зв’язують тверде тіло з адсорбованою речовиною і тому знаходяться в зовсім іншому стані, ніж атоми в об’ємі твердого тіла. З боку атмосфери плівка вкрита фізично адсорбованим киснем. Хімічний зв’язок між киснем і атомами поверхні металу – іонний. Передача електронів від металу до кисню при утворенні зв’язку призводить до появи негативного заряду на плівці і позитивному заряду на її внутрішній поверхні. Зв’язок між адсорбованим киснем і основою значно сильніший за зв’язок між киснем і металом в оксиді. Дослідження енергії зв’язку металів з киснем при окислюванні, вказують на зменшення теплоти адсорбції із зростанням товщини адсорбованого газу. Найміцніше зв’язані з металом перші шари оксиду. Згідно сучасних уявлень, утворення плівки оксиду починається і проходить через ряд різних адсорбційних станів, характерних для хемосорбції на металевій поверхні. Наприклад, для систем 1) хемосорбція на непорушеній металевій поверхні; 2) атомне перегрупування, при якому поверхневі атоми металу залишають свої місця. Цю стадію називають корозійною хемосорбцією; 3) адсорбція додаткових молекул газу на іонах металу, що виникають внаслідок процесів перебудови при атомному перегрупуванні за п. 2. Стадія атомного перегрупування при хемосорбції азоту й оксиду вуглецю на вольфрамі відбувається вже при кімнатній і навіть більш низькій температурі. Схематично поява плівки оксиду на поверхні металу з хемосорбованого кисню (рис. 1.8, а) можна представити як результат перебудови атомів металу і кисню поблизу поверхні таким чином (рис. 1.8, б), щоб просторовий розподіл цих двох видів атомів був близьким до того, що спостерігається в оксиді. Перебудова припускає міграцію на невеликі відстані поверхневих атомів металу й атомів кисню, що вимагає значної енергії активації. При зміні взаємного розташування атомів відбувається збільшення кількості найближчих сусідів як для атомів металу, так і для атомів кисню. У результаті структура упорядковується, зменшується асиметричність зв’язків метал – кисень в адсорбованій плівці і відновлюється іонний характер зв’язків, який має місце в оксиді. 19 0 0  0   Me Me   Me  0  Me    Me  Me     0 0     Me  Me    Me  Me  Me Me       Me    Me       Me  Me    Me  Me  Me Me     Me     Me   Me Me Me Me a б Рис. 1.8. Схема процесу появи плівки оксиду на поверхні металу: а – стадія хемосорбції; б – стадія перебудови |
