Буферные растворы. Буферные растворы Буферные растворы
 Скачать 88.5 Kb. Скачать 88.5 Kb.
|
|
Буферные растворы Буферные растворы Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию. Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы. Различают в основном протолитические буферные растворы двух типов:
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного кислота основания СН3СООNa → Na+ + CH3COO-
NH3 + H2O ↔ OH- + NH4+ избыток Основание сопряженной NH4Cl → Cl- + NH4+ кислоты Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха: рН = рК + ℓg где рК = -ℓg КД. С – молярная или эквивалентная концентрация электролита (C = V N) Механизм действия буферных растворов Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
CH3COO ‾ +H + ↔ CH3COOH (1) Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным. При добавлении кислоты к буферу рН определяется по формуле: рН = рК + ℓg 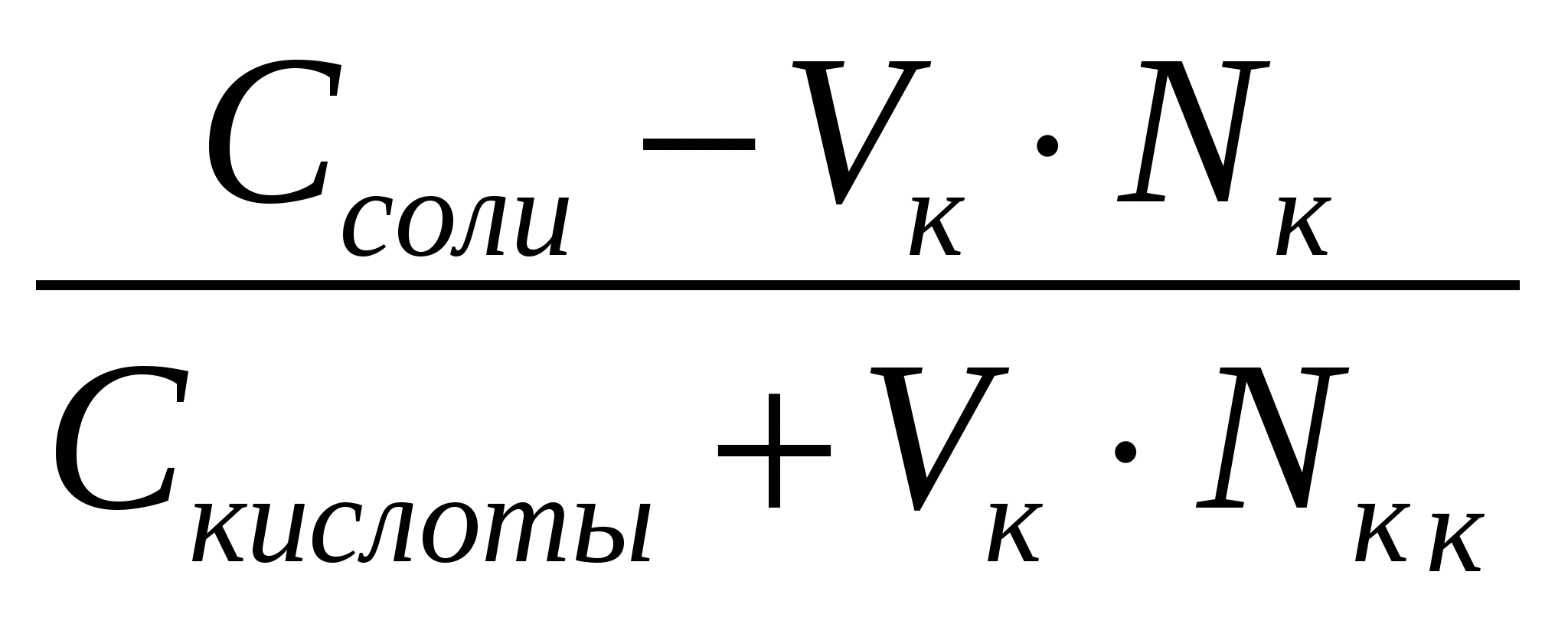
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2) В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным. При добавлении щелочи рН определяется по формуле: рН = рК + ℓg
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице. Для количественной характеристики буфера вводится понятие буферной ёмкости. Буферная ёмкость Это способность буферной системы противодействовать изменению рН среды. Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия. Она равна рН = рК ± 1 Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу. В = В – буферная ёмкость, nЭ – количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи) рНК – конечное значение рН (после добавления кислоты или щелочи) ΔрН – изменение рН. На практике буферная ёмкость рассчитывается по формуле: В = V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.- объём буферного раствора, Δ рН – изменение рН. О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объём чистой воды. Для изменения рН на единицу в кислую область, следует в кровь добавить в 320 раз больше количества соляной кислоты, чем к такому же объёму чистой воды. Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице. Буферная ёмкость артериальной крови 25,3 ммоль/л, венозной – 24,3 ммоль/л, слюна обладает буферной ёмкостью и определяется бикарбонатной, фосфатной и белковой системами. Буферная ёмкость слюны изменяется под влиянием ряда факторов: углеводистая диета снижает буферную ёмкость слюны, высокобелковая диета – повышает её. Поражаемость зубов кариесом меньше у лиц с высокой буферной ёмкостью. В организме человека действуют белковый, гемоглобиновый, фосфатный и бикарбонатный буферы. Буферные системы организма. Бикарбонатный буфер. Он составляет 53 % буферной ёмкости и представлен: Н2СО3 NaHCO3 Соотношение 1 : 20 Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани. Механизм действия.
Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным. Гемоглобиновый буфер Составляет 35 % буферной ёмкости. Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами: HHb ↔ H+ + Hb- HHbO2 ↔ H+ HbO2- Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается. Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СО3 ↔ КНСО3 + ННb. Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот. Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена. В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2. В лёгких: ННb + O2 ↔ HHbO2; HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑ В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3- Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер. Фосфатный буфер Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-. Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1. Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию. Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- : Н + + НРО4 2- ↔ Н2РО4 1- Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи. При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-: ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается. Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче. Белковый буфер Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием. Pt – COOH - белок-кислота Pt – COONa – белок-соль
Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется. Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Рассмотрим взаимодействие буферных систем в организме по стадиям:
ННb + O2 ↔ HHbO2 ↔ Н+ + HbO2-
HbO2-↔ Нb- + О2 Кровь при этом из артериальной становится венозной. Отдаваемый в тканях кислород расходуется на окисление различных субстратов, в результате чего образуется СО2, большая часть которого поступает в эритроциты.
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
Н+ + Нb- → HHb Связывание протонов смещает равновесие реакции стадии (3) вправо, вследствие чего концентрация гидрокарбонат ионов возрастает и они диффундируют через мембрану в плазму. В результате встречной диффузии ионов, отличающихся кислотно-основными свойствами (хлорид-ион протолитически неактивен; гидрокарбонат ион в условиях организма является основанием), возникает гидрокарбонатно-хлоридный сдвиг. Этим объясняется более кислая реакция среды в эритроцитах (рН = 7,25) по сравнению с плазмой (рН = 7,4).
НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2
СО2 + Рt-NH2 ↔ Pt-NHCOOH ↔ H+ + Pt-NHCOO-
Н+ + НРО4- ↔ Н2РО4-
НСО3- + ННbО2 ↔ НbО2- + СО2 + Н2О Образующийся СО2 выводится через легкие. В результате уменьшения концентрации НСО3- ионов в этой части кровеносного русла наблюдаются их диффузия в эритроциты и диффузия хлорид-ионов в обратном направлении.
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-, который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер): H+ + NH3 ↔ NH4+ Таким образом, гемоглобиновая система участвует в двух процессах:
Гемоглобиновую буферную систему можно рассматривать как одно из важнейших звеньев в транспорте СО2 из тканей в легкие. Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др. Кислотно-основное равновесие Кислотно-основное состояние – неотъемлемая составная часть протолитического гомеостаза внутренней среды организма, который обеспечивает оптимальные условия правильного течения обмена веществ. Соотношение определённой концентрации ионов Н+ и ОН- в органах, тканях, жидкостях организма называется кислотно-основным равновесием (КОР). Кислотно – основное равновесие имеет первостепенное значение, так как:
Отклонение рН крови (7,4) на 0,3 ед. может привести к коматозному состоянию, отклонение на 0,4 ед. может повлечь смертельный исход. рН слюны равное 5 ед. приводит к развитию кариеса. Основные показатели КОР.
Возможные причины и типы нарушения КОР организма. Нарушение кислотно-основного состояния возникает в результате нарушения транспорта СО2 в организме или при изменении его концентрации во вдыхаемом воздухе. В зависимости от механизма развития расстройств кислотно-основного состояния выделяют дыхательный и метаболический ацидозы и алкалозы. Метаболический ацидоз характеризуется нарушением метаболизма, которое приводит к нескомпенсированному или частично компенсированому падению рН крови. Метаболический ацидоз некомпенсированный наступает вследствие: а) избыточного введения или образования стойких кислот (поступление кетокислот при голодании и диабете, б) повышеное образование молочной кислоты при шоке, в) задержка фосфатов, сульфатов, анионов органических кислот в результате снижения величины клубочковой фильтрации в почках, г) избыточной потери гидрокарбонат-иона в результате поноса, колита, язвы кишечника. Процессы компенсации связаны с нейтрализацией ионов водорода гидрокарбонат-ионом и усилением лёгочной вентиляции. Метаболический алкалоз характеризуется нарушением метаболизма, которое приводит к некомпенсируемому или частично компенсируемому увеличению рН крови. Метаболический алкалоз наступает в результате: а) потери водородных ионов (высокая кишечная непроходимость, неукротимая рвота и др.); б) увеличение концентрации гидрокарбоната (потеря воды, избыточное введение гидрокарбонат-ионов при метаболическом ацидозе, введение солей органических кислот – молочной, уксусной, лимонной, метаболизирующих с поглощением ионов водорода и др.), в) избыток выведения ионов калия при повышенной секреции минералокортикоидов Компенсации этого явления достигают снижения лёгочной вентиляции (задержка СО2), удалением гидрокарбонат-иона почками. Дыхательный ацидоз – это нескомпенсированное или частично компенсированное снижение рН в результате гиповентиляции из-за: а) заболевания лёгких или дыхательных путей (пневмония, отёк лёгких, инородные тела в верхних дыхательных путях и т.д.); б) повреждения (заболевания) дыхательной мускулатуры в) угнетении дыхательного центра лекарственными средствами или наркотиками – опиатами, барбитуратами и т.п. Дыхательный алкалоз – это нескомпенсированное или частично компенсированное повышение рН в результате гипервентиляции из-за лихорадочного состояния или истерии. Процессы компенсации осуществляются буферными системами, повышенным выведением гидрокарбонат-иона почками. При нарушении КОР в организме быстро включается буферная компенсация (через 10-15 мин). Легочная компенсация развивается в норме в течение 10-18 часов и заключается в стабилизации отношения [HCO3‾]/[ Н2СО3] путем изменения объёма легочной вентиляции. Почечная компенсация связана с включением ряда дополнительных ферментативных процессов, поэтому она развивается в течение 2-3 суток. Применение реакции нейтрализации в фармакотерапии. Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований. В основе фармакологических действий лежит реакция нейтрализации. Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Второе эффективное средство – трисамин 3,66%, который связывает избыточные протоны. Он эффективен только при внутривенном введении. Также в качестве средства, коррегирующего ацидоз, используют лактат натрия 11% раствор. Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства, нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия. |
