ретинол ацетат. Цели и задачи исследования 4
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
1 2 ГЛАВА 2ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ2.1. Материалы и оборудования Для решения поставленных задач нами использовано следующее оборудование: Спектрофотометр ПЭ – 5400В Водяная баня Центрифуга Центрифужные пробирки 10мл. Этиловый спирт 96% 25%-ный водный раствор аскорбиновой кислоты 10N раствор КОН Гексан, ч.д.а. Масляный раствор ретинола ацетата, производитель ООО «Полисинтез», с массовой долей вещества 3,44%. Одна капля масляного раствора содержит 0,9 мг ретинола ацетата. 2.2. Спектрофотометрическое определение жирорастворимых витаминов Использованная нами методика предназначена для определения жирорастворимых витаминов в биологических тканях. Пробоподготовка состоит из двух этапов: омыление и экстрагирование. Для этого из образца тканей готовят гомогенат на дистиллированной воде в соотношении 1:3. В пробирку с подготовленной смесью этилового спирта (1мл) и 25-%-ного водного раствора аскорбиновой кислоты (0,5мл) вносят 1мл полученного гомогената. После предварительного прогрева проб до 700С в течение 5минут, в смесь приливают 1мл 10N раствора КОН и нагревают на водяной бане в течение 30минут при 700С для омыления липидов, мешающих определению витаминов и каротиноидов. По окончании нагрева пробы охлаждают под струей холодной воды, приливают 4 мл гексана, энергично встряхивают до однородной эмульсии в течение 1 минуты, после чего центрифугируют 15 минут при 1000 об/мин.для отделения гексановой фракции, содержащей каротиноиды и витамины [28]. Для оределения ретинола снимают оптическую плотность гескановой фракций при длине волны 328нм. 2.3 Построение градуировочного графика Градуировочные графики строят, пользуясь эталонными растворами чистых веществ. Для построения графика необходимо приготовить 5 – 10 растворов с различной концентрацией эталонного вещества с таким расчетом, чтобы это число растворов охватило весь интервал, в пределах которого может изменяться концентрация определяемого вещества. Для построения градуировочного графика использовали масляный раствор ретинола ацетата с массовой долей 3,44 %. Готовили серию растворов с различным содержанием ретинола ацетата. Для этого пипеткой отмеряли масляный раствор витамина в пять пробирок по 1, 2, 3, 4, 5 капель и доводили каждую дистиллированной водой до 1 мл. Таким образом мы получали пробы с концентрацией ретинола ацетата 0,675; 1,350; 2,050; 2,725 и 3,400 мкмоль/см3 . Все дальнейшие операции проводили в соответствии с методикой, которая описана выше. Все определения проводили в пяти повторах и получали пять серий растворов. Для уточнения оптимальной длины волны нами предварительно был снят спектр гексанового экстракта. Результаты, полученные опытным путем совпадают с теоретическим. Поэтому оптическую плотность гексановой фракций определяли при длине волны 328нм. Таблица 2.1. Значения оптической плотности для построения градуировочного графика
A c  М(ретинола ацетата) = 328,5г/моль М(ретинола ацетата) = 328,5г/моль1 капля ретинола ацетата - 3000МЕ (0,9мг) 1 капля = 0,9 мг : 2,7 мкмоль :0,625 мкмоль/см3 2 капли = 1,8 мг : 5,4 мкмоль : 1,35 мкмоль/см3 3 капли = 2,7мг : 8,2 мкмоль : 2,05 мкмоль/см3 4капли = 3,6 мг : 10,9 мкмоль : 2,725 мкмоль/см3 5 капель = 4,5 мг : 13,6 мкмоль : 3,4 мкмоль/см3 По полученный значениям оптических плотностей построен градуировочный график А 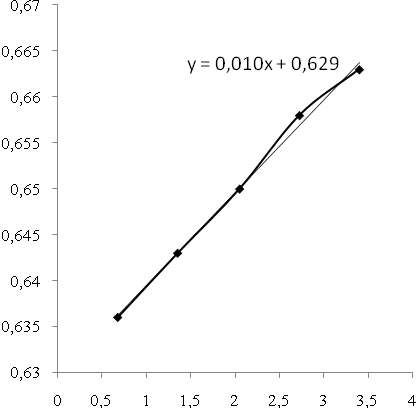 С, мкмоль/см3 Рис. 2.1. График зависимости оптической плотности от концентрации. Калибровочный график описывается уравнением: где y-оптическая плотность, полученная в результате измерений; x 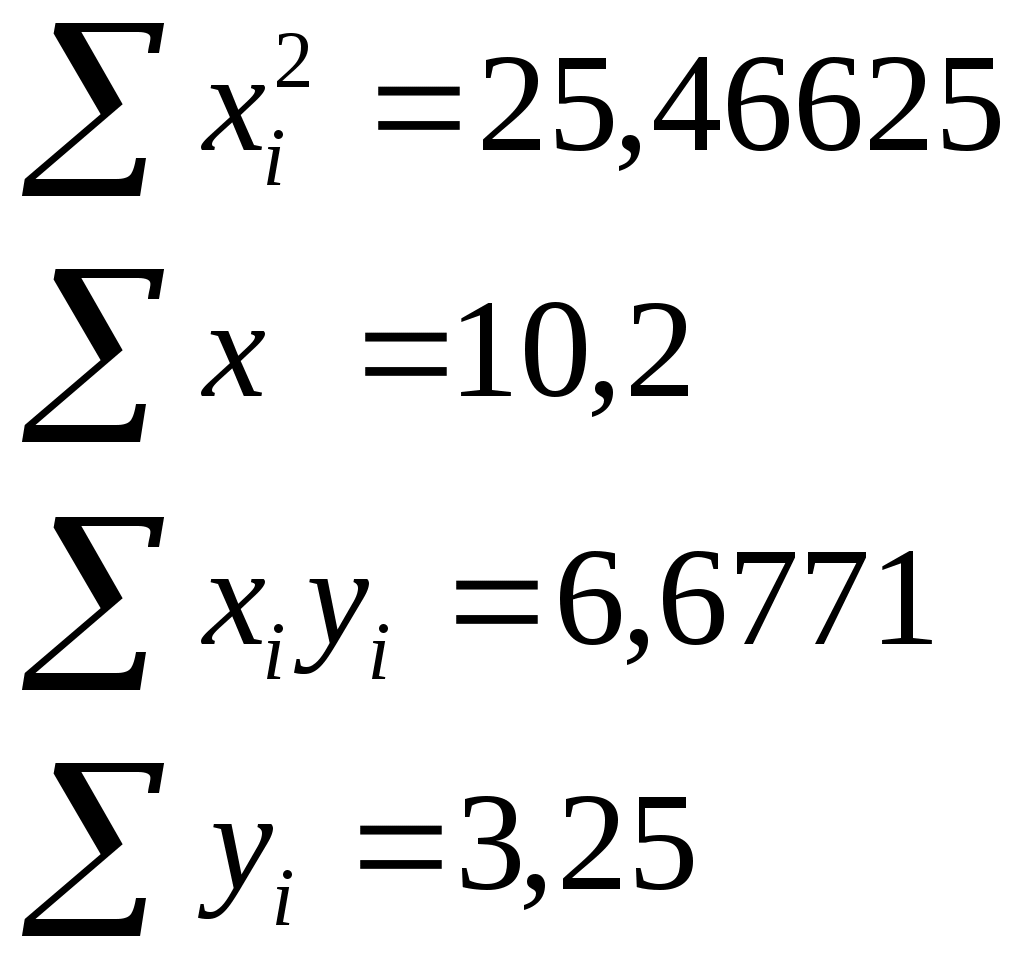 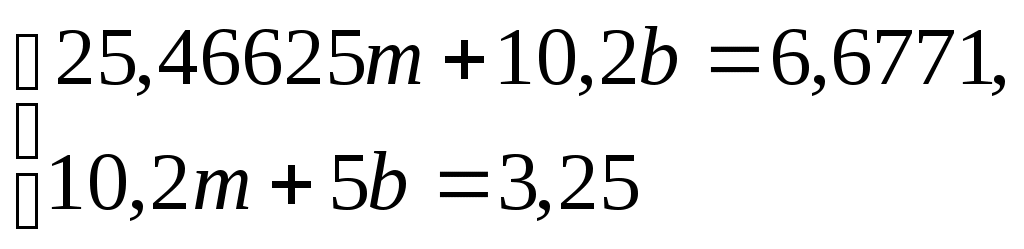 b=0,65 – 2,04m, 25,46625m + 6,63 – 20,808m = 6,6771 4,66825m = 0,0471 m = 0,01 b=0,629 y=0,01х + 0,629. По графику видно, что закон Бугера-Ламберта-Бера соблюдается в диапазоне концентраций 0,9 до 4,5 мг в пробе или 0,675 до 3,4 мкмоль/см3, что позволяет использовать методику для количественного определения ретинола ацетата. 2.2.1 Определение содержания жирорастворимых витаминов в тканях мозга белых крыс Опыты проводили на лабораторных белых крысах, средней массой 180 – 220г. Животные, как контрольные, так и опытные, получали пищу в последний раз за 12 часов до начала эксперимента. Экспериментальные исследования на животных проводились в осенний период с целью исключения влияния сезонных ритмов. Животные содержались в условиях вивария на стандартном рационе. Перед взятием в опыт они проходили карантин в специальном помещении вивария. Животные с подозрением на спонтанную патологию выбраковывались. Для исследования использовали плазму крови и ткани мозга белых крыс, которые были разделены на группы: 1 – контроль (без воздействия) 10 животных; 2 – ингаляторное воздействие природным сероводородсодержащим газом в дозе 150 мг/м3 по H2S (экспозиция 240 минут). Затравку производили в течении 6 недель, 5 дней в неделю (понедельник-пятница); 10 животных; 3 – введение per os в течение 14 дней (за две недели до декапитации) 5% масляного раствора D,L,α – токоферол ацетата в дозе 1 мг/100г массы тела; 10 животных; 4 – введение внутримышечно в течении 14 дней (за 2 недели до декапитации) 1% раствора эмоксипина в дозе 0,5 мг/100г массы тела; 10 животных. Декапитацию животных осуществляли под хлоралгидратным наркозом. После декапитации собирали кровь в пробирки, обработанные гепарином, центрифугировали и отбирали плазму для анализов. Мозг препарировали, выделяя на холоде следующие отделы: большие полушария, промежуточный, средний, продолговатый отделы, мозжечок, спинной мозг. Выделенные препараты мозга помешали в индивидуальных пакетах с маркировкой в морозильную камеру до проведения исследований. В день измерений готовили на фосфатном буфере гомогенаты тканей мозга перечисленных отделов. Для этого отвешивали 250 мг ткани, измельчали ее ножницами до кашицеобразной массы и гомогенизировали растиранием в фарфоровой ступке. Все операции с биоматериалом проводили в кратчайшие сроки. Полученный гомогенат доводили дистиллированной водой до объема 1 мл и проводили минерализацию и экстрагирование как указано в методике [28]. Полученные гексановые экстракты спектрофотометрировали в кюветах с толщиной светопропускающего слоя 10 мм при длине волны 328 нм. Одним из мешающих факторов при работе с биоматериалом была опалесценция. Для ее предотвращения увеличивали время центрифугирования. Таблица 2.2. Значения оптических плотностей гексановых экстрактов из отделов головного мозга белых крыс
БП – большие полушария ПМ – промежуточный мозг СР – средний мозг МЗ – мозжечок ПД – продолговатый мозг СП – спинной мозг Содержание ретинола ацетата в ЦНС рассчитывали по формуле: Таблица 2.3. Содержание ретинола ацетата в отделах головного мозга белых крыс
ВЫВОДЫ 1. Проработана литература по вопросу значения, применения и определения жирорастворимых витаминов, в частности каротиноидов и витамина А. Наиболее проста в исполнении, доступна и чувствительна методика спектрофотометрического определения жирорастворимых витаминов. 2. Отработана методика спектрофотометрического определения ретинола ацетата, подобраны оптимальные условия омыления липидной фракции, мешающих определению витаминов и каротиноидов, подобраны условия экстрагирования ретинола ацетата. Сняты спектры полученных гексановых экстрактов с целью выяснения оптимальной длины волны. 3. Диапазоны концентрации ретинола ацетата, при которых соблюдается закон Бугера-Ламберта-Бэра от 0,9 до 4,5 мг в пробе или 0,675 до 3,4 мкмоль/см3. Построен и рассчитан градуировочный график. 4. Проведено определение ретинол ацетата в тканях мозга интактных и опытных белых крыс. Результаты исследования свидетельствуют о снижении ретинола ацетата в тканях мозга под воздействием сероводородсодержащего газа и повышении его при введении витамина Е. Библиографический список 1.Румянцев,Е.В. Химические основы жизни / Е.В.Румянцев, Е.В.Антина, Ю.В.Чистяков. – М.: Химия, Колос, 2007. – 560с. 2. Филлипович, Ю Б. Основы биохимии / Ю.Б.Филлипович. – М.: Изд-во «Агар», 1998. – 286с. 3. Справочник биохимика. Перевод с англ. / Досон Р., Эллиот Д., Эллиот У., Джонс К. – М.: Мир, 1991. – 114, 196, 422С. 4.Комов, В.П. Биохимия / В.П.Комов, В.Н.Шведова. – М.: Дрофа, 2002. – 638с. 5. Тырков, А.Г. Биоорганическая химия / А.Г.Тырков. - Астрахань.: Издательский дом «Астраханский университет», 2008.-236с. 6.Строев, Е.А. Биологическая химия / Е.А.Строев. – М.: Высшая школа, 1986. - 479с. 7. Никифорова, Н.В. Жирорастворимые витамины Е и А в опухолевой ткани и в крови больных почечноклеточным раком / Н.В.Никифорова, А.М.Чумаков, В.И.Кирпатовский, В.А.Комаров. – Урол.нефрол. – 1996. - №6. – 23-27с. 8.Березовский, В.М. Химия витаминов / В.М.Березовский. – 2-е изд. – М.: Пищевая промышленность, 1973. – 634с. 9.Спиричев, В. Б. Биологическая роль жирорастворимых витаминов / В.Б. Спиричев, И.Я. Конь. – Итоги науки и техники. – 1989. Т.37 10.Меньщикова, Е.Б. Окислительный стресс. Пероксиданты и антиоксиданты / Е.Б.Меньщикова, В.З.Ланин, Н.К.Зенков, И.А.Бондарь, Н.Ф.Круговых, В.А.Труфакин. – М.: Фирма «Слово», 2006. – 556с. 11. Pi Mascio P., Devasagagam T.P.A., Raiser., Siesh. Carotenoids, tocopherols, and thids as biological singlet molecular oxygen quenchers // Biochem. Soc. Trans. 1990. – Vol. 18.- P. 1054 -1056. 12. Palozza P., Galviello G., Bartoli G.M. Prooxidant activity of beta-carotene under 100% oxygen pressure in rat liver microsomes // Free Radic. Biol. Med. - 1995.- Vol.19.- P.887-892. 14.Юдаев, Н.А. Биохимия гормонов и гормональной регуляции / Н.А.Юдаев. - М.: «Наука», 1976, 379с. 15.Овчинников, Ю.А. Биоорганическая химия / Ю.А.Овчинников. – М.: Просвещение, 1987. – 815с. 16.Труфанов, А.Н. Биохимия и физиология витаминов и антивитаминов / А.Н.Труфанов. - М.: 1956г. 17. Шилов, П.И. Основы клинической витаминологии / П.И.Шилов, Т.Н.Яковлев. - Л.: 1964г. 18. Машковский М.Д. Лекарственные средства / М.Д. Машковский. – М.: ООО «Изд-во Новая волна» : издатель С.Б. Дилов, 2002. – 608с. 19. Ефремов, В.В. Важнейшие авитаминозы человека / В.В.Ефремов. - М.: 1939г. 20. Кудряшов, Б.А. Биологические основы учения о витаминах / Б.А.Кудряшов. - М.: 1948г. 21. Колобилова, А.И. Витамины / А.И.Колобилова. - Л.: 1976г. 22. Rosati C., Aquilani R., Dharmapuri S. et al. Metabolic engineering of beta-carotine and lycopene content in tomato fruit // Plant J. - 2000.- Vol.24.- P.412-419. 23. Pan W.H., Wang S.M. Et al. Vitamin F, vitamin E or beta-carotene status and hepatitis B-related hepatocellular carcinoma // Ann. Epidemol.- 1993/- Vol.3.-217-224 P. 24 Rousseau E.J., Davison F.J., Dunn B. Protection by β-carotene and related compounds against oxygen-mediated cytotoxicity and genotoxicity – Implicationds for carcinogenesis and anticarcinogenesis // Free Radic. Biol. Med.- 1992. Vol.13. - P.407-433. 25. Rise-Evans C., Saimar A. Dietary antioxidants and nutrition // Reactive Oxygen Species in Biological Systems.- N.Y.: Kluwer Acad./Plenum Publ., 1999.- P.367-394. 26. Shewmaker C.K., Sheehy J.A., Daley M. et al. Seed – specific overexpression of phytoene synthase: increase in carotenoids and other metabolic effects // Plant J. 1999.- Vol.20. - P.401-412. 27. Ye X., Al-Babili S., Kloti A. et al. Engineering the provitamin A (beta-carotene) biosynthetic pathway into (carotenoid-free) rise endosperm // Science.- 2000.- Vol. 287.- P.303-305. 28. Tailor, S. L. Sensitive fluorometric method for tissue tocopherol analysis [Text] / S. L. Tailor, M. P. Lambden, A. L. Tappel // Lipids. – 1976. – 11, № 7. – P. 530-538. 1 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
