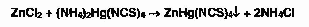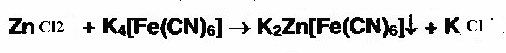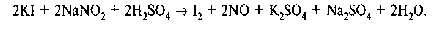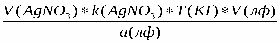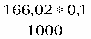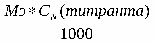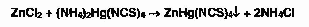 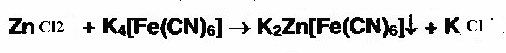  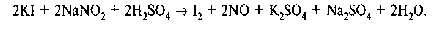 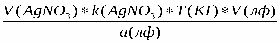 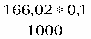   
Дата
|
Содержание работы
|
Подпись руководителя практики
|
18.04.16
|
УЧАСТИЕ В ПРИЁМКЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И РАСПРЕДЕЛЕНИЕ ИХ НА ХРАНЕНИЕ В АПТЕКЕ.
Алгоритм приема товаров аптечного ассортимента
Поставщики поставляют товары в аптечный пункт своим транспортом. При доставке транспортом поставщика товар в отделе экспедиции склада получает шофёр – экспедитор по количеству мест и массе брутто. На основании сопроводительных документов под расписку и отвечает за него в пути. По прибытии в аптеку экспедитор передаёт доставленный груз, сертификаты качества и сопроводительные документы материально ответственному лицу по количеству мест и массе брутто. Материально ответственное лицо производит количественно-качественную приёмку поступившего товара в присутствии экспедитора. На всех экземплярах сопроводительных документов, возвращаемых экспедитору подтверждая факт приёма товаров, проставляется штамп приёма или печать аптеки, а также подпись материально ответственного лица. Один экземпляр сопроводительного документа, заверенный аналогично остаётся в аптеке и служит основанием для регистрации поступления товаров в учётных документах.
Особенности хранения отдельных групп товаров аптечного ассортимента
В помещениях хранения лекарственные средства размещают отдельно:
- в строгом соответствии с токсикологическими группами;
- ядовитые, наркотические и сильнодействующие лекарственные средства должны храниться в соответствии с действующими требованиями;
- в соответствии с фармакологическими группам;
- в зависимости от способа применения (внутреннее, наружное);
- в соответствии с физико - химическими свойствами лекарственных средств и влиянием различных факторов внешней среды;
- с учетом установленных сроков хранения для лекарственных препаратов с ограниченными сроками годности;
- с учетом характера различных лекарственных форм.
Изделия медицинского назначения следует хранить раздельно по группам:
- резиновые изделия;
- изделия из пластмасс;
- перевязочные средства и вспомогательные материалы;
- изделия медицинской техники.
Хранение таблеток и драже должно осуществляться в сухом и, если это необходимо, в защищенном от света месте.
Лекарственные формы для инъекций следует хранить в прохладном, защищенном от света месте в отдельном шкафу или изолированном помещении и с учетом особенности тары (хрупкость), если нет других указаний на упаковке.
Жидкие лекарственные формы (сиропы, настойки) должны храниться в прохладном, защищенном от света месте.
Мази хранят в прохладном, защищенном от света месте.
Хранение суппозиториев должно осуществляться в сухом, прохладном, защищенном от света месте.
Хранение лекарственных средств в аэрозольных упаковках должно осуществляться при температуре от +3 до +20 градусов С. В сухом, защищенном от света месте, вдали от огня и отопительных приборов. Аэрозольные упаковки следует оберегать от ударов и механических повреждений.
Нормативная документация, регламентирующая особенности хранения отдельных групп лекарственных препаратов
1. Приказ Минздравсоцразвития РФ от 23.08.2010 № 706н (ред. от 28.12.2010) "Об утверждении Правил хранения лекарственных средств".
2. Приказ Минздравсоцразвития РФ от 16.05.2011 № 397н "Об утверждении специальных требований к условиям хранения наркотических средств и психотропных веществ, зарегистрированных в установленном порядке в Российской Федерации в качестве лекарственных средств, предназначенных для медицинского применения, в аптечных, лечебно-профилактических учреждениях, научно-исследовательских, учебных организациях и организациях оптовой торговли лекарственными средствами".
3. Постановление Правительства РФ от 31.12.2009 № 1148 (в редакции Постановлений Правительства РФ от 09.06.2010 N 419, от 26.04.2011 N 323, от 06.10.2011 N 824) "О порядке хранения наркотических средств и психотропных веществ".
4. Приказ Минздрава РФ от 12.11.1997 № 330 (редакция от 17.11.2010) "О мерах по улучшению учета, хранения, выписывания и использования наркотических средств и психотропных веществ".
5. Приказ Минздрава РФ от 5.11.1997 № 318 «Об утверждении Инструкции о порядке хранения и обращения в фармацевтических (аптечных) организациях с лекарственными средствами и изделиями, обладающими огнеопасными и взрывоопасными свойствами».
Группы лекарственных препаратов, поступивших в аптеку, требующих особых условий хранения, и место их хранения
Глазные мази – хранить в холодильнике при температуре не выше 15 градусов;
Суппозитории – хранить в холодильнике;
Растворы для инъекций – хранить в прохладном, защищённом от света месте;
Резиновые спринцовки, перчатки – хранить вдали от нагревательных приборов;
Изделия медицинского назначения (тонометры, термометры и др.) – хранить отдельно от лекарственных средств;
Настойки – хранить в прохладном, защищённом от света месте.
|
|
19.04.16
|
УЧАСТИЕ В РАБОТЕ ОТДЕЛА ПО ОТПУСКУ ГОТОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПО РЕЦЕПТАМ
Алгоритм приема рецептов
1.Проверка соответствия формы рецептурного бланка лекарственной прописи.
2. Проверка правомочия лица, выписавшего рецепт.
3.Проверка правильности оформления прописи и способа применения ЛС.
4.Проверка совместимости ингредиентов в рецепте.
5. Проверка высших разовых и суточных доз ЛС с учетом возраста больного.
6. Проверка соответствия количества выписанного ЛС установленным приказами МЗ РФ от 12.02.2007 № 110.
7. Проверка срока действия рецепта.
8. Таксировка рецепта.
9.Регистрация рецепта.
10.Оформление сигнатуры при необходимости.
11.Выдача квитанции.
12.Оплата рецепта.
Формы рецептурных бланков
В аптечный пункт ООО « Галатея» поступают рецептурные бланки двух видов:
Форма 107-1/у
Форма 148-1/у-88
Действующие приказы и инструкции по правилам отпуска ЛС по рецептам
1. Федеральный закон № 61-ФЗ "Об обращении лекарственных средств” от 12.04.2010.
2. Приказ Министерства Здравоохранения РФ № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения» от 20.12.2012.
3. Приказ Минздравсоцразвития РФ от 14.12.2005 N 785 (ред. от 06.08.2007) "О Порядке отпуска лекарственных средств".
4. Приказ Минздравсоцразвития РФ от 28.12.2010 N 1222н "Об утверждении Правил оптовой торговли лекарственными средствами для медицинского применения".
5. Приказ Минздрава России № 378н от 17.06.2013 «Об утверждении правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включенных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету, в специальных журналах учета операций, связанных с обращением лекарственных средств для медицинского применения, и правил ведения и хранения специальных журналов учета операций, связанных с обращением лекарственных средств для медицинского применения».
6. Приказ Минздрава РФ №1181н "Об утверждении порядка назначения и выписывания, а также форм рецептурных бланков на медицинские изделия и порядка оформления указанных бланков, их учета и хранения".
7. Приказ Минздрава России №183н от 22.04.2014 "Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету".
Анализ лекарственных препаратов, см. приложение.
|
|
20.04.16
|
УЧАСТИЕ В РАБОТЕ ОТДЕЛА ПО ОТПУСКУ ГОТОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПО ЛЬГОТНЫМ РЕЦЕПТАМ
Нормативная документация по льготному отпуску ЛС на рабочем месте фармацевта
Постановление Правительства РФ № 890 от 30.07.1994 г. «О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения»
Федеральный закон № 178-ФЗ от 17.07.1999 г. «О государственной социальной помощи» (с изменениями на 21 июля 2014 года)
Приказ Минздравсоцразвития РФ № 665 от 18.09.2006 г. «Об утверждении перечня лекарственных препаратов, в том числе перечня лекарственных препаратов, назначаемых по решению врачебной комиссии лечебно-профилактических учреждений, обеспечение которыми осуществляется в соответствии со стандартами медицинской помощи по рецептам врача (фельдшера) при оказании государственной социальной помощи в виде набора социальных услуг» (с изменениями на 10 ноября 2011 года)
Приказ Министерства Здравоохранения РФ № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения» от 20.12.2012.
Распоряжение Правительства РФ № 2782-р от 30.12.2014 г. «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2015 год»
|
|
21.04.16
|
УЧАСТИЕ В РАБОТЕ ОТДЕЛА ПО БЕЗРЕЦЕПТУРНОМУ ОТПУСКУ ГОТОВЫХ ЛЕКАРСТВЕННЫХ ФОРМ НАСЕЛЕНИЮ.
Должностные обязанности фармацевта в отделе безрецептурного отпуска.
Фармацевт обязан:
Осуществлять безрецептурный отпуск готовых лекарственных средств, предметов санитарии и гигиены, ухода за больными, лекарственных трав и других медицинских изделий.
Проводить кассовые операции по приему от населения денежных средств за реализуемый товар, вести учет движения денежных средств.
Делать кассовые отчеты в конце рабочей смены.
Проводить определение потребности в лекарственных средствах и изделиях медицинского назначения и на основе этого составлять заявку-заказ на склад.
Участвовать в приемке товара, его распределении по местам хранения.
Обеспечивать условия хранения лекарственных средств и изделий медицинского назначения в соответствии с их физико-химическими свойствами и действующими правилами хранения.
Проводить контроль качества лекарственных средств на стадиях приема, хранения и реализации.
Контролировать сроки годности лекарственных средств.
Маркировать товар и презентовать его на витринах, используя основы мерчандайзинга.
Обеспечить соблюдение фармацевтического порядка и санитарно-гигиенического режима на рабочем месте.
Оформлять документацию по фармацевтической деятельности.
Иметь аккуратный внешний вид и носить форменную одежду.
Принимать участие в инвентаризации товарно-материальных ценностей.
Соблюдать правила внутреннего трудового распорядка.
Соблюдать требования по технике безопасности, противопожарной безопасности, правилам технической эксплуатации оборудования.
Систематически повышать свою квалификацию.
Проходить в установленном порядке периодические медицинские осмотры.
Информировать руководство организации об имеющихся недостатках в обслуживании посетителей, о любой ситуации, угрожающей жизни и здоровью людей.
Вежливо обращаться с персоналом и посетителями аптеки.
Проводить санитарно-просветительную и информационную работу среди населения о лекарственных средствах и изделиях медицинского назначения, их применении и хранении в домашних условиях.
Оказывать доврачебную помощь при неотложных состояниях.
Фармакотерапевтический анализ 2-ух лекарственных препаратов безрецептурного отпуска.
|
|
22.04.16
|
УЧАСТИЕ В ПРОВЕДЕНИИ РЕКЛАМНЫХ АКЦИЙ.
Особенности рекламы для населения на лекарственные препараты, отпускаемые без рецептов
1. Реклама не должна способствовать самодиагностике и бесконтрольному самолечению, в частности:
а) содержать подробное описание симптоматики заболевания и таким образом способствовать постановке неправильного самодиагноза;
б) давать понять, что лекарственный препарат необходимо применять здоровым людям (За исключением рекламы средств профилактики.
в) приравнивать продукты питания (добавке к пище), косметические средства и другие продукты, не являющиеся ЛС, к лекарству и, наоборот, лекарство к продуктам, не являющимся ЛС и не требующим повышенной осторожности;
г) вызывать (быть способным вызвать) чувство страха, в связи с последствиями, к которым может привести неприменение данного ЛС;
д) усиливать (обострять) комплексы, связанные с внешней непривлекательностью потенциального покупателя (в частности, подростковые, сексуальные и др.);
е) недобросовестным образом, безответственно или обманно ссылаться на свидетельства о выздоровлении.
2. Реклама не должна эксплуатировать авторитет медицинских работников (часто говорят о запрете использования «белого халата» в рекламе лекарственных препаратов), а также других лиц, известных и популярных в обществе.
3. Реклама не должна непосредственно обращаться к детям.
4. Реклама не должна поощрять самолечение опасных заболеваний, в частности в рекламе запрещены терапевтические рекомендации по таким болезням, как:
- туберкулез;
- болезни, передаваемые половым путем;
- другие тяжелые инфекционные заболевания;
- рак и другие злокачественные заболевания;
- хроническая бессонница;
- сахарный диабет и болезни обмена веществ.
5. Реклама не должна создавать впечатления:
- отсутствия необходимости обращения к врачу;
- отсутствия побочных эффектов и других рисков, связанных с приемом лекарственного препарата;
- гарантии безопасности благодаря "природному происхождению" лекарственного препарата.
Оформить информационный листок на новый лекарственный препарат для населения
Оформить памятку для населения по особенностям хранения товаров аптечного ассортимента в домашних условиях.
|
|
25.04.16
|
УЧАСТИЕ В ПРОВЕДЕНИИ РЕКЛАМНЫХ АКЦИЙ ДЛЯ РАБОТНИКОВ ЛПУ.
Особенности информации для работников ЛПУ на лекарственные препараты.
В процессе информационной деятельности, в частности при информировании специалистов о ЛС, качественными параметрами информации считаются полнота, оперативность и релевантность (соответствие запросу), которые рассчитываются как количественные индексы по известным формулам. Кроме того, информацию характеризуют следующие показатели: количество, доступность, точность, оперативность, достаточность и глубина.
Под количеством информации понимают объем данных, выраженный каким-либо количественным показателем.
Под доступностью информации понимают реальную возможность для конкретного специалиста или пациента получить информацию по интересующей его проблеме из всех известных в мире источников.
Под точностью данных понимают их соответствие или наибольшее приближение к фактам клинической или фармацевтической практики, имеющимися в реальной практике здравоохранения.
Важной характеристикой информации является ее своевременность (оперативность). Жизненный цикл информации в современных условиях составляет 3-5 лет. Это означает, что опубликованная сегодня информация будет обновляться и пересматриваться каждые 3-5 лет. В результате:
* она может потерять свою актуальность и оказаться бесполезной;
* то, что верно сегодня, может быть неверным завтра;
* новые лекарственные средства и методы лечения приходят на смену старым;
* появляются новые данные о ранее известных лекарственных средствах и методах лечения.
Таким образом, оперативность отражает актуальность информации для необходимых расчетов и принятия решений в изменившихся условиях.
Достоверность определяет допустимый уровень искажения как поступающей, так и результатной информации, при которой сохраняется эффективность функционирования системы.
Достаточность определяет объем информации, необходимой для удовлетворения информационных потребностей потребителя.
Глубина определяет степень продвинутости поиска информации.
|
|
26.04.16-02.05.16
|
Санитарные требования при изготовлении лекарственных средств в асептических условиях
1. Помещения для изготовления лекарственных средств в асептических условиях отделывают, оборудуют и обрабатывают в соответствии с разделами 2, 3 данной Инструкции.
2. Персонал для работы в асептических условиях подготавливается в соответствии с санитарными требованиями и указаниями (Приложения 5, 6).
3. Лекарственные вещества, необходимые для приготовления лекарственных средств в асептических условиях, хранят в плотно закрывающихся шкафах в штангласах в условиях, исключающих их загрязнение. Штангласы перед каждым заполнением моют и стерилизуют.
4. Вспомогательный материал подготавливают, стерилизуют и хранят в закрытом виде не более 3 суток (Приложение 9). Вскрытые материалы используют в течение 24 часов. После каждого забора материала бикс или банку плотно закрывают. Забор производят стерильным пинцетом.
5. Аптечную посуду после соответствующей обработки (Приложение 10) используют по назначению или укупоривают и хранят в плотно закрывающихся шкафах. Срок хранения стерильной посуды, используемой для приготовления и фасовки лекарственных средств в асептических условиях, не более 24 часов.
6. Крупноемкие баллоны допускается обеззараживать после мытья пропариванием острым паром в течение 30 мин. После обработки емкости закрывают стерильными пробками или обвязывают стерильным пергаментом и хранят в условиях, исключающих их загрязнение, не более 24 часов.
7. Укупорочный материал (пробки, колпачки и др.) обрабатывают и хранят в условиях, предотвращающих их загрязнение (Приложение 9).
8. Съемные части технологического оборудования, непосредственно соприкасающиеся с раствором лекарственных веществ (трубки резиновые и стеклянные, фильтр-держатели, мембранные микрофильтры, прокладки и др.), обрабатывают, стерилизуют и хранят в режимах, описанных в документации по использованию соответствующего оборудования.
9. Концентрированные растворы, полуфабрикаты, внутриаптечную заготовку изготавливают в асептических условиях и хранят в соответствии с их физико-химическими свойствами и установленными сроками годности в условиях, исключающих их загрязнение.
Выполняла расчёты допустимых норм отклонений, согласно с приказом МЗ РФ от 16.10.97 №305 «О нормах отклонений, допустимых при изготовлении ЛС и фасовке промышленной продукции в аптеках»
Так же стерилизовала ЛФ.
Стерилизацию проводят в паровых стерилизаторах. Для достижения максимальной эффективности процесса необходимо полное удаление воздуха из стерилизационной камеры и обрабатываемых объектов, а также правильное размещение последних, обеспечивающее проникновение к ним пара.
1. Стерилизация насыщенным паром при 120оС рекомендуется для растворов лекарственных веществ. Время стерилизационной выдержки зависит от физико-химических свойств препарата, объема раствора и используемого оборудования:
Объем образца в мл
|
Минимальное время стерилизационной выдержки, в мин.
|
до 100
|
8
|
от 100 до 500
|
12
|
от 500 до 1000
|
15
|
Стерилизацию раствора производят в герметично укупоренных флаконах или бутылках.
В исключительных случаях допускается стерилизация при температуре ниже 120оС, что оговаривается в соответствующей нормативно-технической документации.
Оформляла к отпуску стерильные лекарственные формы: инъекционные растворы по рецептам и требованиям согласно с приказом МЗ РФ №214 от 16.07.1997 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)»
|
|
06.05.16
|
Изготовление в асептических условиях, оформление к отпуску инъекционных растворов.
Rp:Acidi ascorbinici 5%-50ml
Sterilisetur!
D.S. в/м
Р.п.
к-ты аскорбиновой (5*50):100=2,5
натрия сульфата (2*50):100= 0,1
H2O-до 50мл
Vобщ-50мл
Характеристика ЛФ: ЖЛФ в виде инъекционного раствора
Особенности:
1)готовим в асептических условиях
2)растворы к-ты аскорбиновой очень болезненны поэтому в её состав вводят NaHCO3 из расчета 23,85-100
3)к-та аскорбиновая легко окисляющиеся вещество используем антиоксидант натрий сульфат из расчета 2-1000
4)готовим массо-обьемным способом в мерной посуде
5)стерилизуем 8 мин-120*
Технология приготовлени: готовим рабочие место согласно приказу № 309 от 21.10.07. В стерильную подставку помещаем примерно 25 мл воды, растворяем в ней 2,5 к-ты аскорбиновой, поcле NaHCO3 1,2мл натрия сульфат 0,1, доводим объем до 50мл. Часть раствора отдаем на анализ химику-аналитику, после положительного анализа фильтруем в отпускной флакон, укупориваем, оформляем к стерилизации, на ярлыке пишем наименование, концентрацию, дату, роспись. Стерилизуем в автоклаве 8 мин-120*.После стерилизации проверяем на чистоту, оформляем к отпуску согласно приказу №214 от 16.07.97 «Для инъекций», «Беречь от детей», «Хранить в прохладном, защищенном от света месте». Убираем рабочие место согласно приказу №309 от 21.10.97. Оформляем паспорт письменного контроля согласно приказу№120 от 05.09.97
Rp: Sol. Kalii iodidi 3% - 1000 ml
D.S. По 1 столовой ложке 3 раза в день.
Количественный анализ провести методом аргентометрии (вариант Фаянса)
Методика
К 1 мл лекарственной формы (пипетка Мора) прибавить 1 мл воды очищенной, 3 капли разбавленной кислоты уксусной и 1-2 капли эозината натрия. Титровать раствором серебра нитрата (0,1 моль/л) до образования розового осадка над раствором.
M.м. (KI) = 166,01 г/моль
1. Физический контроль.
Бесцветная прозрачная жидкость без механических примесей; допустимая норма отклонений на объем
Вывод: объем ЛФ соответствует прописанному в рецепте.
2. Химический контроль.
Проводится по реакциям на подлинность ионов К+иI-.
1) К+ :
а) Реакция с винно-каменной кислотой в присутствии ацетата натрия и этанола:
KI+ HOOC-CH(OH)-CH(OH)-COOHCH3COONaHOOC-CH(OH)-CH(OH)-COOK+HCl
Образуется белый осадок гидротартрата калия.
Реакция проводится в присутствии ацетата натрия для создания необходимой кислотности среды.
б) Реакция с раствором кобальтинитрита натрия (гексанитрокобальтата натрия)
2K ++ Na3[Co(NO2)6→K2Na[Co(NO2)]6+2Na+
Реакцию проводят в уксуснокислой среде. Образуется желтый осадок.
в) Пирохимическая реакция.
Бесцветное пламя спиртовки окрашивается в присутствии К+ в фиолетовый цвет.
2) I-:
а) Реакция с раствором нитрата серебра в присутствии азотной кислоты.
КI+AgNO3 →AgI+КNO3
Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака.
б) Реакция окисления йодид-иона до элементарного галогена.
К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет.
2KI + 2NaNO2+ 2H2SO4→ I2+ K2SO4+ Na2SO4+ 2NO↑ + 2H2O
Вывод:ЛФ соответствует своему наименованию.
3. Количественный анализ
Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия.
КI+AgNO3 →AgI+КNO3
Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия
По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадкаAgIот желтого до розового.
Расчет титра:
f = 1
Т = == 0,01660 г/мл
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г калия йодида
Расчет допустимых норм отклонений:
Масса KI= 3,0 г (по рецепту)
3,0 ± 4% ± 0,12
2,88 ≤ х ≤ 3,12
Формула расчета
X(KI) =
где V(AgNO3) – количество титрантаAgNO3, пошедшего на титрование;
k(AgNO3)·- поправочный коэффициент;
Т (KI) ·- титр калия йодида по серебра нитрату;
V(лф) – объем прописанной ЛФ;
а (лф) – навеска, взятая на титрование.
Заключение о качестве ЛФ.
Рабочая пропись:
Калия иодида 3,0 – 100,0
Х – 1000,0 Х = 3,0*1000,0/100,0 = 30,0
С% 30,0 - 1000 ml
X - 100 ml C% = 30,0*100/1000 = 3 %
Воды очищенной до 1000 мл
V общ. = 1000 мл
Физико-химические свойства ингредиентов:
Калия иодид (Kaliiiodidum) - белые (бесцветные) кубические кристаллы или мелкокристаллический порошок без запаха, солено-горький на вкус, сыреет во влажном воздухе. Легко растворим в воде (1:0,75), спирте (1:12), глицерине
Характеристика ЛФ: ЖЛФ в виде раствора для внутреннего применения
Особенности приготовления: т.к. сухих веществ в растворе 3%, то готовим в мерной посуде
Технология приготовления:
Готовим рабочее место (приказ № 309 от 21.10.97 г.)
Отвешиваем 30,0 калия йодида, в подставку отмериваем 500 мл воды очищенной и в ней растворяем калия йодид при перемешивании, помещаем раствор в мерный цилиндр и доводим объём до 1000 мл.
Полученный раствор фильтруем в 5 флаконов по 200 мл (флаконы из тёмного стекла)
Флаконы укупориваем пластмассовыми пробками с навинчивающимися крышками
Оформляем к отпуску этикетками «Внутреннее», «Хранить в защищенном от света месте», «Беречь от детей»
Убираем рабочее место (приказ № 309 от 21.10.97 г.)
Rp: Sol. Natrii chloridi 0,9 % - 200 ml
Sterilisetur!
Da. Signa. Внутривенно-капельно.
Рабочая пропись:
Натрия хлорида 0,9*200/100 = 1,8
Воды для инъекций до 200 мл
Vобщ. = 200 мл
Допустимые отклонения:± 2 %
200 мл – 100 %
Х мл – 2 % Х = 200*2/100 = 4 мл [196 мл – 200 мл – 204 мл]
Физико-химические свойства ингридиентов:
Натрия хлорид (Natriichloridum) – белый кристаллический порошок без запаха, солёного вкуса. Хорошо растворим в воде (в 3-х частях), мало растворим в спирте. Хранить в хорошо укупоренной таре. Применяется как дезинтоксикационное средство при обезвоживании.
Характеристика лекарственной формы: ЖЛФ в виде изотонического раствора для капельного введения.
Особенности выписывания рецептурного бланка: ЛФ выписывается на рецептурном бланке формы 107-1/у (приказ № 1175н от 20.12.2012 г.). Заверяется штампом ЛПУ, личной печатью и подписью врача. Действителен 2 месяца.
Особенности технологии:
1). ЛФ готовим в асептических условиях
2). Для приготовления данного раствора используют хлорид натрия сорта «Химически чистый»
3). ЛФ готовим массо-объёмным способом в мерной посуде (либо с учётом КУО)
4). Готовую ЛФ стерилизуем в автоклаве при температуре 120˚ в течение 12 минут.
Технология приготовления:
Готовим рабочее место (приказ № 309 от 21.10.97 г.)
В стерильную подставку отмериваем ≈100 мл воды д/и. На ручных весочках, протёртых спирто-эфирной смесью, отвешиваем 1,8 натрия хлорида сорта «Химически чистый» и растворяем в подставке. Переносим в стерильный мерный цилиндр, доводим объём водой д/и до 200 мл. Часть раствора отдаём на анализ провизору-аналитику. После положительного результата анализа раствор фильтруем в стерильный отпускной флакон, первые порции фильтрата возвращаем на фильтр. Укупориваем стерильной резиновой пробкой. Проверяем на чистоту с помощью прибора УК-2, и на герметичность. Укупориваем металлическим колпачком под обкатку. Готовим к стерилизации – оформляем ярлычок (наименование, концентрация раствора, дата, подпись). Стерилизуем в автоклаве при температуре 120˚ в течение 12 минут. Повторно проверяем раствор на чистоту и, если раствор чистый, оформляем к отпуску этикетками «Для инъекций», «Беречь от детей», «Стерильно!».
Готовили в асептических условиях и оформляли к отпуску глазные капли.
Натрия хлорид (аргентометрически методом Мора). Метод основан на способности натрия хлорида реагировать с серебра нитратом с образованием серебра хлорида.
К 0,5 мл ЛФ прибавляют 1 каплю хромата калия и титруют 0,1 моль/л р-ром серебра нитрата до оранжево-желтого цвета. 1мл 0,1 моль/л серебра нитрата соответствует 0,005844 г натрия хлорида.
NaCl+AgNO3→AgCl↓бел.+NaNO3
В т.к.т. 2 AgNO3+K2CrO4→Ag2CrO4↓Кирп. красн+ 2KNO3
Rp: Sol. Pilocarpinihydrochloridi 1%-10ml
D.S.по 2 капли в оба глаза
Р.п.
Пилокарпин г\х-(1*10):100=0,1
Экв.пилокарпина по NaCL-0,22
0,22-1,0=0,022 NaCL
Х-0,1
0,9 NaCL-100мл=0,09
0.09-0,022=0,07NaCL
H2O -до 10мл
V-10мл
Характеристика ЛФ: ЖЛФ в виде глазных капель
Особенности технологии:
1)готовим в асептических условиях
2)пилокарпин г\х получаем у провизора-технолога
3)готовим с NaCL расчет по эквиваленту
4)сухие вещества растворяем в небольшом количестве растворителя
5)стерилизуем в автоклаве 120-8мин
6)ЛФ опечатывается
Технология приготовления: готовим рабочие место согласно приказу № 309 от 21.10.07. В стерильном цилиндре отмериваем 10мл воды свежеприготовленной. Помещаем в подставку 5 мл,у провизора-технолога под роспись получаем пилокарпина г\х 0,1, затем в подставке растворяем NaCL 0,07. Часть раствора отдаем на анализ химику-аналитику, после положительного анализа фильтруем в отпускной флакон, укупориваем, оформляем к стерилизации, на ярлыке пишем наименование, концентрацию, дату, роспись. Стерилизуем в автоклаве 8 мин-120*.После стерилизации проверяем на чистоту, оформляем к отпуску согласно приказу №214 от 16.07.97 основная «Глазные капли» с розовой сигнальной полосой, «Беречь от детей», «Хранить в прохладном, защищенном от света месте», «Стерильно», «Обращаться осторожно», ЛФ опечатывается. Убираем рабочие место согласно приказу №309 от 21.10.97. Оформляем паспорт письменного контроля согласно приказу№120 от 05.09.97
Определение подлинности пилокарпина гидрохлорида проводят по реакции образования надхромовых кислот, которые образуют с пилокарпином растворимый в хлороформе комплекс сине-фиолетового цвета.
Количественное определение пилокарпина гидрохлорида проводят методом алкалиметрии в присутствии органического растворителя. Сумму пилокарпина гидрохлорида и натрия хлорида титруют серебра нитратом. Объем серебра нитрата, прореагировавшего с натрия хлоридом, рассчитывают по разности между объёмами серебра нитрата и натрия гидроксида, учитывая различную молярность натрия гидроксида и серебра нитрата.
ОРГАНОЛЕПТИЧЕСКИЙ КОНТРОЛЬ
Бесцветная, прозрачная жидкость.
ОПРЕДЕЛЕНИЕ ПОДЛИННОСТИ
Пилокарпина гидрохлорид. К 0,2 мл раствора прибавляют 0,1 мл кислоты серной разведенной, 1 мл раствора водорода пероксида,
0,1 мл раствора калия бихромата, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в сине-фиолетовый цвет.
Хлорид-ион. К 0,2 мл раствора прибавляют по 0,1 мл кислоты азотной разведённой и раствора серебра нитрата.
Появляется белый творожистый осадок, растворимый в растворе аммиака.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ
Пилокарпина гидрохлорид. Алкалиметрический метод. К 0,5 мл раствора прибавляют 2?3 мл хлороформа и титруют 0,02 моль/л раствором натрия гидроксида при взбалтывании до розового окрашивания водного слоя (индикатор - фенолфталеин) (V мл).
1 мл 0,02 моль/л раствора натрия гидроксида соответствует 0,004894 г, пилокарпина гидрохлорида.
Пилокарпина гидрохлорид и натрия хлорид. Аргентометрический метод (Фаянса). К 0,5 мл раствора прибавляют 0,1 мл раствора бромфенолового синего, по каплям кислоту уксусную разведенную до зеленовато-желтого окрашивания и титруют 0,1 моль/л раствором серебра нитрата до фиолетового окрашивания (V м Объем 0,1 моль/л раствора серебра нитрата (V) в миллилитрах, израсходованный на титрование натрия хлорида, вычисляют по разности: 1 мл 0,1 моль/л раствора серебра нитрата соответствует 0,005844 г натрия хлорида.
|
|
04.05.16
|
Rp: Б Sol. Novocaini 0,5 % - 100 ml
Sterilisetur!
Da. Signa. Внутримышечно.
Проверка доз:
ВРД = 0,75 ЛРД = 0,5
ВСД = 1,0 ЛСД = 0,5
Дозы не завышены!
Рабочая пропись:
Новокаина 0,5*100/100 = 0,5
Стабилизатора 0,1Н раствора HCL 4 мл - 1000 мл р-ра
Х мл – 100 мл р-ра Х = 4*100/1000 = 0,4 мл = 8 капель
Воды д/и до 100 мл
Vобщ. = 100 мл
Допустимые отклонения:± 3 %
100 мл – 100 %
Х мл – 3 % Х = 3 мл [97 мл – 100 мл – 103 мл]
Физико-химические свойства ингридиентов:
Новокаин (Novocainum) – бесцветные кристаллы или белый кристаллический порошок без запаха, горького вкуса. Легко растворим в воде, спирте; мало растворим в хлороформе. Хранится по списку «Б», в хорошо укупоренных банках оранжевого стекла. Применяется как местноанестезирующее средство.
Характеристика лекарственной формы:ЖЛФ в виде инъекционного раствора для в/м введения.
Особенности выписывания рецептурного бланка: ЛФ выписывается на рецептурном бланке формы 107-1/у (приказ № 1175н от 20.12.2012 г.). Заверяется штампом ЛПУ, личной печатью и подписью врача. Действителен 2 месяца.
Особенности технологии:
1). ЛФ готовим в асептических условиях
2). Новокаин – соль слабого основания и сильной кислоты, поэтому во избежание гидролиза добавляем стабилизатор 0,1Н раствор HCL из рассчёта на 0,5 % раствор 4 мл стабилизатора на 1 л раствора Новокаина
3). Готовую ЛФ стерилизуем в автоклаве при температуре 120˚ в течение 8 минут.
Технология приготовления:
Готовим рабочее место (приказ № 309 от 21.10.97 г.)
В стерильную подставку отмериваем ≈50 мл воды д/и. На ручных весочках, протёртых спирто-эфирной смесью, отвешиваем 0,5 Новокаина и растворяем в подставке. Добавляем 8 капель 0,1Н раствора HCL. Переносим в стерильный мерный цилиндр, доводим объём водой д/и до 100 мл. Часть раствора отдаём на анализ провизору-аналитику. После положительного результата анализа раствор фильтруем в стерильный отпускной флакон, первые порции фильтрата возвращаем на фильтр. Укупориваем стерильной резиновой пробкой. Проверяем на чистоту с помощью прибора УК-2, и на герметичность. Укупориваем металлическим колпачком под обкатку. Готовим к стерилизации – оформляем ярлычок (наименование, концентрация раствора, дата, подпись). Стерилизуем в автоклаве при температуре 120˚ в течение 8 минут. Повторно проверяем раствор на чистоту и, если раствор чистый, оформляем к отпуску этикетками «Для инъекций», «Беречь от детей», «Стерильно!», «Хранить в прохладном, защищённом от света месте».
Количественное определение
Количественное определение новокаина, анестезина, натрия пара-аминосалицилата проводят по первичной ароматической ами�ногруппе методом нитритометрии.
Титрование натрия нитритом проводят медленно, так как обра�зование соли диазония идет во времени. В реакционную среду для стабилизации соли добавляют калия бромид; рекомендуемая тем�пература - ниже комнатной.
В качестве индикатора используют тропеолин 00 (внутренний) или йодкрахмальную бумагу (внешний).
В точке эквивалентности на йодкрахмальной бумаге выделяется йод, который окрашивает крахмал в синий цвет:
Rp: Sol. Natrii hydrocarbonatis 5 % - 100 ml
Sterilisetur!
Da. Signa. Внутривенно.
Рабочая пропись:
Натрия гидрокарбоната 5*100/100 = 5,0
Воды д/и до 100 мл
Vобщ. = 100 мл
Допустимые отклонения:± 3 %
100 мл – 100 %
Х мл – 3 % Х = 3 мл [97 мл – 100 мл – 103 мл]
Физико-химические свойства ингридиентов:
Натрия гидрокарбонат (Natriihydrocarbonatis) – белый кристаллический порошок без запаха, солёно-щелочного вкуса. Растворим в воде (1:2), практически нерастворим в спирте. Хранить в хорошо укупоренной таре. Применяется при насморке, конъюктивитах, стоматологических ларингитах; как полоскания.
Характеристика лекарственной формы:ЖЛФ в виде инъекционного раствора для в/в введения.
Особенности выписывания рецептурного бланка: ЛФ выписывается на рецептурном бланке формы 107-1/у (приказ № 1175н от 20.12.2012 г.). Заверяется штампом ЛПУ, личной печатью и подписью врача. Действителен 2 месяца.
Особенности технологии:
1). ЛФ готовим в асептических условиях
2). ЛФ готовим массо-объёмным способом в мерной посуде (либо с учётом КУО)
3). Натрия гидрокарбонат растворяем в воде д/и частями
4). Флакон заполняем на ⅔ объёма во избежание его разрыва
5). Готовую ЛФ стерилизуем в автоклаве при температуре 120˚ в течение 8 минут.
Технология приготовления:
Готовим рабочее место (приказ № 309 от 21.10.97 г.)
В стерильную подставку отмериваем ≈50 мл воды д/и. На ручных весочках, протёртых спирто-эфирной смесью, отвешиваем 5,0 Натрия гидрокарбоната и частями растворяем в подставке. Переносим в стерильный мерный цилиндр, доводим объём водой д/и до 100 мл. Часть раствора отдаём на анализ провизору-аналитику. После положительного результата анализа раствор фильтруем в стерильный отпускной флакон, первые порции фильтрата возвращаем на фильтр. Укупориваем стерильной резиновой пробкой. Проверяем на чистоту с помощью прибора УК-2, и на герметичность. Укупориваем металлическим колпачком под обкатку. Готовим к стерилизации – оформляем ярлычок (наименование, концентрация раствора, дата, подпись). Стерилизуем в автоклаве при температуре 120˚ в течение 8 минут. Повторно проверяем раствор на чистоту и, если раствор чистый, оформляем к отпуску этикетками «Для инъекций», «Беречь от детей», «Стерильно!», «Хранить в прохладном, защищённом от света месте».
Молярная масса:
М(NaHCO3) = 84,00 г/моль.
Описание (внешний вид):
Белый кристаллический порошок без запаха, солёнощелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном. Водные растворы имеют щелочную реакцию.
Растворимость:
Растворим в воде, практически не растворим в спирте.
Прозрачность и цветность раствора:
Раствор 0,5 г препарата в 10 мл воды должен быть бесцветным и по мутности не превышать эталон № 4.
Получение:
Карбонат натрия Na2CO3 получают насыщением водного раствора NaCl аммиаком и CO2. Рaстворимость образующегося гидрокарбоната натрия NaHCO3 менее 10 г в 100 г воды при 20°C, основная часть NaHCO3 выпадает в осадок:
NaCl+NH3+CO2=NaHCO3,
который отделяют фильтрованием.
Качественный анализ.
Качественный анализ – это установление подлинности неорганических веществ, основанное на обнаружении с помощью аналитических реакций катионов и анионов, образующих молекулу вещества.
Хлорид алюминия образован ионом алюминия Al3+, относящийся кIVаналитической группе анионов и хлорид-иономCl-, относящийся кIIIаналитической группе анионов.
Аналитические реакции катиона натрия.
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8c образованием жёлтого кристаллического осадка (фармакопейная реакция - ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl + Zn(UO2)3(CH3COO)8 + CH3COOН + 9 H2O
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl
Мешающие ионы: избыток ионов K+, катионы тяжёлых металлов (Hg22+, Hg2+, Sn2+, Sb3+, Bi3+, Fe3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K+, NH4+, Ag+).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl + K[Sb(OH)6] Na[Sb(OH)6] + KCl
Условия проведения реакции:
а) достаточная концентрация Na+;
б) нейтральная реакция раствора;
в) проведение реакции на холоду;
г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6] + HCl KCl + H3SbO4 + 2 H2O
H3SbO4 HSbO3 + H2O
Аналитические реакции гидрокарбонат-иона.
1. С разбавленными минеральными кислотами (групповым реагентом) (ГФ) (табл. 16).
| |
 Скачать 263.83 Kb.
Скачать 263.83 Kb.