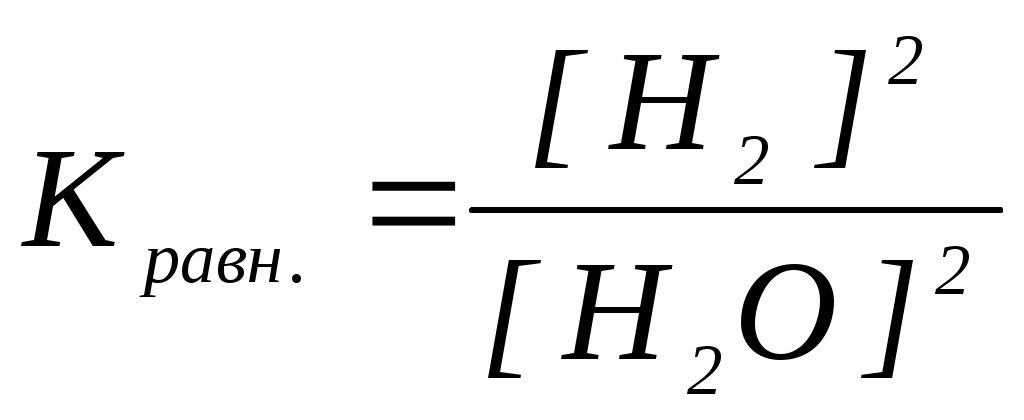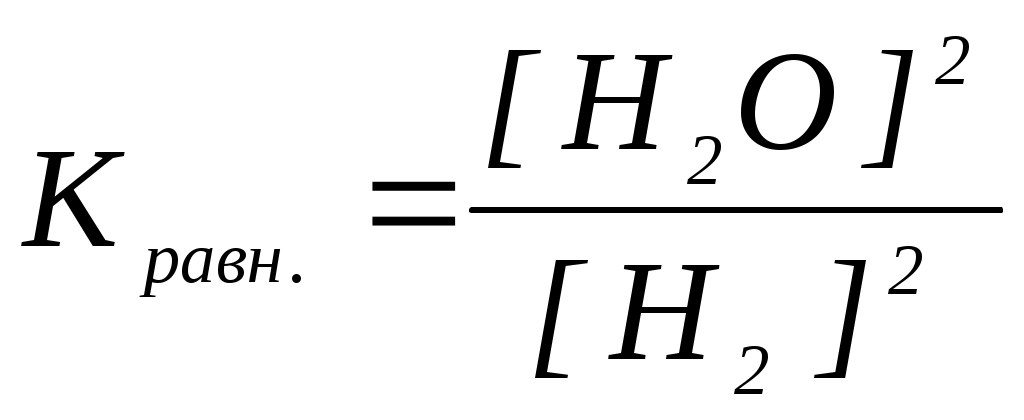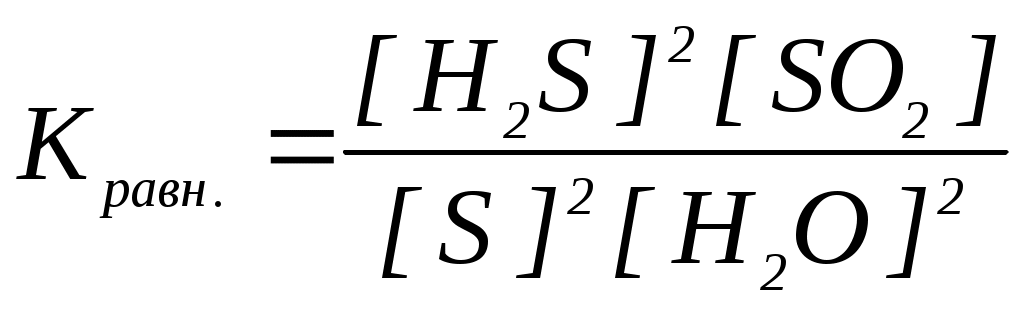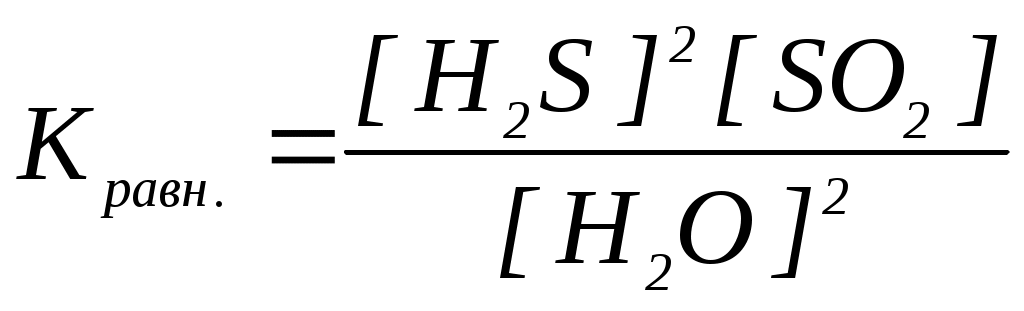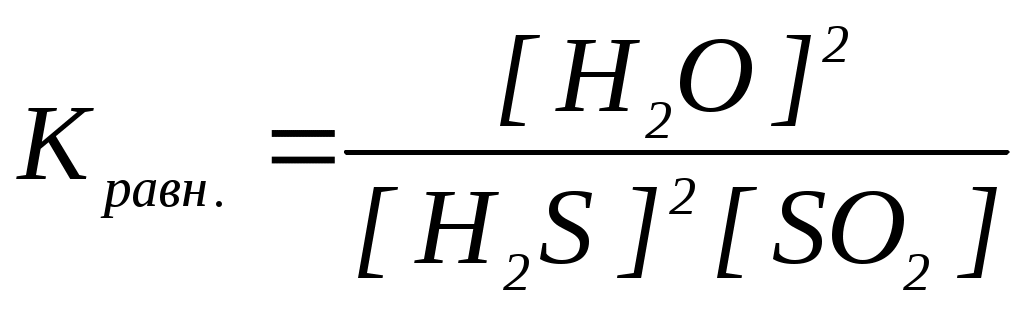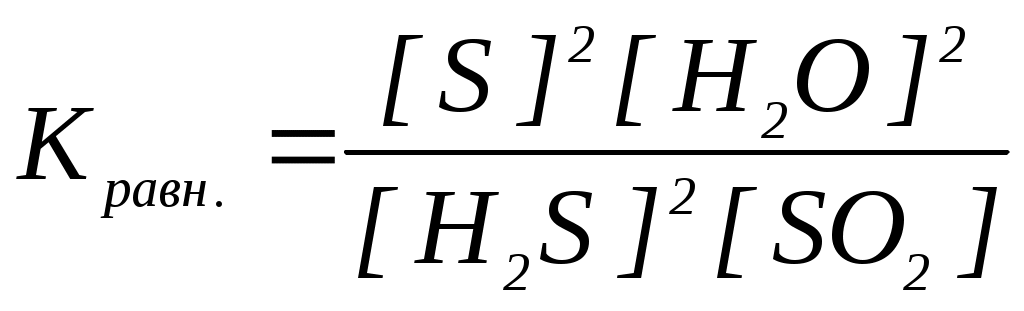1_ФЕПО_подготовка_октябрь_2011. Де наименование дидактической единицы де
 Скачать 1.42 Mb. Скачать 1.42 Mb.
|
|
8. При увеличении давления в системе H2(Г) + I2(Г) 2HI(Г), HO < 0, 1) увеличивается содержание продуктов 2) увеличивается содержание продуктов и исходных веществ 3) состояние равновесия не изменяется 4) увеличивается содержание исходных веществ 9. При увеличении давления в системе CO() + 2H2() CH3OH(), H < 0, 1) увеличивается выход продуктов 2) уменьшается выход продуктов 3) состояние равновесия меняется неоднозначно 4) состояние равновесия не изменяется 10. Для смещения равновесия в системе CO(Г) + 2H2(Г) CH3OH(Г), H < 0 в сторону продуктов реакции необходимо
11. При увеличении температуры в системе C2H2(Г) + H2О(Г) C2H5OH(Г), H0 < 0 равновесие
12. Увеличение температуры вызывает смещение равновесия в сторону ___ процесса.
13. Состояние равновесия характеризуется равенством а) температуры продуктов и исходных веществ б) количества вещества в системе в) концентраций продуктов и исходных веществ г) скоростей прямого и обратного процессов 14. Для смещения равновесия в системе H2(Г) + I2(Г) 2HI(Г), H < 0 в сторону исходных веществ необходимо а) уменьшить температуру б) увеличить концентрацию йода в) увеличить давление г) уменьшить концентрацию йода 15. Понижение температуры вызывает смещение положения равновесия в сторону ____ реакции
16. Уравнение константы равновесия гетерогенной химической реакции SiO2(к.) + H2(г.) Si(к.) + 2H2O(г.) имеет вид
17. Уравнение константы равновесия гетерогенной химической реакции 2NaHCO3(К.) Na2CO3(К.) + H2O(Г.) + CO2(Г.) имеет вид
18. Уравнение константы равновесия гетерогенной химической реакции 3S(к.) + 2H2O(г.) 2H2S(г.) + SO2(г.) имеет вид
19. Уравнение константы равновесия гетерогенной химической реакции 2CO(г.) С(графит) + CO2(г.) имеет вид
20. Если прямая реакция равновесной конденсированной системы протекает с выделением теплоты, то для смещения положения равновесия в сторону продуктов, следует
21. Константа скорости химической реакции не зависит от
18. Общие свойства раствором 1. Раствор, содержащий 11,6 г вещества в 400 г воды, замерзает при температуре 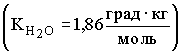 . Тогда молярная масса растворенного вещества равна . Тогда молярная масса растворенного вещества равна
2. Давление паров воды при 25С составляет 3,167 кПа. Давление пара (кПа) над раствором, в 450 г которого содержится 180 г глюкозы, равно
3. Концентрация раствора глюкозы, кипящего при 100,780С (ЕH2O = 0,52 град*кг/моль) равна …. а) 0,3 моль/кг б) 1 моль/кг в) 0,5 моль/кг г) 1,5 моль/кг 4. Осмотическое давление 0,1М раствора глицерина при 25С равно а) 123,8 б) 61,9 в) 247,6 г) 51,6 5. Растворы, обладающие одинаковым осмотическим давлением, называются а) гипертоническими б) изотоническими в) гипотоническими г) изотермическими 6. Концентрация раствора этиленгликоля (тосол), замерзающего при –37,2С (KH2O = 1,86 град*кг/моль) составляет ____ моль/кг а) 20 б) 10 в) 2 г) 40 7. Молярная масса неэлектролита, раствор 6 г которого в 100 мл воды ( а) 6 б) 60 в) 3 г) 30 8. Осмотическое давление 0,5М раствора этанола при 200С равно … а) 1217 кПа б) 4970 кПа в) 2435 кПа г) 609 кПа 8. Молярная масса неэлектролита, раствор 11,6 г которого в 200 г воды замерзает при -1,860С ( а) 29 б) 116 в) 58 г) 232 10. Для повышения температуры кипения раствора на 1,040С ( а) 2 б) 0,5 в) 0,2 г) 1 11. Уравнение PОСМ = CRT(закон Вант-Гоффа), характеризующее зависимость осмотического давления от концентрации и температуры, применимо … а) только к растворам сильных электролитов б) к растворам слабых электролитов в) к любым растворам г) только к растворам неэлектролитов 12. Раствор, содержащий 9,2г этилового спирта в 200 г воды ( а) -1,86 б) -0,186 в) 0,186 г) 1,86 13. Молярная масса неэлектролита, раствор 9,2 г которого в 400 г воды замерзает при -0,930С ( а) 60 г/моль б) 92 г/моль в) 120 г/моль г) 46 г/моль 14. Раствор, содержащий 18 г глюкозы в 100 г воды -1,86С 15. Раствор, содержащий 12 г мочевины (MR = 60) в 100 г воды (К = 1,86), будет замерзать при температуре _____ 0С а) -3,72 б) -0,372 в) 3,72 г) -1,86 16. Раствор, содержащий 46 г глицерина (MR = 92) В 100 Г ВОДЫ (кн2о = 1,86 град*кг/моль), будет замерзать при температуре ___ 0С а) -4,65 б) 9,3 в) -9,3 г) -1,86 17. Осмотическое давление раствора глюкозы с молярной концентраций 0,1 моль/л при 259С равна ___ кПа
19. Молярная масса неэлектролита, раствор 9,2 г которого в 400 г воды замерзает при -0,930С (
20. Раствор, содержащий 9,2 г этилового спирта в 200 г воды (КН2О=1,86 град*кг/моль), замерзает при температуре ____ 0С.
21. Для повышения температуры кипения раствора на 1,040С (
22. Раствор, содержащий 4,6 г глицерина (Mr = 92) в 100 г воды (
23. Температура кипения раствора по сравнению с температурой кипения чистого растворителя
24. На растворимость газообразных веществ оказывают влияние 1) температура, наличие катализатора, низкое значение теплового эффекта растворения 2) степени окисления элементов растворителя, атмосферное давление, валентность элементов растворяемого вещества 3) температура, наличие катализатора, низкое значение энергии активации 4) природа растворяемого вещества, природа растворителя, температура, давление 25. Для вымораживания пресной воды из морской применяют метод
19_1. Коррозия и защита от коррозии 1. Для защиты железа от коррозии в качестве катодного покрытия используется … а) олово б) цинк в) алюминий г) магний 2. Для защиты железного изделия от коррозии в качестве анодного покрытия используют … а) медь б) олово в) серебро г) цинк 3. Для защиты железных изделий от коррозии в качестве катодного покрытия используется
4. При нарушении цинкового покрытия на железном изделии во влажном воздухе на аноде будет протекает реакция, уравнение которой имеет вид
|