ДИАГНОСТИКА ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ. Диагностика инфекционных заболеваний
 Скачать 183.5 Kb. Скачать 183.5 Kb.
|
|
ДИАГНОСТИКА ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ. Диагностика инфекционных болезней основана на комплексном использовании клинических, лабораторных и инструментальных методов обследования. Клинические методы предусматривают выявление жалоб больного, анамнестических сведений (анамнез болезни, эпидемиологический анамнез, основные сведения из анамнеза жизни) и клинический осмотр больного. Анамнез инфекционной болезни – важное звено в диагностике инфекций, он должен быть выяснен путем активного опроса больного: выявления его жалоб на момент осмотра врачом, времени и характера начала болезни (острого или постепенного), подробного и последовательного описания возникновения отдельных симптомов и их развития в динамике заболевания. Это дает врачу возможность составить предварительное впечатление о вероятном клиническом диагнозе. Старое правило клиницистов гласит: "Анамнез — половина диагноза". При сборе анамнестических сведений у инфекционных больных особое внимание необходимо обратить на данные эпидемиологического анамнеза. При этом врач преследует цель получить сведения о месте, обстоятельствах и условиях, при которых могло произойти заражение: контакт с больными людьми или животными, поездки за пределы города или страны, возможность профессионального или бытового заражения. Обращается внимание на возможность укусов насекомых и животных любые повреждения кожных покровов (травмы, ранения), лечебные парентеральные вмешательства. Активно выясняют возможные пути и способы передачи возбудителя инфекции данному больному... Не маловажной частью является анамнез жизни. Только целостная многофакторная клиническая диагностика, учитывающая закономерности и взаимосвязи патологических состояний в масштабе жизни пациента, дает врачу серьезные аргументы для прогноза и, таким образом, дифференцированного планирования терапии при внешне сходной симптоматике болезни. При выяснении анамнеза жизни обращают внимание на условия быта, питания, труда и отдыха больного. Исключительно важны сведения о перенесённых ранее заболеваниях, в том числе инфекционных, и проводимом при этом лечении. Необходимо выяснить, сделаны ли больному профилактические прививки (какие и когда), есть ли в анамнезе указания на введение сывороток, иммуноглобулинов, препаратов крови и кровезаменителей, а также возможные реакции на них. Последовательный и детальный осмотр позволяет выявить симптомы и синдромы, характерные для инфекционного заболевания. На основе информации полученной врачом, формулируется предварительный диагноз и очерчивается круг дифференциальной диагностики. В соответствии с диагнозом (с оценкой формы и тяжести заболевания, периода болезни, наличия осложнений и сопутствующих заболеваний) врач определяет необходимость и место госпитализации больного в инфекционном стационаре. Для подтверждения диагноза используются специфические лабораторно-инструментальные методы исследования: Специфические лабораторно - инструментальные методы исследования. 1. Бактериоскопия (микроскопия), вирусоскопия (электронная микроскопия) 2. Бактериологическое (выделение чистой культуры). 3. Паразитологическое исследование (микроскопия и гельминтоовоскопия). 4. Биологический метод (заражение животных). 5. Вирусологическая диагностика (выделение вирусов и токсинов): А) цитопатическое действие на культуру клеток (ЦПД); Б) реакция нейтрализации летального эффекта на чувствительных животных и куриных эмбрионах; 6. Серологическая диагностика (идентификация при помощи иммунной диагностической сыворотки): A) реакция агглютинации развернутая (РА); Б) ориентировочная (пластинчатая) реакция агглютинации; B) реакция непрямой гемагглютинации (РНГА); Г) реакция Кумбса Д) реакция гемагглютинации (РГА) и реакция гемадсорбции (РГАдс); Е) реакция торможения гемагглютинации (РТГА) и гемадсорбции (РТГАдс); 7. Иммунологическая диагностика (идентификация антигенов и антител): A) имуноферментный анализ (ИФА); Б) метод флюорисцирующих антител (МФА); B) реакция иммуиофлюорисценции (РИФ); Г) радиоиммунологический анализ (РИА); Д) иммуноферритиновая реакция; Е) реакция преципитации (РП):
Ж) реакция связывания комплемента (РСК); 3) реакция лизиса бактерий и гемолиза; И) иммуноблотинг; К) тонкослойный иммунный анализ (ТИА). 8. Метод генной диагностики:
9. Экспресс-методы: А) иммунологический (МФА,.РНТА, ИФМ); Б) бактериоскопический. 10. Алергологическая диагностика: А). Кожные пробы со специфическими аллергенами (тулярин, туберкулин, бруцеллин, дизентерии). Б). Клеточные тесты аллергологической диагностики in vitro:
Бактериологическое исследование – включает в себя бактериоскопию, посев материала, взятого у больного, на питательные среды, выделение чистой культуры возбудителя и его идентификацию. Определение типовой принадлежности микроорганизма-возбудителя. Для выращивания бактерий применяют различные питательные среды. По назначению питательные среды подразделяют на следующие основные категории: Универсальные - среды, на которых хорошо растут многое виды патогенных и непатогенных бактерий. К ним относятся: мясо-пептонный бульон, мясо-пептонный агар. Дифференциально-диагностические — среды, позволяющие отличать одни виды бактерий от других по их ферментативной активности или культуральным проявлениям. К ним откосятся среды Эндо, Левина, Плоскирева, Гисса и многие другие. Селективные - среда, содержащие вещества, используемые микроорганизмами определенных видов и не благоприятствующие или даже препятствующие росту других микроорганизмов. Селективные среды позволяют направленно отбирать из исследуемого материала определенные виды бактерий. Сюда относятся среды Мюллера, селенитовая, Рапопорт, 1 %-ная пептонная вода и другие. Дифференциально-селективные — среды, сочетающие в себе свойства диффереяаиально-диагностических и селективных сред. Они используются, в частности, для ускорения обнаружения и идентификации бактерий, относящихся к большому числу широко распространенных видов энтеробактерий и псевдомонад (среды Сиволодского). Специальные — среды, специально приготовленные для получения роста тех бактерии, которые не растут или очень плохо растут на универсальных средах. К ним относятся среды Мак-Коя-Чепина (для получения роста возбудителя туляремии), кровяной МПА (для получения роста патогенных стрептококков), среда Левенштейна-Иенсена (для выделения возбудителя туберкулеза) и другие. Вирусологический метод основан на выделении вирусов и их идентификации с использованием культур клеток или куриных эмбрионов (облигатный внутриклеточный паразитизм вирусов накладывает отпечаток на методы их выделения – посев материала проводится не на среды, а в культуру клеток или куриные эмбрионы) Для проведения вирусологического исследования важное значение имеют: выбор материала и его предварительная обработка, условия транспортировки и соблюдение необходимых условий для культивирования вируса. Материал для исследования определяется характером вирусного заболевания, местом размножения вируса в организме и путями его выделения. Для подавления возможного роста бактерий исследуемый материал обрабатывают антибиотиками, или последние добавляют в питательную среду для выращивания культуры клеток в соответствующих концентрациях. Выбор способа культивирования (заражение лабораторных животных, куриных эмбрионов или культур клеток) определяется биологией предполагаемого возбудителя. Важное значение имеет соблюдение стандартных условий культивирования: оптимальная температура, продолжительность, использование дополнительных тестов для индикации (бляшкообразование, реакции гемадсорбции, гемагглютинации, имиунофлуоресценции и т. д.). Биологический метод основан на использовании вместо питательных сред животных, чувствительных к соответствующему возбудителю. Наиболее часто используется для быстрого получения чистой культуры из сильно загрязненного сопутствующей микрофлорой материала при лептоспирозе, чуме, Ку-лихорадке и др.) Иммунологические реакции - применяют с одинаковым успехом для двух целей. Во-первых, по известному антигену (диагностикуму) определяют в исследуемой сыворотке наличие и количественное содержание специфических к данному антигену антител. Последнее устанавливают путем титрования сыворотки. Титром иммунной сыворотки называют то ее максимальное разведение, которое еще дает положительную реакцию. Во-вторых, с помощью известного антитела, т. е. диагностической иммунной сыворотки или моноклональных антител, определяют наличие в исследуемом материале специфического микробного антигена или осуществляют серологическую идентификацию выделенного возбудителя. С диагностической целью используют следующие серологические реакции: 1. Реакция агглютинации в ее различных вариантах. 2. Реакция преципитации и ее различные модификации. 3. Реакции иммунофлуоресценции (РИФ) в прямом и непрямом вариантах. 4. Реакции, протекающие с участием комплемента. 5. Реакции, протекающие с участием фагоцитов. 6. Реакции иммуносорбентного анализа твердой фазы. 7. Реакции нейтрализации биологической активности возбудителя или токсинов. I. Реакция агглютинации Агглютинация (от лат. agglutinatio — склеивание) — склеивание (соединение) антигеннесущих корпускулярных частиц (цельные клетки, частицы латекса и др.) молекулами стецифических антител в присутствии электролитов, которое заканчивается образованием видимых невооруженным глазом хлопьев или осадка (агглютината). При помощи реакции агглютинации определяют только полные (двухвалентные) антитела. Неполные (моновалентные, блокирующие) антитела этими методами не выявляются, так как, соединяясь с антигеном, блокируют его, но не могут вызвать агрегации антигена в крупные конгломераты. Неполными (блокирующими) называют антитела, у которых функционирует только один активный центр; второй активный центр по неизвестной причине не срабатывает. Различают агглютинацию прямую, при которой во взаимодействии -со специфическими антителами непосредственно участвуют собственные антигены бактериальной или любой другой клетки, например эритроцитов; и непрямую, или пассивную, при которой бактериальные клетки или эритроциты, или частицы латекса являются носителями не собственных, а сорбированных на них чужих антигенов (или антител) для выявления специфических к ним антител (или антигенов). В реакции агглютинации участвуют главным образом антитела, относящиеся к классам IgG и IgM. Она протекает в две фазы: вначале происходит специфическое взаимодействие активного центра антител с детерминантом антигена, эта стадия может происходить в отсутствие электролитов и не сопровождается видимыми изменениями реагирующей системы. Для второй стадии — образования агглютината — необходимо наличие электролитов, которые снижают электрический заряд комплексов антиген + антитело и ускоряют процесс их склеивания. Эта фаза заканчивается образованием агглютината. Реакции агглютинации ставят либо на стеклянных, либо в пробирках. Реакции агглютинации (прямые и пассивные) на стекле обычно применяют в качестве ускоренного метода обнаружения специфических антител в сыворотке больного (например, при бруцеллезе) или для серологической идентификации возбудителя. Несомненным достоинством реакции агглютинации на стекле является простота ее постановки и то, что она протекает несколько минут или даже секунд, так как оба компонента в ней используются в концентрированном виде. Однако она имеет лишь качественное значение и менее чувствительна, чем пробирочная. Развернутая реакция агглютинации в пробирках дает более точные результаты, ибо она позволяет определить количественное содержание антител в сыворотке (установить ее титр) и при необходимости зарегистрировать факт нарастания титра антител, что имеет диагностическое значение. Для постановки реакции в агглютинационные пробирки вносят определенным образом разведенную 0,85%-ным раствором NaCl сыворотку и равный объем (обычно 0,5 мл) суспензии стандартного диагностикума (или исследуемой культуры), содержащего в 1 мл 1 млрд бактерий. Учет результатов реакции агглютинации производят предварительно через 2 ч инкубации пробирок при 37 °С и окончательно через 20-24 ч по двум признакам: наличию и величине осадка и степени прозрачности надосадочной жидкости. Оценку осуществляют по четырехкрестной системе. Реакция обязательно сопровождается контролем сыворотки к антигена. Необходимо учесть, что при смешивании растворов гомологичных антигенов и антител не всегда наблюдаются видимые проявления реакции агглютинации. Осадок образуется только при оптимальных соотношениях обоих компонентов реакции. Вне этих пределов, при значительном избытке антигена или антител, реакции не наблюдается. Это явление получило название «феномена прозоны» или ложно отрицательного результата. Он наблюдается как при реакции агглютинации, так и при реакции преципитации. Появление прозоны в иммунных реакциях объясняется тем, что участвующие в них антигены, как правило, являются полидетерминантными, а молекулы антител IgG имеют два активных центра. При избытке антител поверхность каждой частицы антигена покрывается молекулами антител так, что не остается свободных детерминантных групп, поэтому второй, несвязанный активный центр антител не может взаимодействовать с другой антигенной частицей и связывать их друг с другом. Образование видимого агглютината или преципитата подавляется также при избытке антигена, когда не остается ни одного свободного активного центра антител, и поэтому комплексы антиген + антитело + антиген не могут более укрупняться. Реакция пассивной гемагглютинации и ее варианты: Классическая реакция агглютинации предусматривает использование корпускулярных антигенов. Однако в ней могут участвовать и растворимые антигены. Чтобы это стало возможным, такие антигены адсорбируют на иммунологически инертных частицах. В качестве носителя можно использовать частицы латекса или бентонита, однако в настоящее время наиболее часто применяют эритроциты животных или человека. Эритроциты, адсорбировавшие на себе антиген, называются сенсибилизированными данным антигеном, а иммунная реакция, в которой они участвуют, — реакцией непрямой, или пассивной гемагглютинации (РНГА, или РПГА), так как эритроциты участвуют в ней пассивно. РНГА ставят в специальных пластинках с луночками, имеющими полусферическое дно. При использовании ее для серологической диагностики в этих луночках готовят двукратные разведения в физиологическом растворе исследуемой сыворотки (неизвестные АТ), а затем добавляют к ней в качестве диагностикума взвесь сенсибилизированных эритроцитов. Учет результатов проводят через 2 ч инкубации при 37 °С. При положительной реакции агглютинировавшиеся эритроциты оседают на дно луночки и равномерно покрывают его в виде перевернутого зонтика. При отрицательной реакции эритроциты тоже оседают, жидкость становится прозрачной, осадок выглядит в виде маленького «диска» в центре луночки. Титром сыворотки в РНГА считается последнее ее разведение, которое еще дает ярко выраженную гемагглютинацию. Метод не позволяет дифференцировать IgG и IgM, для того чтобы отличить острую и пастинфекцию, поэтому реакция проводится дважды на 7-ой и 14-ый день болезни. Положительным считается 4-х кратное нарастание титра антител. РНГА может применяться также в качестве ускоренного метода бактериологической диагностики для обнаружения непосредственно в исследуемом материале неизвестных бактерий, вирусов, токсинов, например возбудителей чумы, стафилококковых энтеротоксинов и др. При таком варианте постановки РНГА в роли известного компонента реакции используют эритроциты, адсорбировавшие известные по своей специфичности антитела — антительный эритроцитарный диагностикум. Вариантами использования РНГА являются: реакция нейтрализации антигена (РНАг), реакция нейтрализации антител (РНАт), реакция торможения пассивной гемагглютинации (РТПГА). Для этих реакций используют антигенные и антительные эритроцитарные диагностикумы. Можно использовать одновременно две взаимно контролирующие однонаправленные реакции, например РНГА с антигенным диагностикумом и РНАг с антительным эритроцитарным диагностнкумом. Реакция нейтрализации антител (РНАт) заключается в том, что суспензию, содержащую искомый антиген, смешивают со специфической иммунной сывороткой, содержащей известные антитела, в соответствующих объемах и инкубируют при 37 °С в течение двух часов. После этого добавляют антигенный эритроцитарный диагностикум. Смесь встряхивают и оставляют при комнатной температуре. Результаты учитывают через 3—4 ч и окончательно — через 18—24 ч. Если в исследуемом материале имеется антиген, он свяжет антитела (нейтрализует их), и гемагглютинация не произойдет. По такому же принципу ставят реакцию нейтрализации антигена (РНАг). Только в этом случае в исследуемом материале обнаруживают антитела. Реакция коагглютинации. Является одним из вариантов пассивной, т. е. опосредованной клетками-носителями, реакции агглютинации на стекле. В основу этой реакции положено уникальное свойство золотистого стафилококка, имеющего в составе своей клеточной стенки белок А, связываться с Fc-фрагментами IgG и IgM. При этом активные центры антител остаются свободными и могут взаимодействовать со специфическими детерминантами антигенов. На предметное стекло наносят каплю 2%-ной взвеси стафилококков, сенсибилизированных соответствующими антителами, и добавляют каплю взвеси исследуемых бактерий. При соответствии антигена антителам через 30—60 с происходит четкая агглютинация нагруженных антителами стафилококков. Реакция латекс-агглютинации (РАЛ или ЛАГ). Носителем антител в этой диагностической системе являются мелкие стандартные частички латекса. Реакцию выполняют в лунках на стекле. Основным условием успешной постановки ЛАГ является строгое соблюдение количественных соотношений компонентов системы. ЛАГ используют для быстрого обнаружения микроорганизмов или их антигенов в исследуемом материале. II. Антиглобулиновая проба Кумбса (реакция Р. Кумбса) Используют для выявления неполных антител. В реакции участвуют: сыворотка больного, в которой определяют неполные антитела, корпускулярный антиген-диагностикум, антиглобулиновая сыворотка, содержащая антитела к человеческому глобулину. Реакция протекает в два этапа: 1. Взаимодействие антигена с неполными антителами. Видимых проявлений при этом нет. Первый этап заканчивают отмывкой антигена от остатков сыворотки больного. 2. Взаимодействие антиглобулиновой сыворотки, полученной в результате иммунизации животного человеческим глобулином, с неполными антителами, адсорбированными на антигене. В силу того, что антиглобулиновые антитела двухвалентны, они связывают два одновалентных антитела отдельных комплексов АГ + неполное антитело, что приводит к их склеиванию и появлению видимого осадка. А 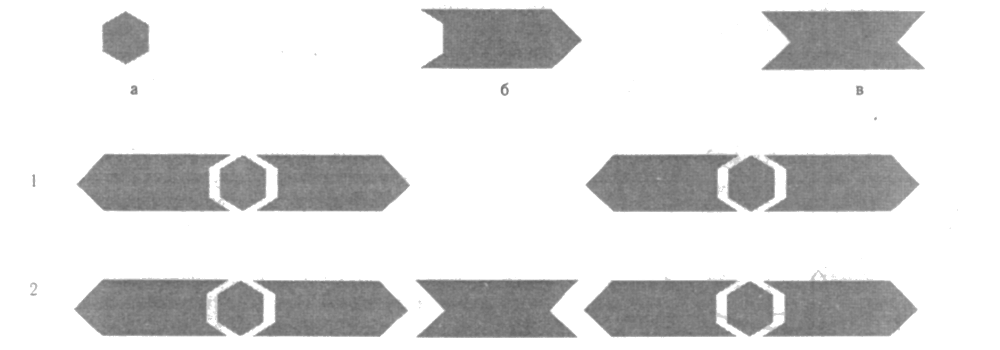 нтиглобулиновую пробу Кумбса применяют, например, при серологической диагностике бруцеллеза, при анализе групп крови, в диагностике аутоиммунных заболеваний и др. нтиглобулиновую пробу Кумбса применяют, например, при серологической диагностике бруцеллеза, при анализе групп крови, в диагностике аутоиммунных заболеваний и др.Атиглобулиновая проба Кумбса для выявления неполных антител. а — антиген: б — неполное антитело; в — антитело против моновалектного антитела (антиглобулин). 1. Соединение неполных антител с антигенами (агглютинация не происходит). 2. Добавление антиглобулиновой сыворотки приводит к агглютинации антигенов, блокированных неполными антителами. III. Реакция преципитации и ее варианты Реакции агглютинации и преципитации очень близки по своей сути. Различия между ними зависят главным образом от величины частиц антигена. Преципитацией называют процесс, когда происходит агрегация антител с растворимыми антигенами. Появление преципитата при реакции антиген-антитело определяется не только возникновением решетки, образуемой ее участниками, но и особой ролью Fc-фрагмента иммуноглобулина, изменение конформации которого приводит к утрате этим комплексом растворимости в солевых растворах. В связи с этим в реакции преципитации используют неразведенную или слабо разведенную сыворотку. Для постановки реакции преципитации необходимы: антитела — испытуемая сыворотка больного или иммунная диагностическая сыворотка (при идентификации выделенных микробов); антиген соответствующих микроорганизмов; физиологический раствор как источник электролитов. Существует множество модификаций этой реакции, которые подразделяют на две группы: преципитация в жидкой среде (реакция флоккуляции и реакция кольцепреципитации) и преципитация в геле. Реакция флоккуляции представляет собой преципитацию, при которой растворы антигенов и антител смешивают в пробирке. Учет реакции производят с помощью измерения на фотоэлектроколориметре мутности получаемой системы, что позволяет определить концентрацию исследуемого антигена. Значительно чаще применяется качественная реакция кольцепреципитации. Для ее постановки в тонкие преципитацноиные пробирки наливают сначала неразведенную преципитирующую сыворотку и сверху на нее наслаивают, не допуская перемешивания, раствор антигена. В случае гомологичности антител и антигена на границе между этими растворами быстро, через 3-10 мин, появляется кольцо преципитата. Реакция преципитации в геле является одним из наиболее эффективных методов анализа растворимых антигенов. Один из компонентов реакции преципитации, обычно сыворотка, наносится в лунку вырезанную в центре чашки с гелем, а другой — антиген — наслаивается в лунки по периферии. Антитела и антигены диффундируют навстречу друг другу, и в участках, где создаются их эквивалентные концентрации, образуются дугообразные полосы преципитации. Учет результатов проводят через 24, 48 и 72 ч инкубации при комнатной температуре. Реакцию часто применяют для определения токсигенности бактерий, например дифтерийных. IV. Реакция иммунофлуоресценции (РИФ) Молекулы иммуноглобулинов способны необратимо связываться с некоторыми химическими веществами без потери антительной специфичности и свойства связываться с антигеном. Для метки Ат можно использовать красители, флуоресцирующие при облучении их коротковолновым светом (флуорохромы), например, ультрафиолетовым. С помощью РИФ можно быстро обнаруживать даже ничтожные количества антигенов, в том числе бактериальных и вирусных, по эффекту флуоресценции комплекса антиген + антитело в люминесцентном микроскопе. V. Реакции, протекающие с участием комплемента Реакция бактериолиза. Используется для серологической диагностики холеры Феномен бактериолиза легко удается наблюдать in vitro. Исследуемую сыворотку наносят в последовательном двукратном разведении каплями на поверхность питательной среды, на которую предварительно засевают известную культуру вибриона. Чашку с посевами инкубируют при 37 °С в течение 18-20 ч. Под влиянием имеющихся в сыворотке антител и комплемента холерные вибрионы разрушаются (лизируются). и в местах нанесения капель образуются стерильные пятна. Титром вибриоцидных антител считается максимальное разведение сыворотки, при котором она еще вызывает отчетливый лизис бактерий. Реакция гемаглютинации иммунного прилипания. В основе этой реакции лежит способность комплекса антиген + антитело в присутствии комплемента адсорбироваться на эритроцитах, вызывая их склеивание. Применяется для серологической диагностики гепатита А. Характеризуется высокой чувствительностью и специфичностью. Реакция связывания комплементаУникальная способность комплемента специфически связываться с различимом во своей природе комплексами антиген + антитело нашла широкое применение в реакции связывания комплемента (РСК). Особое преимущество РСК состоит в том, что природа антигена, участвующего в ней (корпускулярный или растворимый), не имеет значения, так как комплемент связывается с Fc-фрагментом любого антитела, относящегося к IgG и IgM, независимо от его антительной специфичности. Реакцию ставят в два этапа:
VI. Реакции иммуносорбентного анализа твердой фазы В основе методов иммуносорбентного анализа твердой фазы лежит сорбция антител (для обнаружения неизвестного антигена) или антигенов (для обнаружения специфических антител) и специфических антител, меченных ферментом (нммуноферментный метод — ИФА) или изотопом (радиоимиунный метод — РИМ). Чувствительность этих методов значительно превышает чувствительность традиционных иммунологических реакций, поэтому они приобрели самое широкое распространение. Эти методы могут быть использованы для диагностики практически любого инфекционного заболевания. С их помощью можно определить как антигены любого возбудителя, так и антитела к ним, дифференцируя IgG и IgM. Методика постановки этих реакций включает три последовательных этапа: Обнаружение специфических антитгенов с помощью ИФА и РИМ Первый этап - адсорбция специфических антител твердой фазой, в качестве которой обычно используют поверхности пластиковых панелей. Когда антитела связываются со стенками лунок, у них сохраняются свободными активные центры, поэтому они способны специфически реагировать с соответствующим антигеном. Второй этап - связывание антигена из исследуемого материала за счет реакции антитело + антиген. После этого луночки промывают, дли удаления из системы других, неспецифически связанных с антителами компонентов. Третий этап — обработка специфическими антителами против данного антигена, но меченными либо ферментом, либо изотопом. Такие меченые антитела присоединяются к антигенам, а их избыток удаляется из системы промыванием. Таким образом, в случае присутствия в исследуемом материале искомого антигена на поверхности твердой фазы формируется комплекс антитело + антиген + меченое антитело. Результаты реакции учитывают в зависимости от характера метки. Для иммуноферментного метода антитела метят ферментом, чаще всего пероксидазой или щелочной фосфатазой. Добавление в опытную луночку раствора субстрата приводит к тому, что он подвергается действию пероксидазы, фиксированной на антителах, образующиеся продукты реакции имеют желтую окраску, интенсивность которой может быть определена путем фотометрии. Радиоиммунный метод (РИМ) предусматривает использование антител, меченных изотопом, поэтому результаты реакции оценивают путем определения радиоактивности исследуемых образцов. При положительной реакции уровень радиоактивности опытных образцов более чем в 2 раза превышает уровень радиоактивности контрольных, заведомо отрицательных образцов. Обнаружение специфических антител с помощью ИФА и РИМ Для обнаружения антител реакции также ставят в три этапа. Первый этап — адсорбция специфических антигенов на стенках луночек. Обычно планшеты в коммерческих тест-системах уже имеют сенсибилизированные луночки, т. е. на их дне а стенках антигены уже адсорбированы. Второй этап — добавление в луночки образцов исследуемой сыворотки для обнаружения в ней специфических антител к данному антигену. Если они имеются, то вступают во взаимодействие с антигеном и образуют комплекс антиген + антитело. Третий этап — после отмывания луночек в них добавляют специфические антиглобулиновые антитела (т. е. антитела против человеческих иммуноглобулинов), но меченные ферментом (ИФА) либо изотопом (РИМ). Результаты реакции оценивают, как указано выше. В качестве контроля используют образцы, заведомо положительные и заведомо отрицательные. Предложены различные варианты иммуноферментного метода. Большое значение имеет вариант ИФМ, позволяющий осуществлять «захват» только антител, относящихся к IgM. Этот метод позволяет более точно производить серологическую диагностику, так как основан на обнаружении специфических иммуноглобулинов IgM, которые появляются при первой встрече с возбудителем. VII. Реакции нейтрализации Этот тип иммунологических реакций основан на способности антител специфически подавлять (нейтрализовать) биологическую активность возбудителя или его токсинов в различных тест-системах: в организме животных, в куриных эмбрионах, культурах клеток или каким-то иным способом. Например, для оценки эффективности иммунизации против дифтерии и столбняка определяют уровни антитоксинов в сыворотке крови привитых по их способности нейтрализовать биологическое действие определенной дозы токсина (реакция Шика). Однако реакции нейтрализации применяют и с диагностическими целями. Особенно широкое применение они получили в вирусологической практике как для серологической диагностики вирусных заболеваний, так и для идентификации вирусов. С этой целью, используют реакции нейтрализации роста, вирусов в культуреклеток, подавления бляшкообразования, гемадсорбции, торможения гемагглютинации (РТТА) и др. До тех пор. пока не была выяснена химическая природа антител, полагали, что каждая, реакция иммунной .сыворотки опосредуется особым видом антител, которые получили соответственно название агглютининов, преципитинов, опсонинов, антитоксинов и т. п. Хотя, эта названия сохранились, они имеют чисто феноменологическое значение, т. е. отражают конечный результат взаимодействия антитела с антигеном. В настоящее время уже ясно, что нет специальных антител - агглютининов, преципитинов и т. д., а есть 5 классов иммуноглобулинов. Специфичность антител, относящихся к любому классу иммуноглобулинов, определяется структурой его активного центра, причем антитела данной специфичности могут относиться к разным классам. Конечный исход взаимодействия антигена с антителами зависит от природы антигена (корпускулярный - агглютинация, растворимый - преципитация); от участия системы комплемента (бактериолиз, бактерицидное действие); макрофагов; от того, к какому классу иммуноглобулинов относится данное антитело; от свойств его Fc-фрагмента. Разные классы иммуноглобулинов в неодинаковой степени участвуют в различных иммунологических реакциях. Например, в реакциях агглютинации наиболее активны, антитела, относящиеся к IgM и IgG, в реакции связывания комплемента участвуют главным, образом антитела IgG, а в реакции лизиса с участием лизоцима и комплемента — только IgA. VIII. Иммуноблотинг - современный высокочувствительный метод идентификации белков, в том числе вирусных антигенов. Метод основан на комбинации гельэлектрофореза и реакции антиген-антитело. Высокая степень разрешения достигается за счет электрофоретического разделения белков, глико- и липопротеинов и максимальной специфичностью детектирующих иммунных сывороток или моноклональных антител. В оптимально отработанных условиях иммуноблотингом можно обнаруживать антиген в количествах менее 1 нг в испытуемом объеме. Технически иммуноблотинг выполняется в три приема: 1) подлежащие анализу белки подвергаются разделению в полиакриламидном геле в присутствии денатурирующих веществ. 2) разделенные белки переносятся с геля путем наложения (блотинга) на нитроцеллюлозный фильтр и фиксируются на нем; при переносе сохраняются количественные соотношения белков; 3) на фильтры наносятся детектирующие поли- или моноклональные антитела, содержащие радиоизотопную или ферментную метку; для обнаружения связавшихся антител применяют также антивидовую меченую сыворотку, иными словами, на заключительном этане блотинг аналогичен твердофазным иммунологическим тестам. Иммуноблотинг достаточно широко используется в исследованиях строения вирусов гепатитов, в частности, для установления антигенного родства между отдельными штаммами. IX. Тонкослойный иммунный анализ с аутосывороткой (ТИА) Чашки Петри ополаскивают этиловым спиртом, высушивают на воздухе и заливают агаром с толщиной слоя 3 мм. В агаре делают 3 лунки диаметром 3 мм. В каждую лунку вносят по 0,025 мл сыворотки крови исследуемого больного. Чашки Петри выдерживают при температуре 37 С в течение 48 ч. , а затем лунки отмывают водой. В одну лунку вносят 0,025 мл антигена описторхисов (для обнаруженя Ат в сыворотке больного). В другую лунку вносят 0,025 мл надосадочной жидкости фекалий больного. (Для получения надосадочной жидкости 1 г фекалий больного помещают в центрифужную пробирку, добавляют 9 мл 0,85% раствора хлорида натрия. Содержимое перемешивают и кипятят над пламенем спиртовки 5 мин.) В третью лунку вносят 0.025 мл изотонического раствора хлорида натрия (контроль). Чашки закрывают и выдерживают при комнатной температуре в течение 1 ч. Затем агар удаляют, чашки ополаскивают водой и высушивают в токе воздуха. Чашки экспонируют над водяной баней при температуре 56 С в течение 1 мин на расстоянии 8-10 см от поверхности воды. Реакция считается положительной, если в месте контакта сыворотки и с надосадочной жидкостью фекалий, и с описторхозным антигеном образовались крупные капли конденсата, а на других, не сенсибилизированных сывороткой участках, - мелкие капли. Таким образом, реакция ТИА считается положительной в случае обнаружения и антигенов описторхисов в фекалиях, и противоописторхозных антител в сыворотке крови. Используется в диагностике описторхоза. Метод цепной полимеразной реакция (ПЦР)- один из наиболее перспективных способов исследования в современной биологии и медицине. Он может быть использован для выявления любых генов, любых фрагментов нуклеиновых кислот. В его основе лежит способность однонитевых молекул нуклеиновых кислот вступать во взаимодействие с комплементарными нитями и образовывать двунитевые гибридные молекулы. Исследуемую клеточную суспензию лизируют для высвобождения нуклеиновых кислот. После этого двухцепочечную ДНК предварительно денатурируют, а образующиеся одноцепочечные молекулы переносят на мембрану, где они ковалентно связываются с ДНК-зондом, который представляет собой меченные изотопом или ферментом денатурированные молекулы нуклеиновой кислоты. Гибридизация происходит лишь в том случае, если между зондом и иммобилизованной на мембране нитью ДНК имеется гомология. Аллергологические методы. Кожные пробы со специфическими аллергенами. Аллерген вводят внутрикожно или наносят на скарифицированную кожу. У больного сенсибилизированного к данному виду микроорганизма, на месте введения специфического аллергена через 24-48 ч развивается воспалительная реакция (положительный результат). Примером могут служить положительные внутрикожные реакции на тулярин (туляремия), туберкулин (туберкулез), бруцеллин (бруцеллез, проба Бюрне), Малеин (сап), дизентерин (дизентерия, проба Цуверкалова) токсоплазмин (токсоплазмоз). Пример: Методы, используемые в диагностике вирусных заболеваний: 1. Вирусоскопический. 2. Иммунной электронной микроскопии. 3. Вирусологический. 4. Серологический. 5. Иммунофлуоресцентный. 6. Биологический. 7. Цепная полимеразная реакция. . Серологические методы могут быть использованы для обнаружения в исследуемом материале как специфических антител, так и вирусных антигенов. Для этих целей могут быть использованы все известные серологические реакции: 1. Реакция связывания комплемента. 2. Реакция пассивной гемагглютинации и ее варианты (РНАг, РНАт). 3. Реакция торможения гемагглютинации. 4. Реакция гемагглютинации иммунного прилипания (комплекс антиген + антитело в присутствии комплемента адсорбируется на эритроцитах). 5. Реакции преципитации в геле. 6. Реакции нейтрализации вирусов. 7. Радиоиммунный метод. 8. Методы иммуноферментного анализа. Из перечисленных методов всe большей популярностью пользуются методы иммуноферментного анализа, отличающиеся высокой специфичностью и удобством использования. |
