Аналитика (1-14 вопросы). Дисциплина Аналитическая химия и фхма
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
14. Хроматометрия: сущность метода, общая характеристика, достоинства и недостатки. Применения хроматометрии для определения железа в рудах и сплавах. Хроматометрия − метод окислительно-восстановительного титрования, основанный на реакциях окисления восстановителей дихроматом калия K2Cr2O7, или (реже) хроматом калия K2CrO4. По основному реактиву этот метод иногда называют дихроматометрией. Обычно титрование проводят в кислой среде, дихромат при этом восстанавливается по уравнению: Cr2O72− + 14Н+ + 6е 2Cr3+ + 7Н2О (2.6) Из уравнения (2.6) следует, что 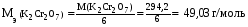 . .Стандартный окислительно-восстановительный потенциал этой системы (при [Н+] = 1 моль/л) E0(Cr2O72−/2Cr3+) = 1,36 В, т.е. дихромат калия является довольно сильным окислителем. В хроматометрии используют прямое, обратное титрование и метод замещения. Дихромат калия способен окислять многие неорганические и органические вещества: Fe(II), Mn(III), Mn(IV), V(IV), Mo(V), Te(IV), Ti(III), сульфиты, дитионаты, гексацианоферрат (II),арсенит, йодид, спирты, гидрохинон, глицерин, аскорбиновую кислоту и др. Дихромат калия используется и для определения окислителей (U(VI), V(V), Mo(VI), Fe(III), Co(III), NO3−, ClO3−, H2O2 и др.). Метод основан на предварительном восстановлении окислителей до соединений низшей степени окисления (например, в редукторе Джонса) и последующем титровании полученных восстановленных форм стандартным раствором дихромата калия; или окислители восстанавливают стандартным раствором восстановителя (чаще всего ионами Fe2+, например, раствором соли Мора – FeSO4∙(NH4)2SO46H2O) с последующим титрованием избытка восстановителя дихроматом. Например, для определения нитратов к анализируемому раствору прибавляют избыток соли железа (II) и полученную смесь кипятят. При этом протекает окислительно-восстановительная реакция: nFe2+ + NO3− + 4H+ 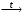 3Fe3+ + NO + 2H2O + (n−3) Fe2+(изб.) 3Fe3+ + NO + 2H2O + (n−3) Fe2+(изб.)Затем избыток ионов железа (II) оттитровывают дихроматом: 6(n−3)Fe2+ + (n−3)Cr2O72− + 14(n−3)Н+ → 6(n−3)Fe3+ + 2(n−3)Cr3+ + 7(n−3) H2O По сравнению с другими методами окислительно-восстановительного титрования, и в частности по сравнению с методом перманганатометрии метод хроматометрии имеет следующие достоинства: 1. Перекристаллизацией из водного раствора с последующим высушиванием при 2000С легко получить химически чистый дихромат калия строго соответствующий формуле K2Cr2O7. Поэтому стандартный раствор дихромата калия готовят по точной его навеске. Полученный раствор можно использовать как для титрования, так и для стандартизации растворов других веществ. 2. Растворы дихромата калия очень устойчивы. K2Cr2O7 не разлагается даже при кипячении в подкисленном растворе, поэтому титр раствора K2Cr2O7 не изменяется в течение длительного времени. 3. Титрование дихроматом калия можно проводить в солянокислой среде. При этом на холоду ионы Cl− не окисляются, т.к. E0(Cl2 /2Cl−) = 1,358 В, т.е. практически равен потенциалу дихромата (1,36 В). Однако, при концентрации HCl более 2 н. или при кипячении дихромат калия окисляет ионы Cl− до свободного хлора. 4. Дихромат труднее, чем перманганат восстанавливается органическими веществами, попадающими в дистиллированную воду. К недостаткам метода относятся: 1. Дихромат калия менее сильный окислитель, чем перманганат, и поэтому он используется относительно меньше. 2. Окислительно-восстановительные реакции с участием дихромата протекают относительно медленно. Скорость реакции заметно повышается в сильно кислых средах, т.к. окислительно-восстановительный потенциал системы возрастает по мере увеличения концентрации ионов водорода (см. уравнение 1.3). Однако иногда прямое титрование оказывается неосуществимо, и в методе хроматометрии часто используют обратное титрование. 3. В процессе титрования дихроматом образуются ионы Cr3+ , придающие раствору зеленую окраску. Сам дихромат окрашен в оранжевый цвет, и в конечной точке титрования одна лишняя капля дихромата вызовет изменение окраски из зеленой в желто-зеленую. Однако такой переход виден не очень отчетливо, поэтому конечную точку титрования устанавливают с помощью индикаторов, в качестве которых используют дифениламин, дифениламинсульфокислоту, фенилантраниловую кислоту, или инструментальными методами (потенциометрический, кондуктометрический, амперометрический и др.). Методом хроматометрии можно определять почти те же вещества, что и методом перманганатометрии. Наиболее широко хроматометрия используется для определения урана, который предварительно переводят в U(IV), и особенно ― содержания железа в рудах и сплавах. Образцы растворяют в серной или соляной кислотах, при этом железо получается в виде ионов Fe2+ и Fe3+. Последние восстанавливают хлоридом олова SnCl2 или металлическим цинком и титруют дихроматом калия в присутствии дифениламина по уравнению: K2Cr2 O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+ K2SO4+7H2O В процессе титрования происходит окисление дифениламином 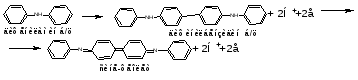 Е0=0,76 В рТ=0,76±0,03В Скачек титрования 0,944-1,302В Т.е дифенил амин должен изменять окраску за долю до скачка титрования. Что бы этого избежать титрование ведут в присутствие Н3PO4 который связывает ионы Fe3+ в прочный комплекс. Fe2(SO4)3+4 Н3PO4 =2H3[Fe(PO4)2]+3H2SO4 В результате получается концентрация свободных ионов Fe3+ что приводит к снижению о/в потенциала скачек титрования смещается в область более низких потенциалов в соответствующий интервал перехода дифениламина. Хроматометрическое определение органических веществ применения не получило в связи с неполнотой протекания многих реакций и появлением побочных продуктов (СО наряду с СО2 и др.), количество которых контролировать не удавалось. Однако ряд веществ (метанол, глицерин и некоторые другие) легко окисляется дихроматом до СО2 и H2O, и их хроматометрическое определение имеет практическое значение. |
