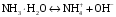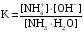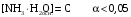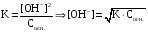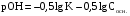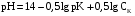Аналитика (1-14 вопросы). Дисциплина Аналитическая химия и фхма
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
Дисциплина: Аналитическая химия и ФХМА
1. Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Аналитическая классификация катионов и анионов. Дробный и систематический анализ. Основы качественного анализа. Аналитические реакции, их чувствительность и специфичность. Обычно исследуемое вещество переводят в раствор и подвергают систематическому, химическому анализу с помощью аналитических реакций. Аналитические реакции должны обладать внешним эффектом, изменение окраски раствора, выделение осадка определенного цвета и структуры или выделение газа. Так как большинство неорганических веществ в растворах дисоцируются на ионы, то анализ сводится к обнаружению этих ионов. 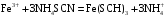 - аналитическая реакция - аналитическая реакцияFe3+ - открытый ион; Fe(SCN)3 – красный раствор; NH4SCN – реагент. Не все реакции, сопровождающиеся внешним эффектом, могут использоваться в анализах. Аналитическая реакция должна удовлетворять требованиям специфичности и чувствительности. Специфичными называются реакции и реагенты с помощью которых можно обнаруживать данный ион в присутствии любых других ионов. 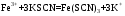 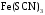 - красный раствор - красный растворСпецифичных реакций и реагентов сравнительно немного, чаще используются селективные или групповые реагенты, которые дают сходные внешние эффекты с небольшим числом ионов. 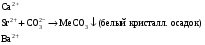 Аналитическая реакция должна давать возможность обнаружить в растворе очень небольшое количество вещества. Если реакция происходит даже в присутствии ничтожно малой концентрации определенного иона, она называется чувствительной. Количественно-чувствительная реакция – выражается 3 взаимосвязанными параметрами: 1) открываемый минимум – наименьшее количество вещества, которое может быть обнаружено с помощью данной реакции при определенных условиях: К+ K2[PtCl6] m=5 мкг 2) открываемая минимальная концентрация – показывает, при какой наименьшей концентрации раствора данная реакция позволяет обнаружить ион из небольшой порции раствора. Минимальная концентрация выражается отношением массы определяемого вещества, к массе или объему раствора [Сmin , г/см3 (г/г)] K2[PtCl6] Сmin=1:10000 3) предельное разбавление (Wпред) – это величина обратная минимальной концентрации и выражается числом миллилитров раствора, содержащего 1 грамм определяемого иона, который можно обнаруживать с помощью данной реакции. 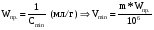 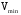 - это минимальный объем раствора необходимый для обнаружения ионов - это минимальный объем раствора необходимый для обнаружения ионов(1 капля = 0,02-0,05 мл) При выполнении аналитических реакций следует соблюдать определенные условия, важнейшими из которых являются концентрация раствора, температура и рН. Еще одно условие выполнения аналитических реакций является качество применяемых реактивов. На производстве и в лаборатории используют реактивы следующей классификации: технически чистые (ч), чистые для анализа (ч.д.а.), химически чистые (х.ч.), особо чистые, оптически чистые, спектроскопически чистые. Для химического анализа используют х.ч. и ч.д.а. Аналитическая классификация ионов. Для удобства обнаружения ионов их делят на аналитические группы. Ионы одной группы обладают сходными аналитическими свойствами и можно перевести в осадок и отделить от ионов других групп, действием группового реагента. Аналитическая классификация катионов. В соответствии с классическим сероводородным методом катионы делят на 5 аналитических групп в зависимости от свойств их сульфидов, гидроксидов и карбонатов.
Аналитическая классификация анионов. Чаще всего анионы делят на 3 аналитические группы в зависимости от отношения к солям бария Ва2+ и серебра Ag+.
Дробный и систематический анализ. Дробным анализом называется обнаружение ионов в отдельных небольших порциях раствора с помощью специфических реакций, при этом последовательность обнаружения может быть произвольной: 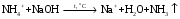 При химическом анализе, часто одни ионы мешают обнаружению других. Систематический анализ это определенная последовательность выполнения аналитических реакций при которой каждый ион обнаруживается после того как обнаружены и удалены из раствора все мешающие ионы. Пример: раствор с ионами Ca2+, Sr2+, Ва2+. 1) в отдельной небольшой порции раствора обнаруживают ион Ва2+ действием K2CrO4 в уксуснокислой среде: Ва2+ + CrO42- = BaCrO4 ↓(желт. кристалл. осадок) 2) при обнаружении ионов Ва2+ его осаждают из всей порции раствора по той же реакции; 3) обнаруживают ион Sr2+ действием (NH4)2SO4: Sr2+ + SO42- = SrSO4↓ (белый, кристалл. осадок) 4) при обнаружении иона Sr2+ его осаждают из всей порции раствора по той же реакции; 5) обнаруживают ионы Са2+ действием H2C2O4: Са2++ С2О42- = СаС2О4↓ (оксалат кальция; кристалл. осадок). 2. Электролитическая диссоциация. Слабые и сильные электролиты. Константа диссоциации. Состояние сильных электролитов в растворе. Активность, коэффициент активности. Ионная сила раствора. Электролитическая диссоциация – это процесс распада молекул электролита на ионы под действием полярных молекул растворителя. У многих электролитов на ионы распадаются лишь часть молекул. Степень электролитической диссоциации(α) – это отношение числа молекул электролита распавшихся на ионы к общему числу молекул электролитов в растворе. 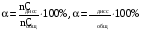 В зависимости от степени диссоциации различают: 1) α>30% (α>0,3) – сильные электролиты (большинство растворов солей, щелочей, HCl, HBr, HJ, HNO3, H2SO4 и др.); 2) 3%<α<30% (0,03<α<0,3) – электролиты средней силы (HF, H3PO4, H2SO3, H2C2O4 и др.); 3) α<3% (α<0,03) – слабые электролиты (H2S, NH3*H2O, H2CO3, H2SiO3, CH3COOH, H2O, HNO2, HCN и др.). Процесс диссоциации слабых электролитов и электролитов средней силы является обратимым и не подчиняется закону действующим масс. 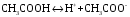 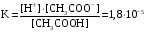 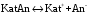 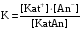 К отвечающая диссоциации слабого электролита называется константой электролитической диссоциации и является для данного электролита при данной температуре постоянной величиной. К количественно характеризует способность электролита распадаться на ионы, чем она выше, тем больше ионов находится в растворе. Пусть С – концентрация слабого электролита в растворе, тогда С·α – концентрация каждого из ионов. С - С·α = С·(1-α) 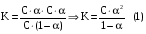 Если α<<1 (α<<0,05), то 1-α ≈ 1 Тогда (1) может быть записан как: 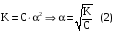 Формулы (1) и (2) являются выражением закона разбавления Освальда. При разбавлении раствора степень диссоциации слабого электролита возрастает. Многоосновные кислоты диссоциируют ступенчато, преимущественно по первой ступени. Каждой ступени соответствует своя константа и α. Сильные электролиты. Сильные электролиты диссоциируют практически полностью α=1. В растворах сильных электролитов количество ионов довольно велико, а расстояние между ними сравнительно не большое, в таких растворах действуют электростатические силы межионного взаимодействия, в результате каждый ион оказывается, окружен слоем ионов противоположного знака, так называемые ионные атмосферы. Ионная сила значительно снижает подвижность ионов, поэтому степень диссоциации сильного электролита, вычисленная на основании измерений электропроводности является кажущейся и всегда меньше 100%. Для оценки реального состояния электролитов в растворе пользуются величиной активности (а). Это та эффективная концентрация сильного электролита и его ионов в растворе в соответствии, с которой, они действуют в химических реакциях. 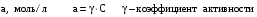 Для предельно разбавленных растворов: 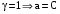 Для реальных растворов: 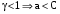 Коэффициент активности зависит от зарядов ионов и их концентрации. Коэффициент активности тем меньше, чем больше концентрация и больше заряд. 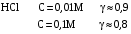 Величина коэффициента активности зависит не только от концентрации данного иона, но и от концентрации всех других ионов содержащихся в растворе. В растворах сильных электролитов все ионы взаимодействуют между собой. Мерой электростатического взаимодействия между всеми ионами находящимися в растворе является ионная сила раствора. 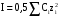 Сi- концентрация каждого из ионов; zi – заряд этого иона. Зависимость коэффициента активности от ионной силы раствора выражается уравнением Дебая – Гюккеля: 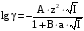 А, В – константы, зависящие от t0 и диэлектрической проницаемости растворителя. Пример: Н2О, t=200A=0,5, B=0,3. а – расстояние максимальное сближение ионов. Пример: a=3A0, 1A0=10-10м 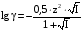 Если I<0,01 тогда 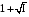 ≈1 ≈1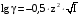 Подстановка значений активности к выражению К делает применимым закон действующих масс к реальным растворам   3. Ионное произведение воды, водородный показатель (рН). Расчет рН и рОН в растворах сильных и слабых кислот и оснований. Н2О – слабый электролит 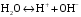 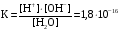 Т.к. Кд очень мала, то константа не диссоциированных молекул практически равна концентрации воды [H2O]=CH2O 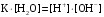 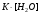 - ионное произведение воды. - ионное произведение воды.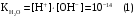 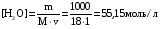 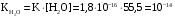 При постоянной t0 произведение концентрации ионов [H+] и [ОН-] в растворе является постоянной величиной. При этом концентрация каждого из ионов может изменяться в широких пределах. По преобладанию в растворе ионов Н+ или ОН- судят о реакции среды: 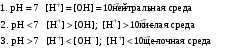 На практике для характеристики реакции среды пользуются водородные, реже гидроксильные показатели. 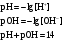 Зависимость (1) справедлива для чистой воды и очень разбавленных растворов электролитов. Для реальных растворов следует пользоваться значениями активности: 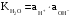 Расчет концентрации ионов и рН сильных и слабых кислот и оснований Для сильных кислот: HCl ↔ H+ + Cl- 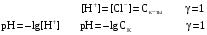 Если раствор не очень разбавленный, то при расчете следует учитывать активность ионов 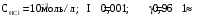 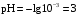 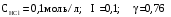 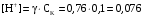 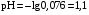 Для сильных оснований: 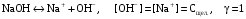   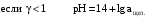 Для слабых кислот: 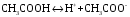 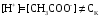 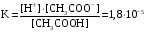 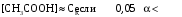 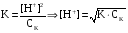 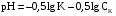 -lgK=pK 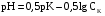 Если α > 0,05 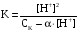 Для слабых оснований: Если α > 0,05, то смотреть как у слабых кислот Для слабых многоосновных кислот: 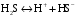 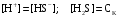 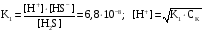 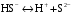 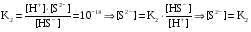 Т.к. К1 >> K2 расчет концентрации ионов Н+ производится по первой ступени | ||||||||||||||||||||||||||||||||||||||||||||||