Тест по химии для 11 класса. Дополнительное задание по химии 11кл. Дополнительное задание по химии 11 класс
 Скачать 110.94 Kb. Скачать 110.94 Kb.
|
|
Дополнительное задание по химии 11 класс Дисперсной называют систему, в которой одно вещество в виде мелких частиц распределено в объёме другого. Дисперсная фаза – это вещество, которое присутствует в дисперсионной системе в меньшем количестве. Она может состоять и из нескольких веществ. Дисперсионная среда – это вещество, которое присутствует в дисперсионной системе в большем количестве, и в объеме которого распределена дисперсная фаза. Заполните таблицу агрегатные состояния дисперсионной среды и фазы
На рисунке изображена модель электронного строения атома некоторого химического элемента. 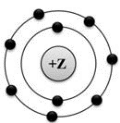 На основании анализа предложенной модели выполните следующие задания: 1) определите химический элемент, атом которого имеет такое электронное строение; 2) укажите количество протонов, которые содержит этот элемент; 3) укажите количество заполненных энергетических уровней; 4) определите максимальную валентность этого элемента Ответы запишите в таблицу.
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне. Учитывая эти закономерности, расположите в порядке увеличения неметаллических свойств, следующие элементы: Na, Cl, Al, Si. Запишите обозначения элементов в нужной последовательности. Ответ: ____________________________ Атом водорода, соединенный с атомом фтора, кислорода или азота (реже - хлора, серы или других неметаллов), может образовывать еще одну дополнительную связь. Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. Из предложенных соединений выберите 2 соединения, между молекулами которых образуются водородные связи: этаналь, этанол, водород, аммиак, кислород. Запишите ответ в отведенном месте: _________________________ _________________________ Солеобразующие оксиды классифицируют на три группы, как показано на схеме. В эту схему впишите пропущенные названия групп и приведите по два примера химических формул веществ, принадлежащих данной группе. 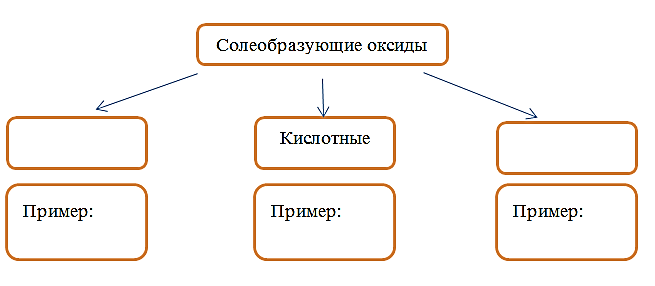 Прочитайте следующий текст и выполните задания 6–8. Сульфат бария часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %. Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами. В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе. Кроме того, сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси. 1) Составьте молекулярное уравнение реакции получения сульфата бария из пероксида бария, которая упоминалась в тексте. Ответ: _____________________________________________________ Объясните, почему сульфат бария не оказывает токсического влияния на организм. Ответ: ________________________________________________________________ ___________________________________________________________________________________________ 1) Составьте молекулярное уравнение реакции между хлоридом бария и сульфатом натрия. Ответ: _________________________________________________________________ Объясните, какие особенности этой реакции позволяют использовать хлорид бария в аналитической химии. Ответ: ________________________________________________________________ 1) Составьте сокращенное ионное уравнение реакции между хлоридом бария и сульфатом натрия. Ответ: _____________________________________________________________ 2) Объясните, почему нитрат бария предпочтительней сульфата бария в качестве цветового компонента для пиротехнических средств ______________________________________________________________________________________________________________________________________________________________________________ Дана схема окислительно-восстановительной реакции PH3 + KMnO4 + H2SO4 → MnSO4 + H3PO4 + K2SO4 + H2O Составьте электронный баланс этой реакции ______________________________________________________________________ Укажите окислитель и восстановитель ______________________________________________________________________ Расставьте коэффициенты в уравнении реакции ______________________________________________________________________ Дана схема превращений: Al → Na[Al(OH)4] → AlCl3 → Al(OH)3 Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения ________________________________________________________________ ________________________________________________________________ _________________________________________________________________ Установите соответствие между названием органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. НАЗВАНИЕ ВЕЩЕСТВА КЛАСС/ГРУППА А) Толуол 1) спирты Б) Ацетилен 2) алкены В) Этанол 3) арены 4) алкины Запишите в таблицу выбранные цифры под соответствующими буквами.
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты CaC2 + H2O → …….. + ………………. CH3NH2 + ……….. → ……….. + N2 + H2O Глауберова соль Na2SO4*10H2O применяется при лечении желудочно-кишечных заболеваний как слабительное. Сколько (г) Na2SO4.10H2O нужно для приготовления 250 г раствора, с массовой долей Na2SO4, равной 5%. Запишите подробное решение задачи. Запишите подробное решение задачи. Ацетон является популярным растворителем, применяется как сырье для синтеза многих важных химических продуктов, таких как уксусный ангидрид, метилметакрилат. Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. В соответствии с приведенной ниже схемой составьте уравнения реакций получения ацетона. При написании уравнений реакций используйте структурные формулы органических веществ. 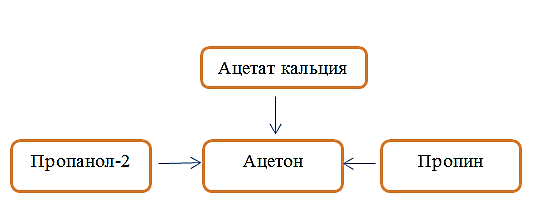 _________________________________________________________ _________________________________________________________ _________________________________________________________ |
