3.2. Д. Основы термодинамики (дополнительные вопросы)
|
Газ массой m с молярной массой М участвует в изотермическом процессе, при температуре Т, в котором ему передается теплота Q, а газ совершает работу А, увеличивая свой объем от V1 до V2. При этом:
|
1. Q = A; 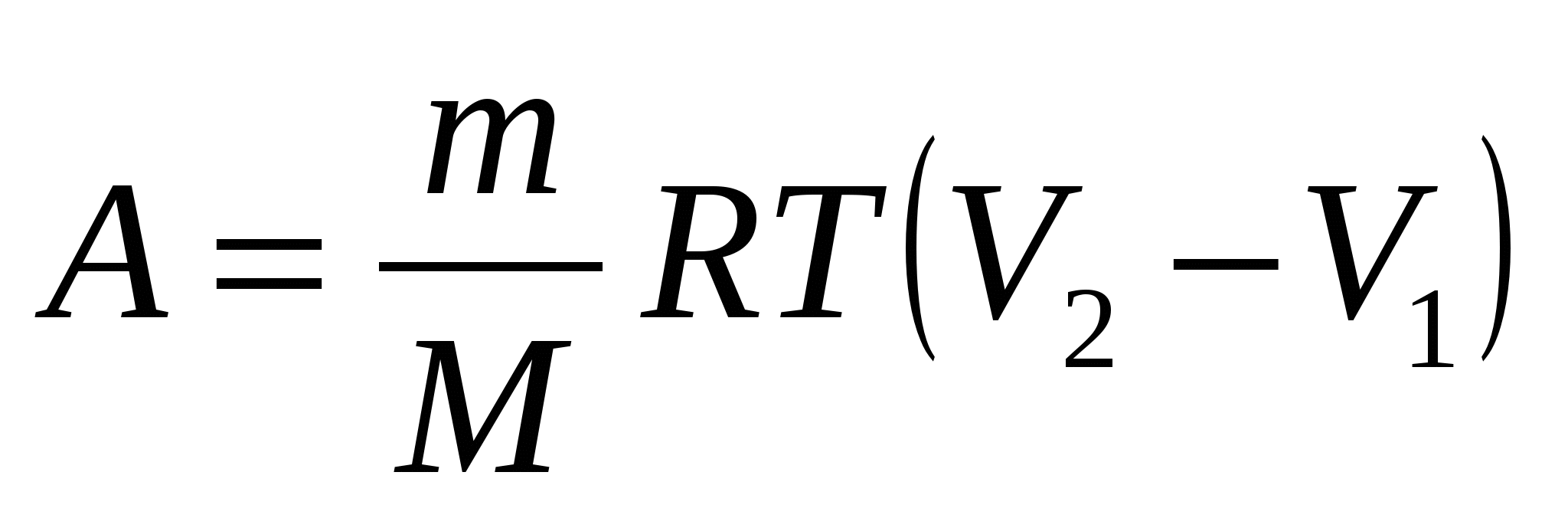 . .
2. Q > A; 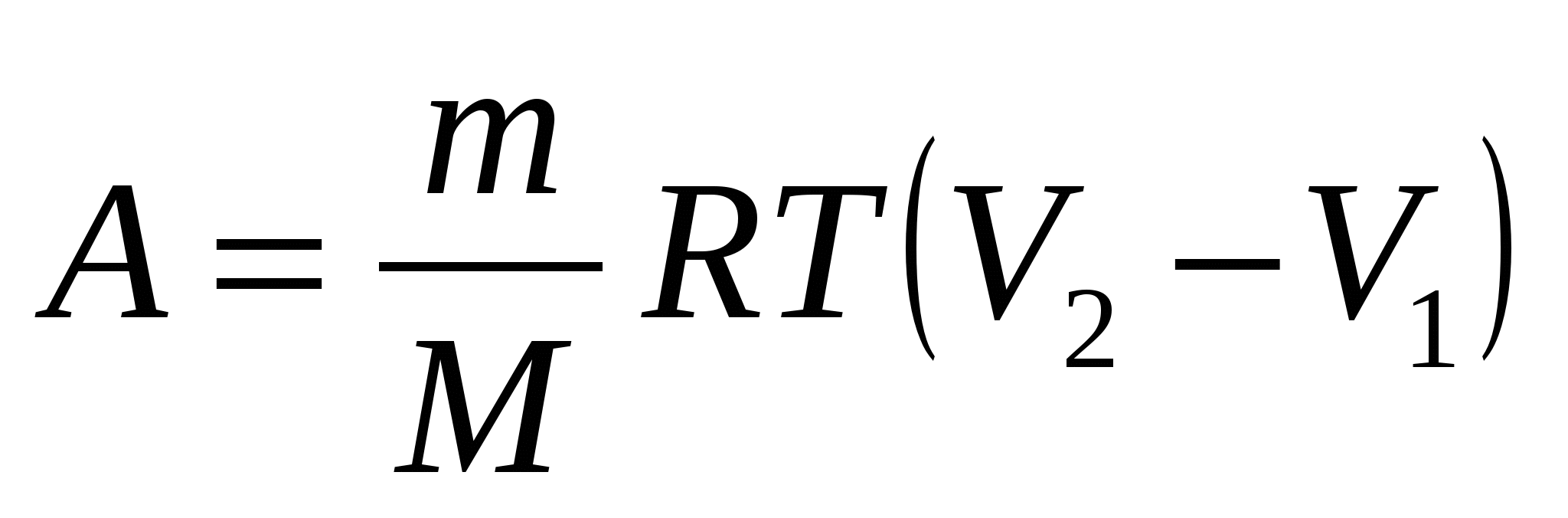 . .
3. Q = A; 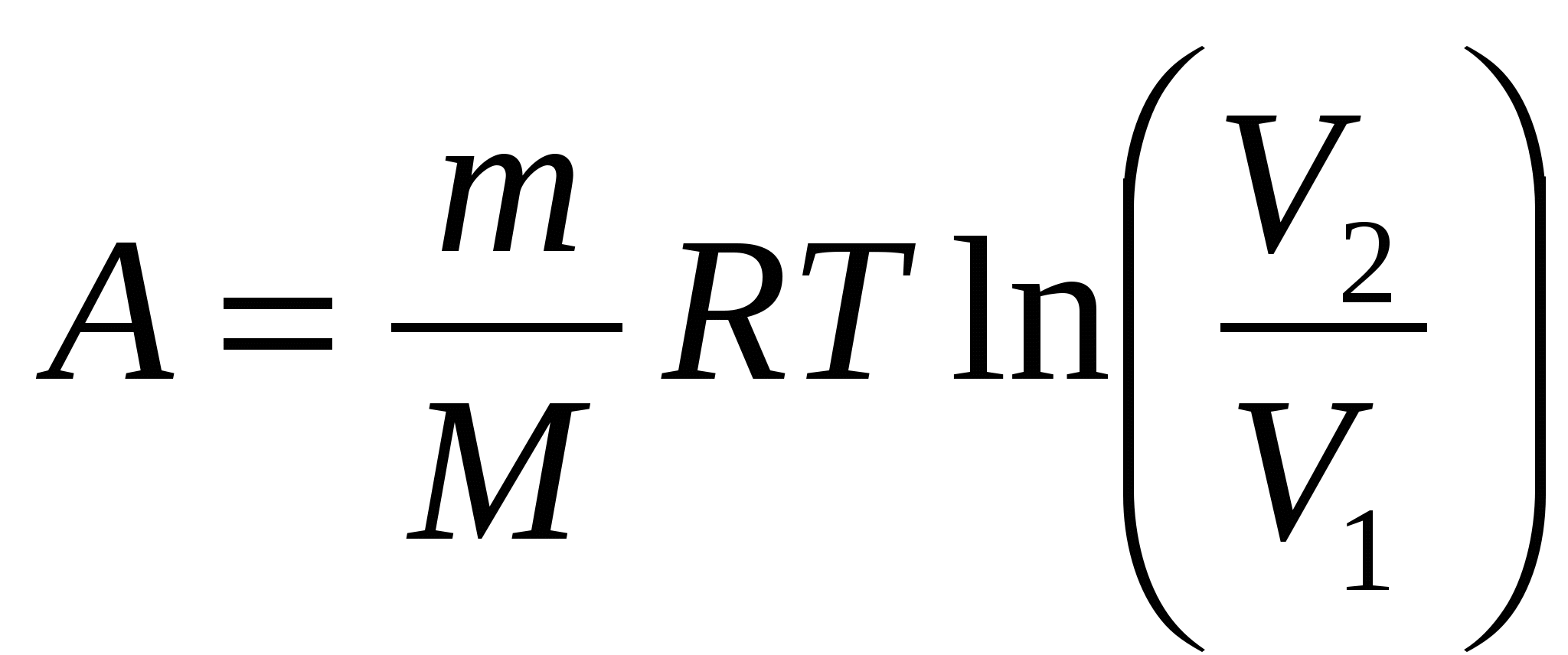 !.! !.!
4. Q < A; 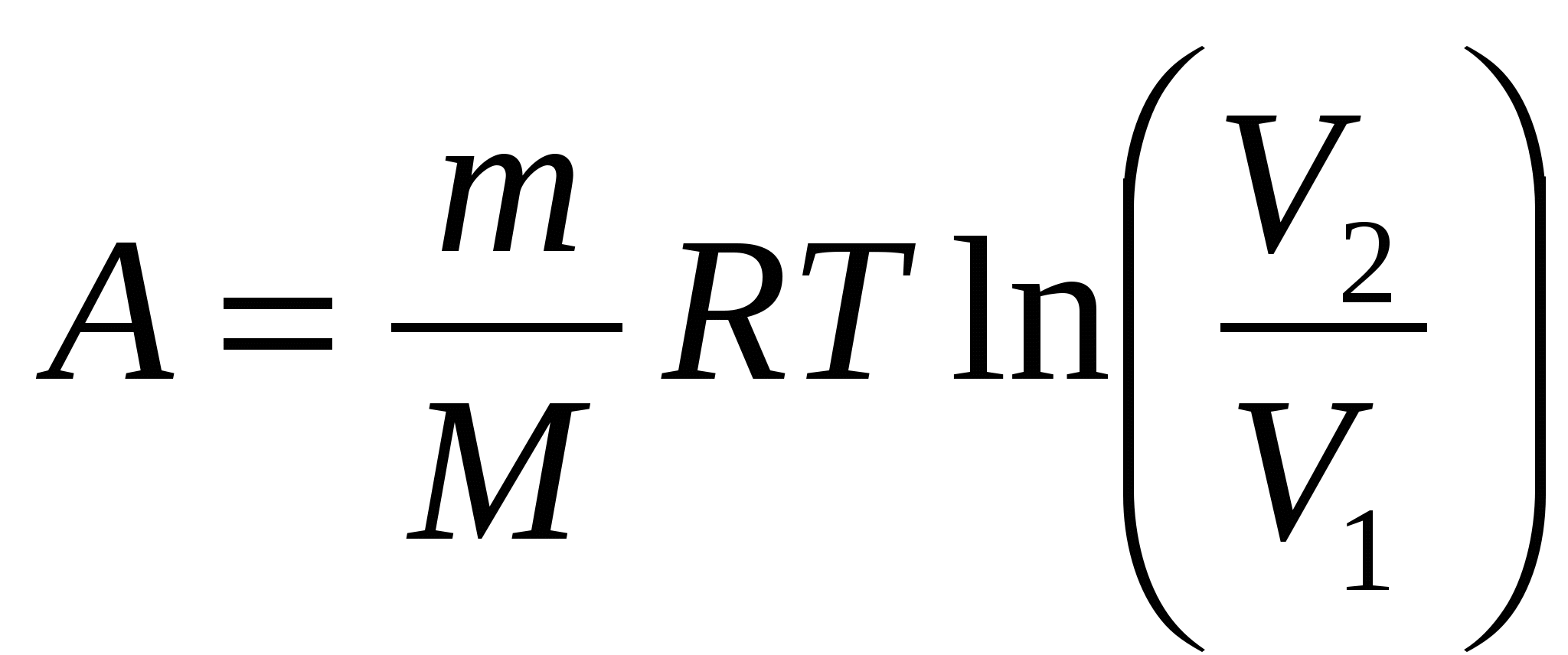 . .
|
|
Величина, которая характеризует количество микросостояний, посредством которых осуществляется данное макросостояние, называется…
|
1. масса макросостояния.
2. молярная масса макросостояния.
3. статистический вес макросостояния.!
4. логарифм статистического веса.
|
|
Какая из перечисленных величин не является аддитивной величиной?
|
1. Статистический вес макросостояния.
2. Логарифм статистического веса.
3. Масса.!
4. Молярная масса.
|
|
При изохорическом процессе изменение энтропии S равно …
(m – масса, М – молярная масса, V1, T1 и V2, T2 – начальные и конечные объемы и температуры, соответственно, СV – молярная теплоемкость при постоянном объеме, R – универсальная газовая постоянная)
|
1. 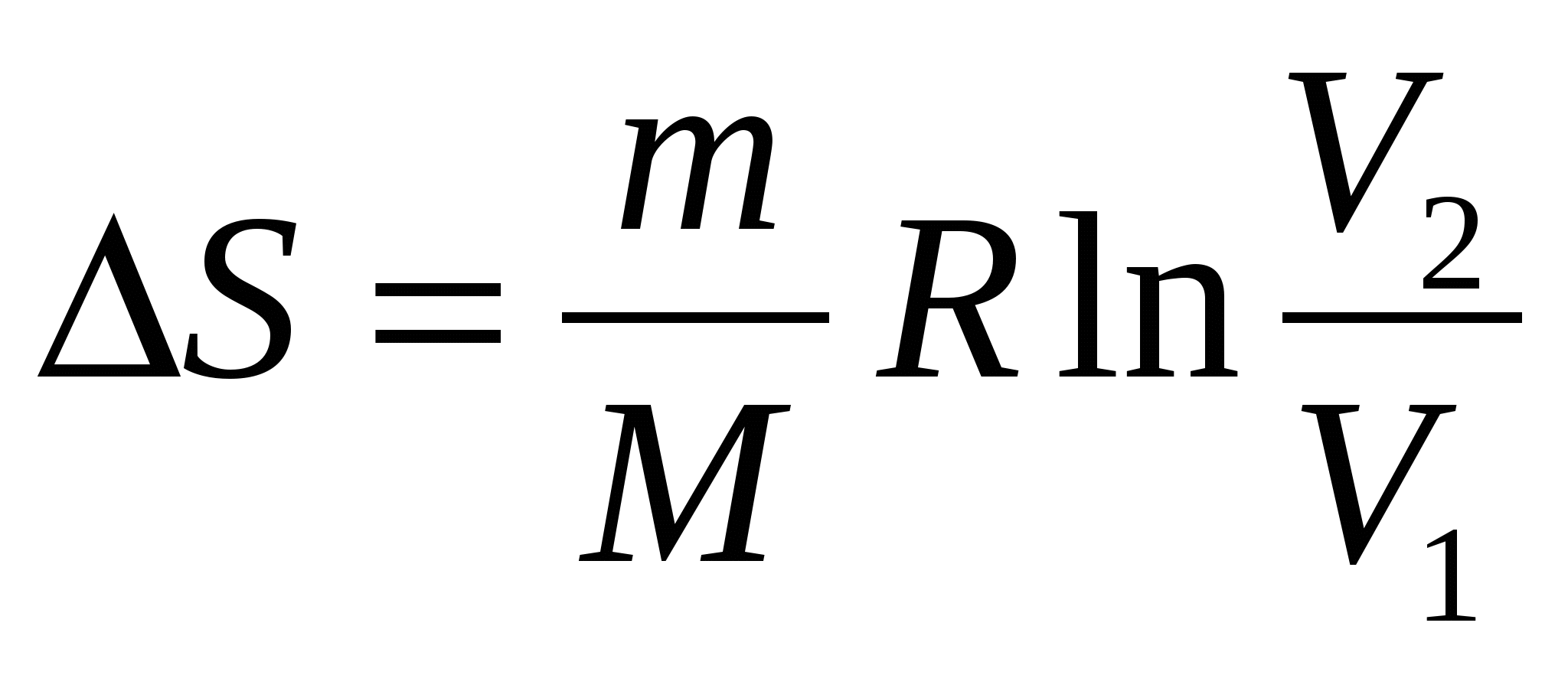 .! .!
2. 0.
3. 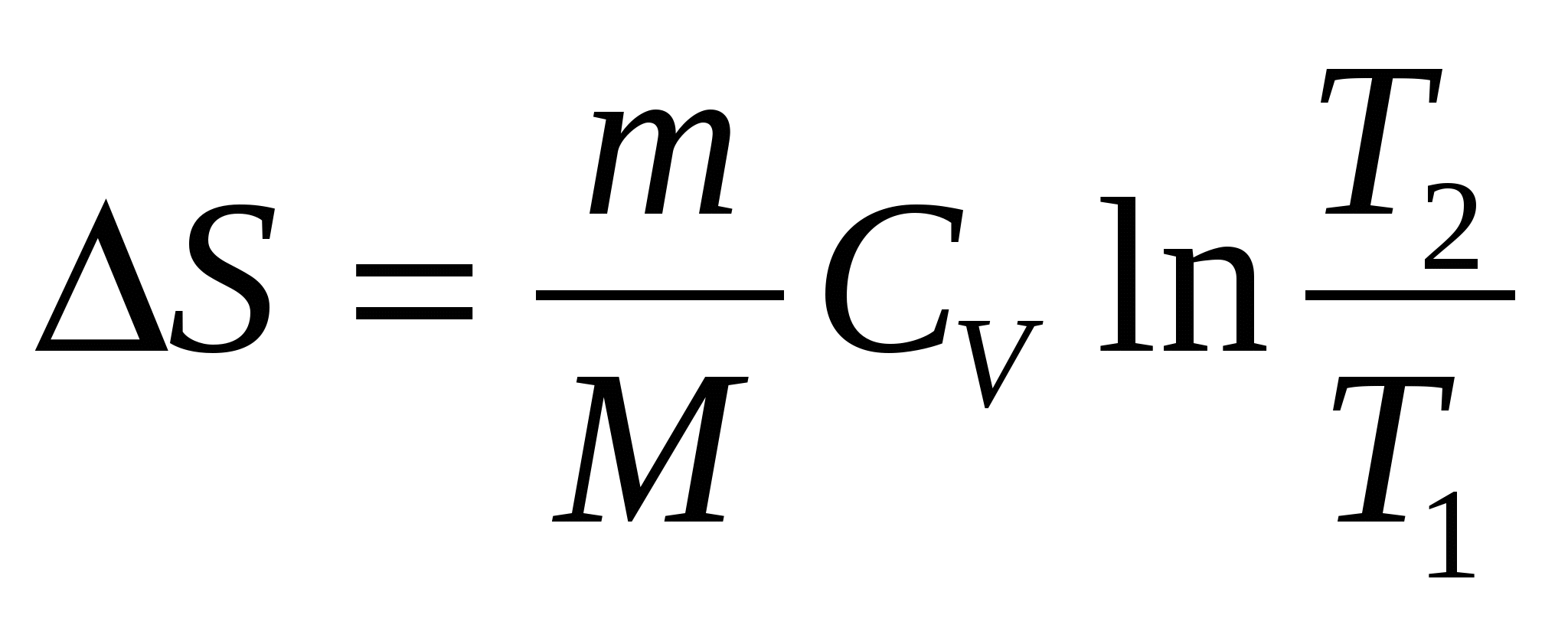 . .
4. 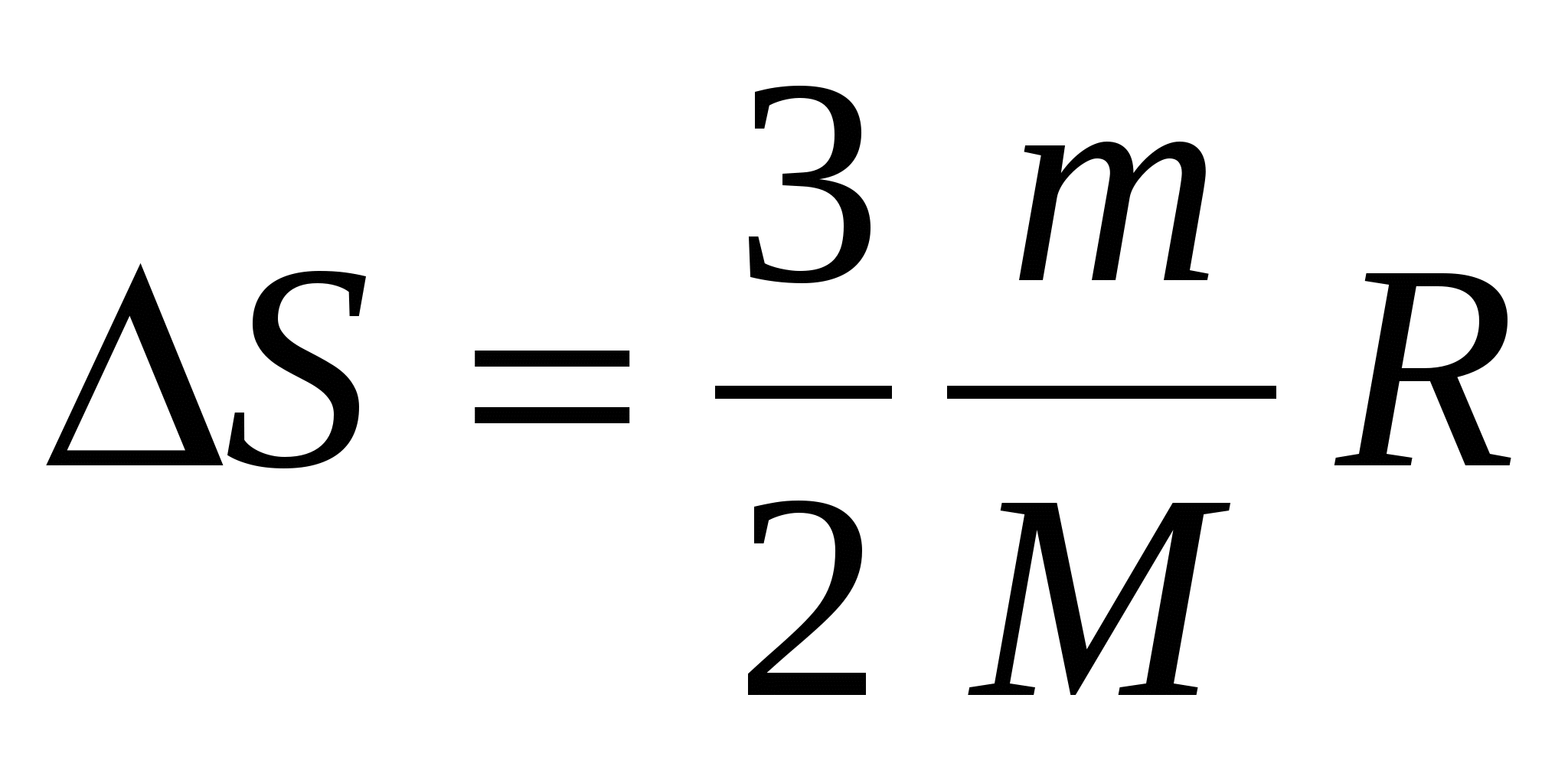 . .
|
|
Приведенным количеством теплоты называется …
|
1. отношение теплоты, полученной телом в изотермическом процессе к температуре теплоотдающего тела.
2. количество теплоты на единицу массы.!
3. количество теплоты на один Кельвин.
4. количество теплоты, полученное за одну секунду (в СИ).
|
|
Выражение для изменения энтропии 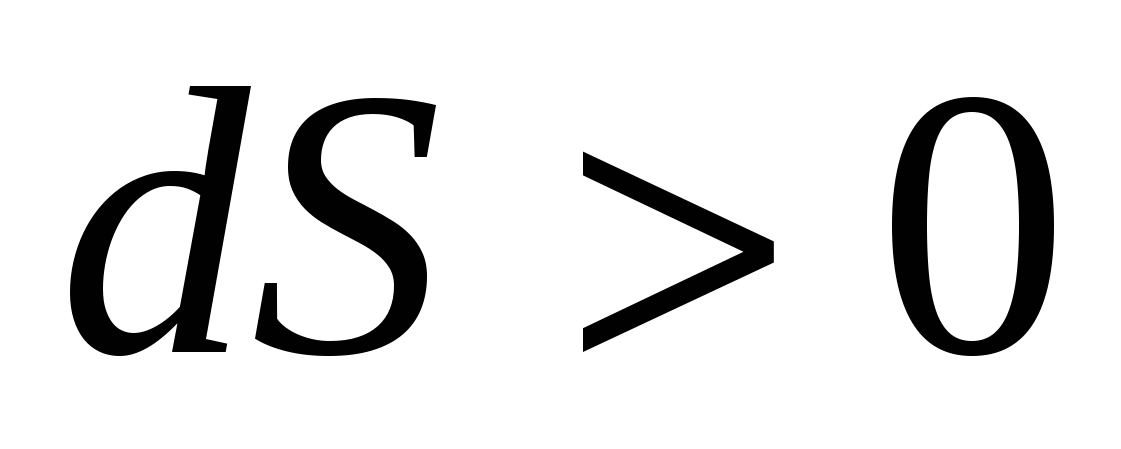 описывает… описывает…
|
1. необратимый процесс в изолированной системе.
2. необратимый процесс в неизолированной системе.
3. обратимый процесс в изолированной системе.
4. обратимый процесс в неизолированной системе.!
|
|
Выражение для изменения энтропии 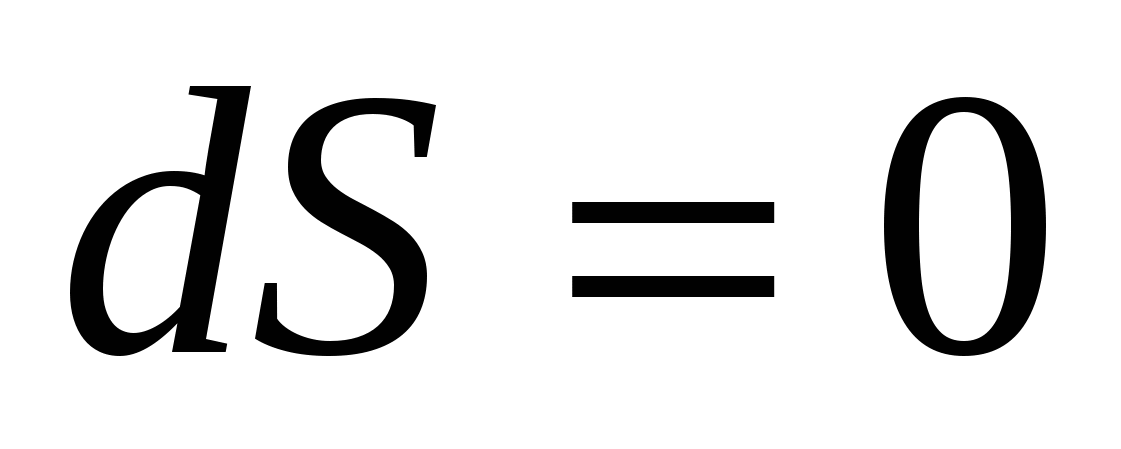 описывает… описывает…
|
1. необратимый процесс в изолированной системе.!
2. необратимый процесс в неизолированной системе.
3. обратимый процесс в изолированной системе.
4. обратимый процесс в неизолированной системе.
|
|
Обратимый процесс в неизолированной системе описывает выражение для изменения энтропии …
|
1. 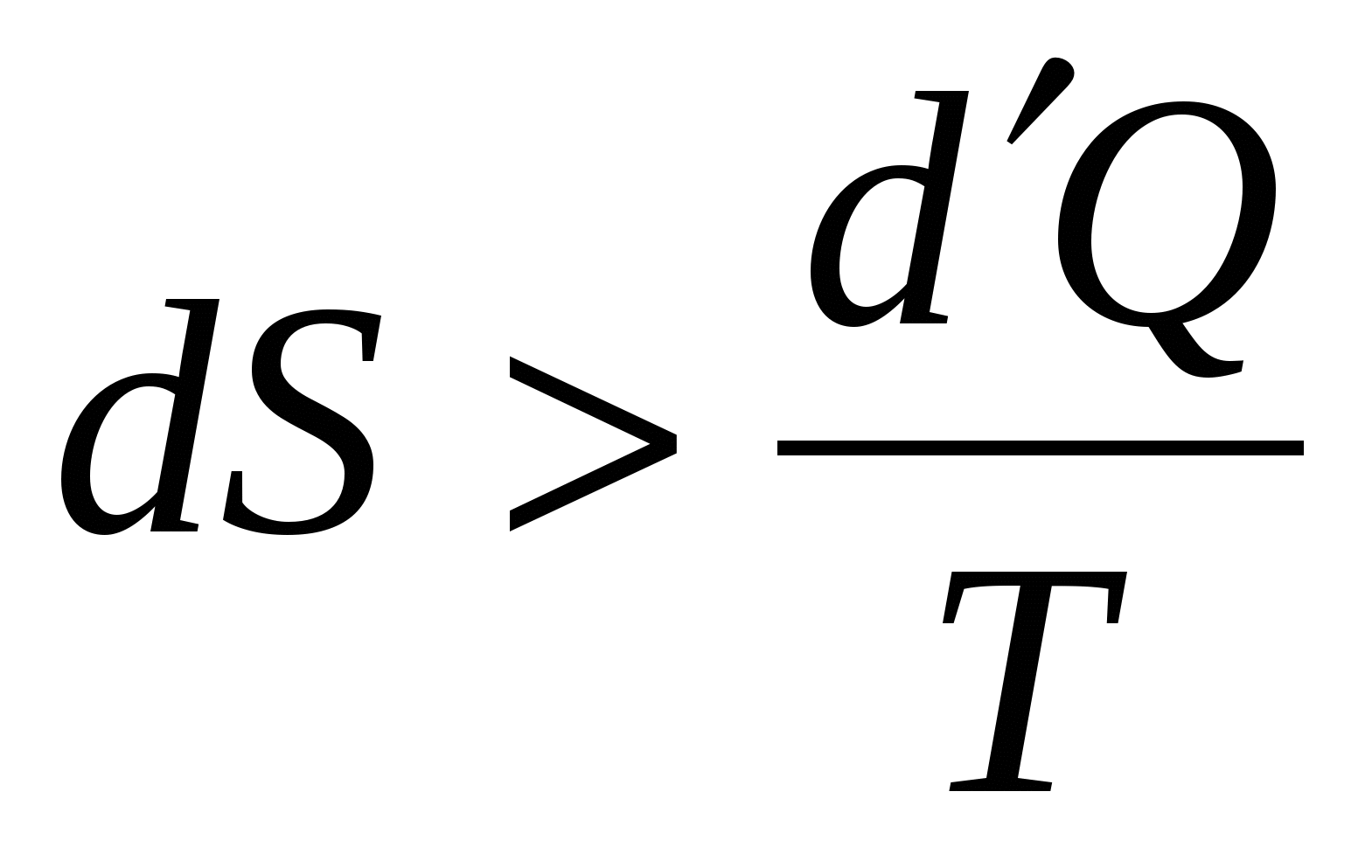 . .
2. 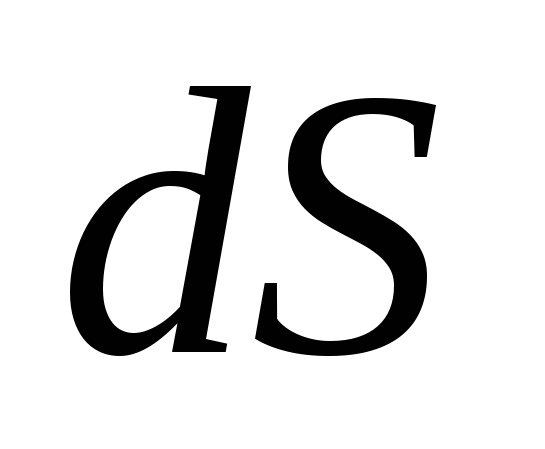 = 0. = 0.
3. 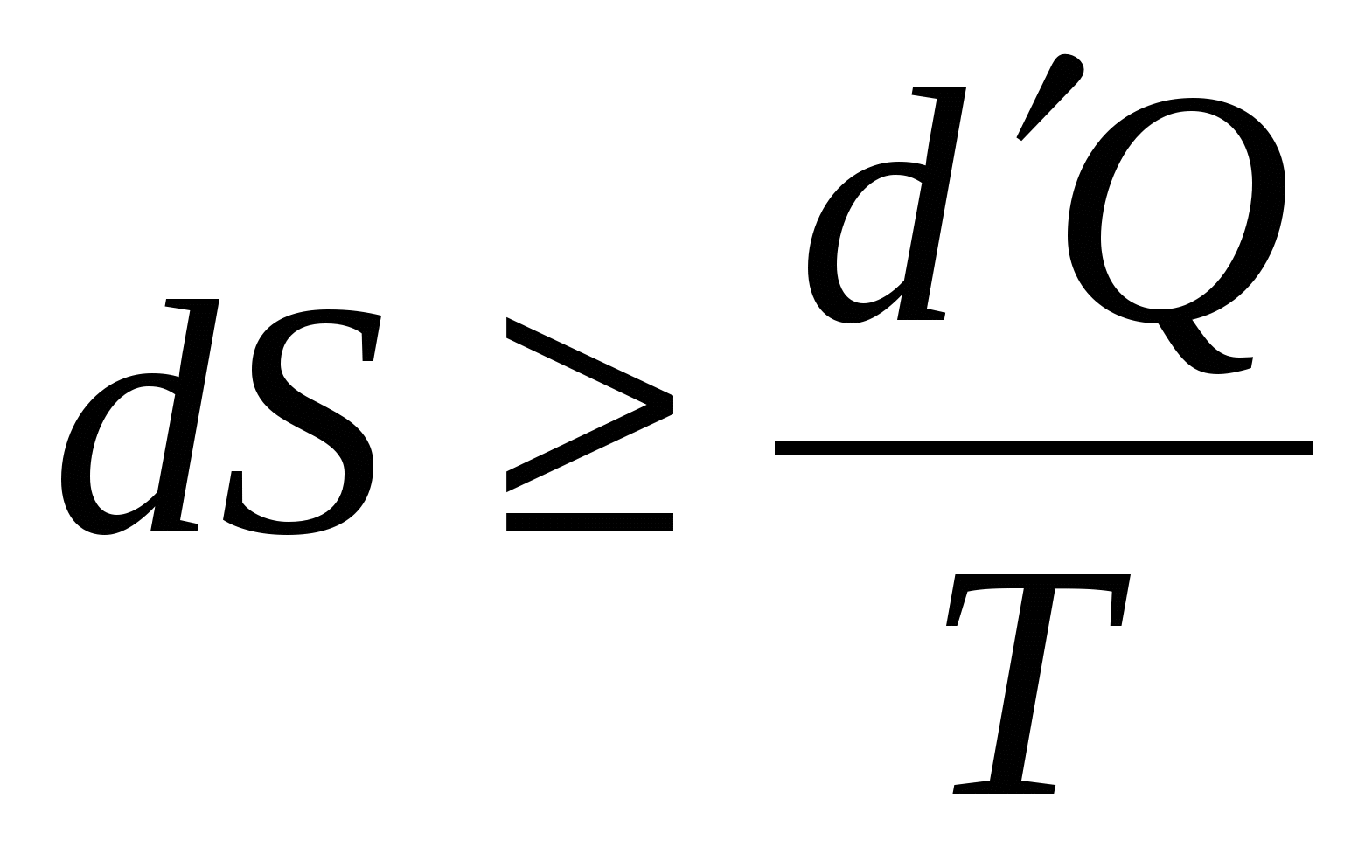 . .
4. 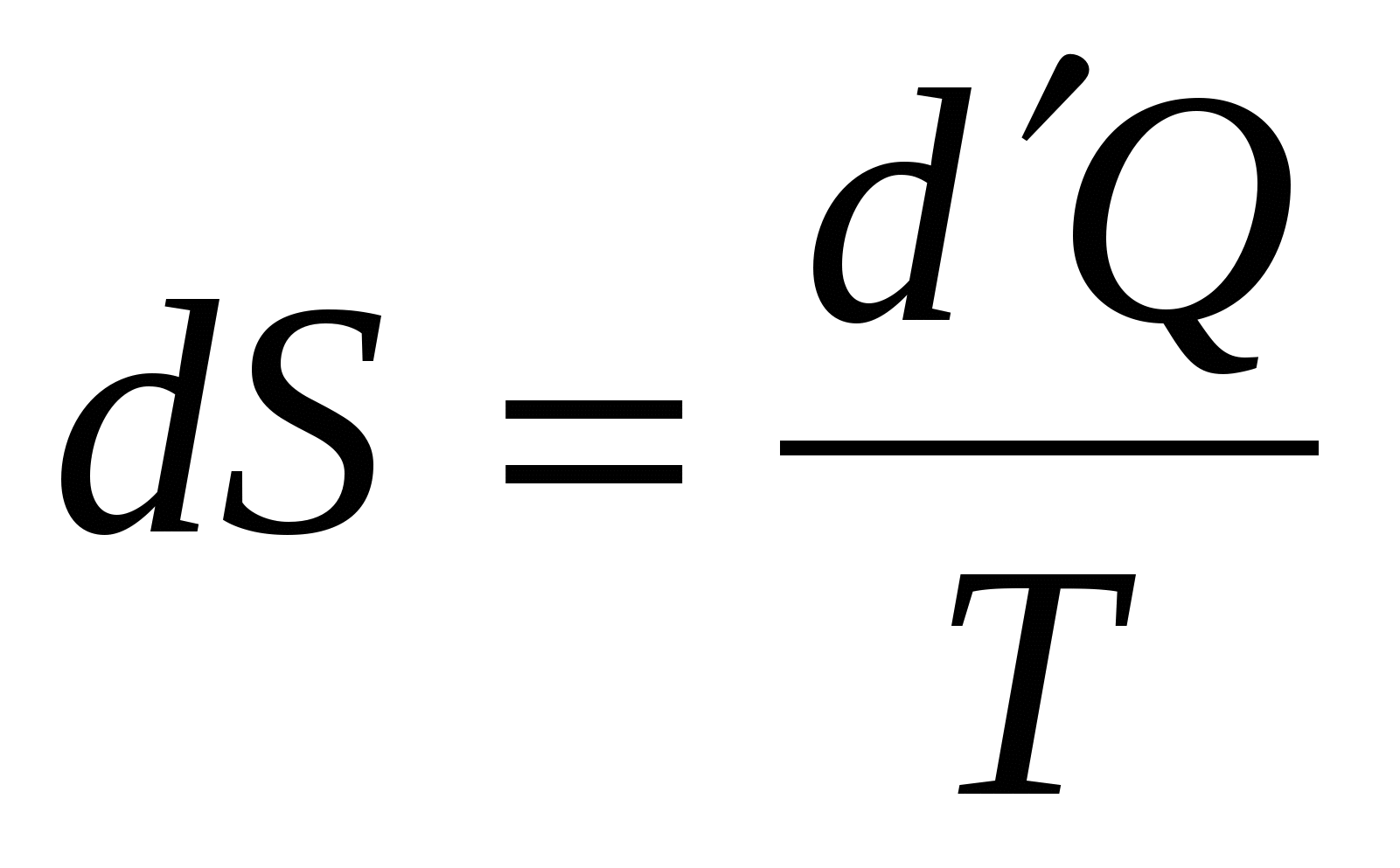 .! .!
|
|
Энтропия термодинамической системы является мерой…
|
1. хаоса в термодинамической системе.
2. инертности в термодинамической системе.
3. беспорядка в термодинамической системе.!
4. взаимодействия в термодинамической системе.
|
|
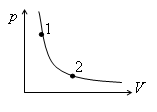
Точки 1 и 2 лежат на одной адиабате. В каком из состояний, 1 или 2, выше температура и больше энтропия?
|
1. Температура и энтропия больше в точке 2.
2. Температура выше в точке 1, энтропия одинакова в обеих точках.!
3. Температура выше в точке 2, энтропия больше в точке 1.
4. Температура выше в точке 2, энтропия одинакова в обеих точках.
|
|
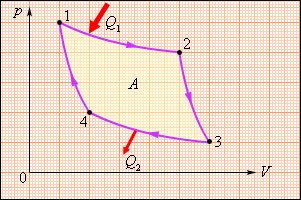
Цикл Карно в координатах p – V содержит…
|
1. две изотермы и две изохоры.
2. две изохоры и две адиабаты.
3. две изотермы и две изобары.
4. две адиабаты и две изотермы.!
|
|
К.п.д. идеальной тепловой машины при повышении температуры холодильника …
|
1. возрастает.!
2. убывает.
3. не изменяется.
4. возрастает, только если в работе участвует идеальный газ.
|
|
Если в некотором процессе подведённая к газу теплота равна изменению его внутренней энергии, то есть Q = U, то такой процесс является…
|
1. изохорическим.!
2. изотермическим.
3. политропическим.
4. адиабатическим.
|
|
Если в некотором процессе газ совершает работу за счёт подведённой к газу теплоты при неизменной внутренней энергии, то такой процесс является…
|
1. изохорическим.
2. политропическим.
3. изотермическим.!
4. адиабатическим.
|
3.3. Б. Реальные газы, жидкости, твёрдые тела (базовые вопросы)
|
|
Уравнение 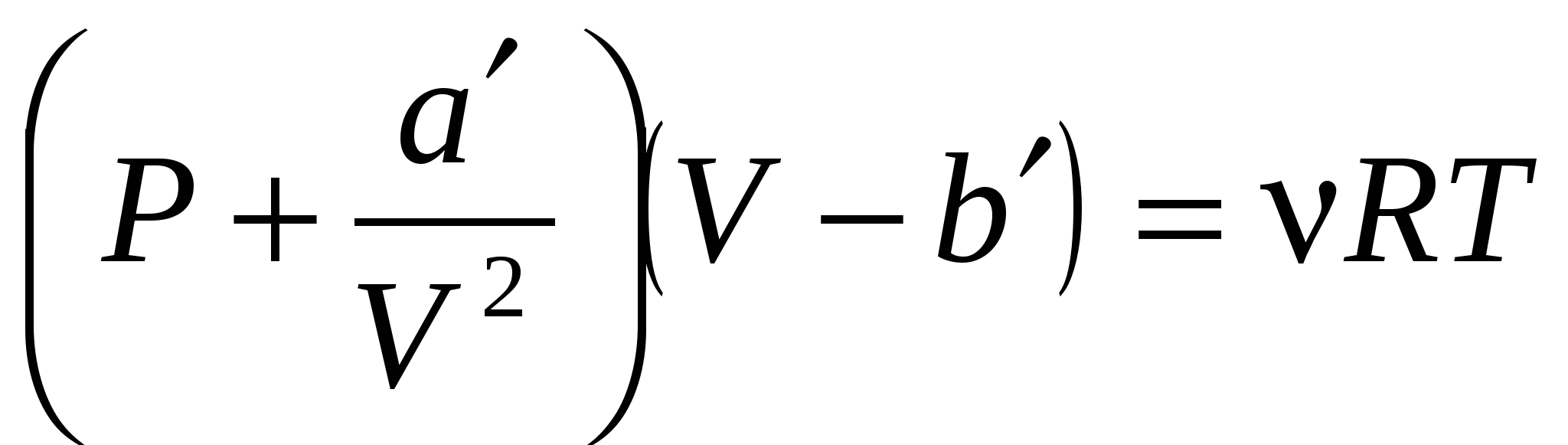 , ,
где: (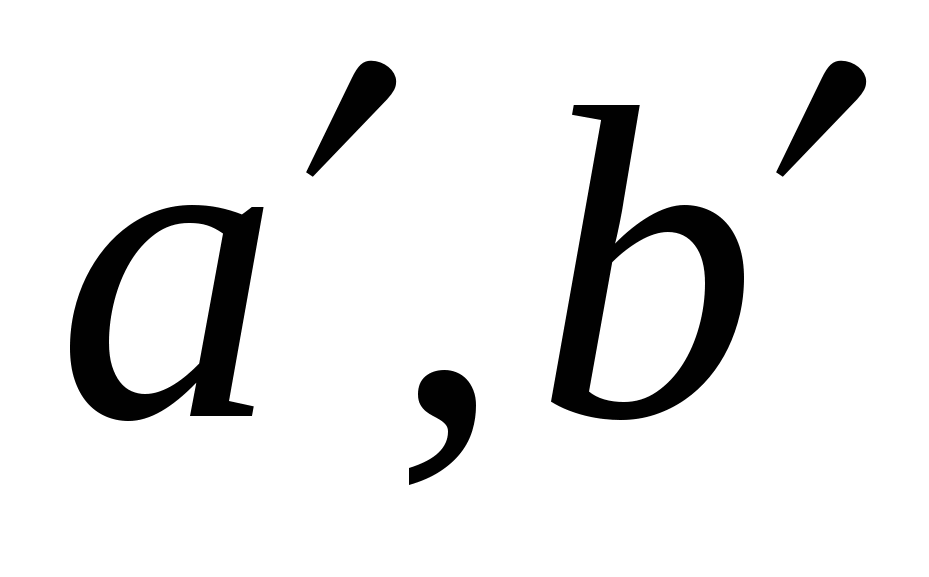 – константы; P, V, T, – давление, объем, температура, количество вещества газа; R – универсальная газовая постоянная). – константы; P, V, T, – давление, объем, температура, количество вещества газа; R – универсальная газовая постоянная).
|
1. описывает поведение идеальных газов.
2.описывает поведение реальных газов!
3. является уравнением переноса энергии.
4. описывает поведение вязких жидкостей.
|
|
Сжижение газа …
|
1. не возможно.
2. возможно при температуре ниже критической.!
3. возможно при температуре выше критической.
4. возможно при любой температуре.
|
3.3. Д. Реальные газы, жидкости, твёрдые тела(дополнительные вопросы)
|
|
Поведение реальных газов описывает уравнение….
(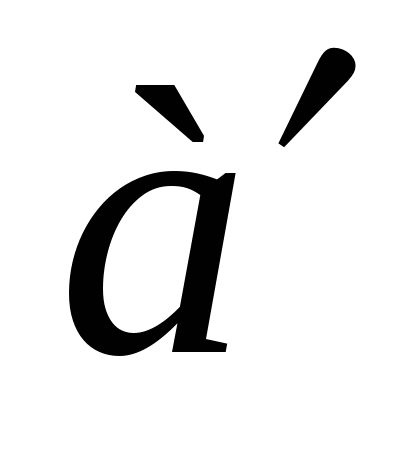 , ,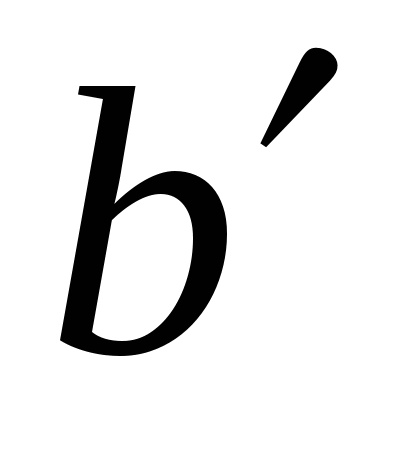 – соответствующие поправки, включённые в уравнение идеального газа; P, V, T, n – давление, объем, температура, количество вещества газа; R – универсальная газовая постоянная). – соответствующие поправки, включённые в уравнение идеального газа; P, V, T, n – давление, объем, температура, количество вещества газа; R – универсальная газовая постоянная).
|
1. 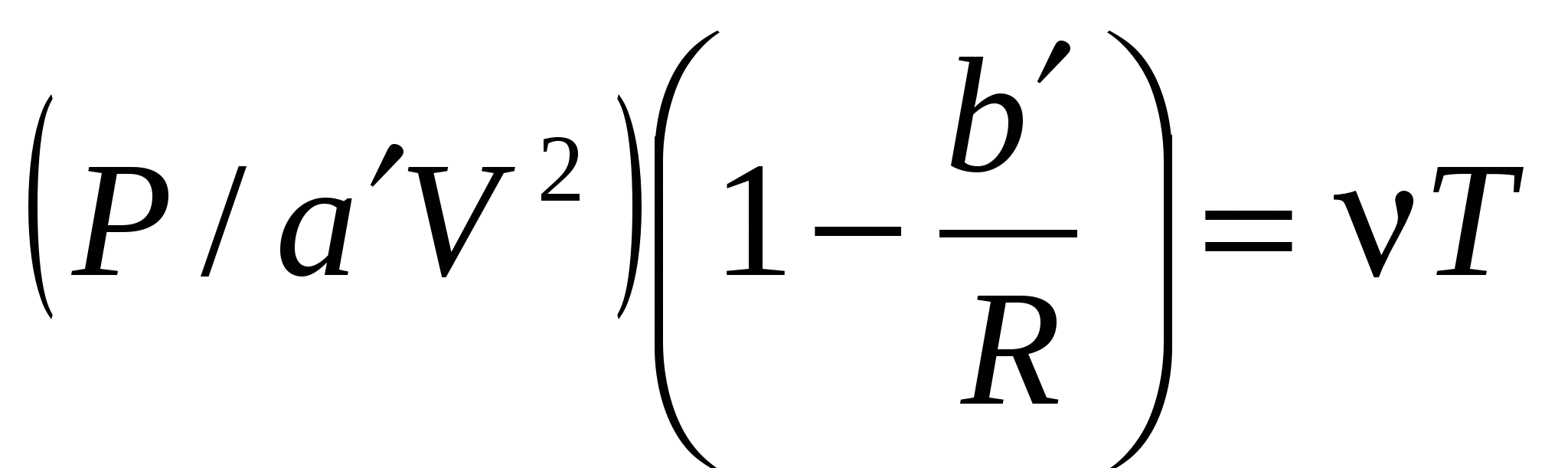 . .
2. 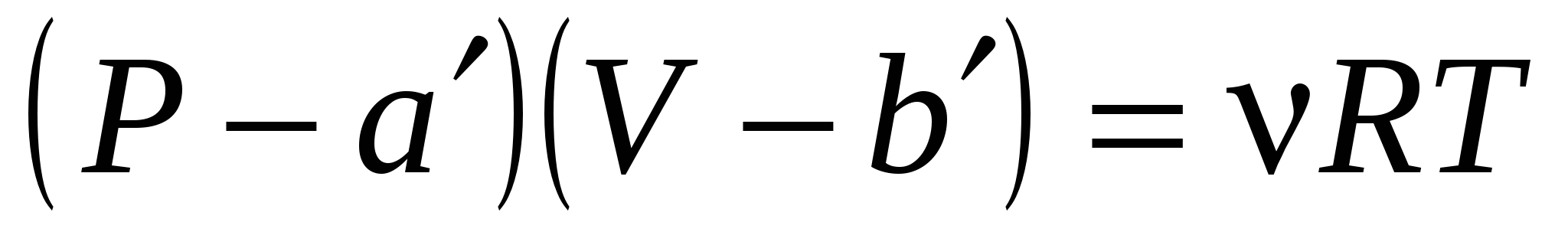 .! .!
3. 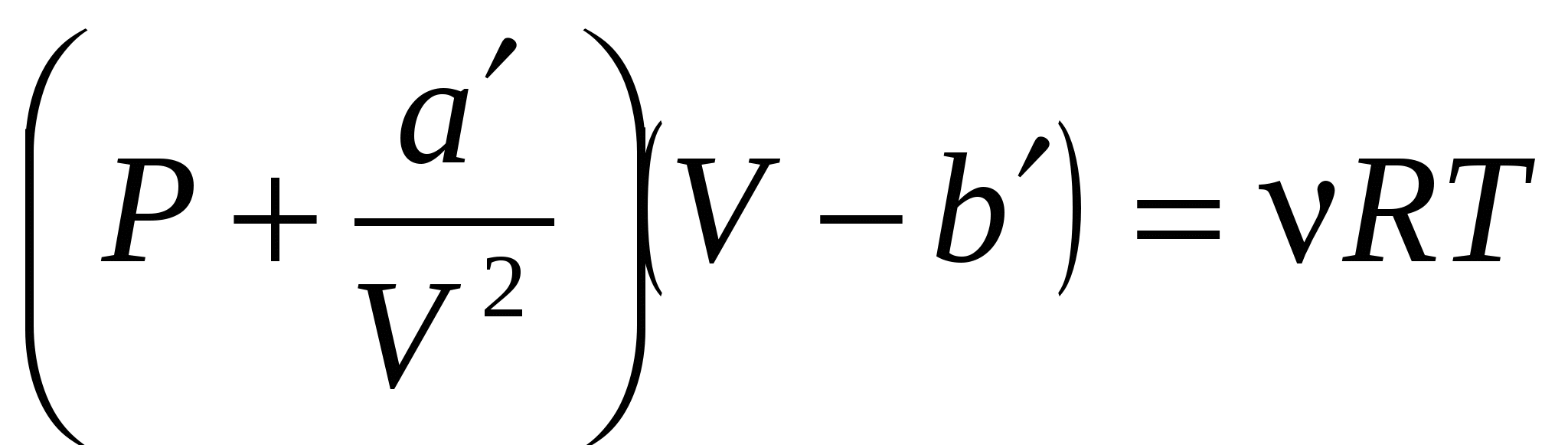 . .
4. 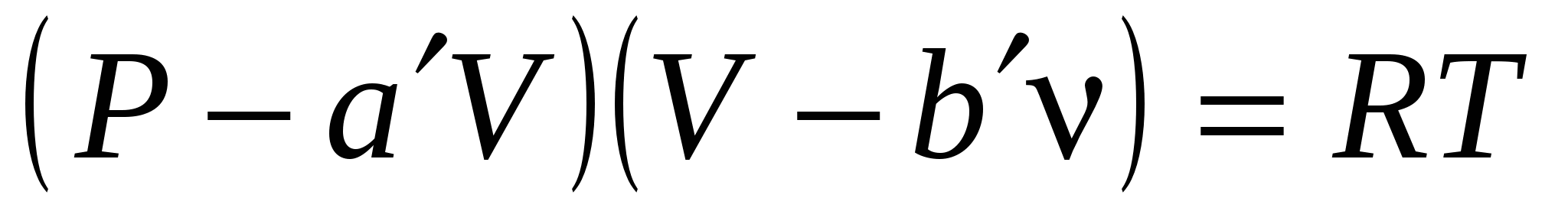 . .
|
|
Идеальный газ при адиабатическом расширении в вакуум…
|
1. охлаждается.!
2. нагревается.
3. не изменяет своей температуры.
4. испаряется.
|
|
Выберете правильное выражение для изменения температуры реальных газов в положительном эффекте Джоуля – Томсона и температуры инверсии соответственно.
|
1. ΔT < 0, Tин>0.!
2. ΔT < 0, ΔTин = 0.
3. ΔT >0, ΔTин < 0.
4. ΔT = 0, ΔTин = 0.
|
|
Выберете правильное выражение для изменения температуры реальных газов в отрицательном эффекте Джоуля – Томсона и температуры инверсии соответственно.
|
1. ΔT < 0, T >0. !
2. ΔT >0, ΔT < 0.
3. ΔT >0, ΔT = 0.
4. ΔT = 0, ΔT = 0.
|
|
При температуре инверсии коэффициент Джоуля – Томсона  … …
|
1. равен нулю.
2. меньше нуля.
3. больше нуля.!
4. равен единице.
|
|
На диаграмме состояния вещества, кривые испарения и сублимаций заканчиваются в …
|
1. тройной точке.
2. тройной и критической точке соответственно.!
3. критической и тройной точке соответственно.
4.. критической точке.
|
|
При адиабатическом расширении в вакуум, реальный газ…
|
1. охлаждается.!
2. нагревается.
3. не изменяет своей температуры.
4. испаряется.
|
|
При адиабатическом сжатии в вакуум, реальный газ…
|
1. охлаждается.
2. нагревается.!
3. не изменяет своей температуры.
4. испаряется.
|
|
Молярная теплоёмкость химически простых тел в кристаллическом состоянии…
|
1. зависит от температуры и равна 3R/T.
2. не зависит от температуры и равна R/3T.
3. зависит от температуры и равна 3RT.!
4. не зависит от температуры и равна 3R.
|
 Скачать 1.71 Mb.
Скачать 1.71 Mb.