Биохимия. ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Экзаменационные вопросы по биологической химии для студентов лечебного, педиатрического и медикопрофилактического факультетов
 Скачать 6.22 Mb. Скачать 6.22 Mb.
|
|
Альбумин. Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка - примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Cu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза. Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови. Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки. Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок. Альбумин - важнейший транспортный белок. Он транспортирует свободные жирные кислоты , неконъюгированный билирубин Са2+, Сu2+, триптофан, тироксин и трийодтиронин. Многие лекарства (аспирин, дикумарол, сульфаниламиды) связываются в крови с альбумином. Этот факт необходимо учитывать при лечении заболеваний, сопровождающихся гипоальбуминемией, так как в этих случаях повышается концентрация свободного лекарства в крови. Кроме того, следует помнить, что некоторые лекарства могут конкурировать за центры связывания в молекуле альбумина с билирубином и между собой. Транстиретин (преальбумин) называют тироксинсвязывающим преальбумином. Это белок острой фазы. Транстиретин относят к фракции альбуминов, он имеет тетрамерную молекулу. Он способен присоединять в одном центре связывания ретинолсвязывающий белок, а в другом - до двух молекул тироксина и трийодтиронина. Соединение с этими лигандами происходит независимо друг от друга. В транспорте последних транстиретин играет существенно меНbшую роль по сравнению с тироксинсвязывающим глобулином. α1 - Антитрипсин относят к α1-глобулинам. Он ингибирует ряд протеаз, в том числе фермент эластазу, освобождающийся из нейтрофилов и разрушающий эластин альвеол лёгких. При недостаточности α1-антитрипсина могут возникнуть эмфизема лёгких и гепатит, приводящий к циррозу печени. Существует несколько полиморфных форм α1-антитрипсина, одна из которых является патологической. У людей, гомозиготных по двум дефектным аллелям гена антитрипсина, в печени синтезируется α1-антитрипсин, который образует агрегаты, разрушающие гепатоциты. Это приводит к нарушению секреции такого белка гепатоцитами и к снижению содержания α1-антитрипсина в крови. Гаптоглобин составляет примерно четверть всех α2-глобулинов. Гаптоглобин при внутрисосудистом гемолизе эритроцитов образует комплекс с гемоглобином, который разрушается в клетках РЭС. Если свободный гемоглобин, имеющий молекулярную массу 65 кД, может фильтроваться через почечные клубочки или агрегировать в них, то комплекс гемоглобин-гаптоглобин имеет слишком большую молекулярную массу (155 кД), чтобы пройти через гломерулы. Следовательно, образование такого комплекса предотвращает потери организмом железа, содержащегося в гемоглобине. Определение содержания гаптоглобина имеет диагностическое значение, например, снижение концентрации гаптоглобина в крови наблюдают при гемолитической анемии. Это объясняют тем, что при Т1/2 гаптоглобина, составляющем 5 дней, и Т1/2 комплекса гемоглобин - гаптоглобин (около 90 мин) увеличение поступления свободного гемоглобина в кровь при гемолизе эритроцитов вызовет резкое снижение содержания свободного гаптоглобина в крови. Гаптоглобин относят к белкам острой фазы, его содержание в крови повышается при острых воспалительных заболеваниях. Содержание и функции некоторых белков плазмы крови
Энзимодиагностика - методы диагностики болезней, патологических состояний и процессов, основанные на определении активности энзимов (ферментов) в биологических жидкостях. В особую группу выделяются иммуноферментные диагностические методы, состоящие в применении антител, химически связанных с каким-либо ферментом, для определения в жидкостях веществ, образующих с данными антителами комплексы антиген — антитело. Использование энзимных тестов является важным критерием в распознавании врожденных энзимопатий, характеризующихся специфическими нарушениями обмена веществ и жизнедеятельности в связи с отсутствием или недостатком того или иного фермента. Ферменты представляют собой специфические высокомолекулярные белковые молекулы, являющиеся биологическими катализаторами, т.е. ускоряющими химические реакции, протекающие в живых организмах. Проникновение ферментов из клеток во внеклеточную жидкость, а затем в кровь, в мочу или другие биологические жидкости служит чрезвычайно чувствительным показателем повреждения плазматических мембран или повышения их проницаемости (например, вследствие гипоксии, гипогликемии, воздействия некоторых фармакологических веществ, инфекционных агентов, токсинов). Это обстоятельство лежит в основе диагностики повреждения клеток органов и тканей по феномену сопровождающей его гиперферментемии, причем выявляемое повышение активности фермента или его изоформы может иметь разную степень специфичности для поврежденного органа. Распределение отдельных изоферментов в тканях более специфично для определенной ткани, чем суммарная ферментативная активность, поэтому исследование некоторых изоферментов приобрело важное значение для ранней диагностики поражения отдельных органов и тканей. Так, например широко используется определение активности в крови изоферментов креатинфосфокиназы для диагностики острого инфаркта миокарда,лактатдегидрогеназы — для диагностики поражений печени и сердца, кислой фосфатазы — ираспознавании рака предстательной железы Диагностическая ценность энзимных тестов достаточно высока; она зависит как от специфичности данного вида гиперферментемии для определенных болезней, так и от степени чувствительности теста, т.е. кратности возрастания активности фермента при данном заболевании относительно нормальных значений. Однако большое значение имеет время постановки теста, т.к. появление и продолжительность гиперферментемии после повреждения органа различны и определяются соотношением скорости поступления фермента в кровоток и скорости его инактивации. При отдельных заболеваниях надежность их диагностики может быть повышена исследованием не одного, а нескольких изоферментов. Так, например, достоверность диагноза острого инфаркта миокарда возрастает, если в определенные сроки отмечено повышение активности креатинфосфокиназы, лактатдегидрогеназы и аспарагиновой аминотрансферазы. Степень выявляемой гиперферментемии объективно отражает тяжесть и распространенность повреждения органа, что позволяет прогнозировать течение заболевания. 145. Свертывающая система крови. Этапы образования фибринового сгустка. Внутренний и внешний пути свертывания и их компоненты. При повреждении кровеносного сосуда инициируется каскад реакций, в результате которого образуется сгусток крови - тромб, предотвращающий кровотечение. Основную роль в свёртывании (коагуляции) крови играют тромбоциты и ряд белков плазмы крови. В остановке кровотечения различают 3 этапа. На первом этапе происходит сокращение кровеносного сосуда. Затем к месту повреждения прикрепляются тромбоциты, которые, наслаиваясь друг на друга, образуют тромбоцитарную пробку (белый тромб). Белый тромб является непрочным и может закупорить только небольшой кровеносный сосуд. На третьем этапе растворимый белок плазмы крови фибриноген превращается в нерастворимый белок фибрин, который откладывается между тромбоцитами, и формируется прочный фибриновый тромб. Такой тромб содержит эритроциты и поэтому называется красным тромбом. Образованию фибринового тромба предшествует каскад протеолитических реакций, приводящий к активации фермента тромбина, который и превращает фибриноген в фибрин. Все белки, участвующие в свёртывании крови, называют факторами свёртывания. Они синтезируются в основном в печени и клетках крови в виде неактивных предшественников, обозначаются римскими цифрами, но имеют и тривиальные названия Большинство этих белков активируется в каскаде ферментативных реакций свёртывания крови. Активные формы этих белков обозначают такими же римскими цифрами, но с добавлением буквы "а". Основные функции и содержание в плазме крови факторов свёртывания крови
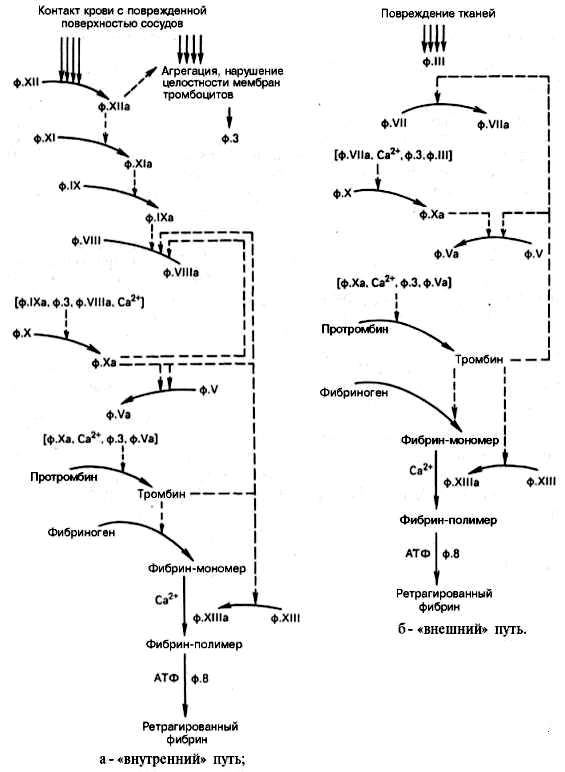 146. Принципы образования и последовательность фукционирования ферментных комплексов прокоагулянтного пути. Роль витамина К в свертывании крови. Для остановки кровотечения из капилляров и сосудов необходимо быстрое образование прочного тромба, препятствующего потере крови. Это достигается каскадом ферментативных реакций с механизмами усиления на многих этапах. Прокоагулянтный путь занимает центральное место в свёртывании крови. В циркулирующей крови содержатся проферменты протеолитических ферментов: фактор II (протромбин), фактор VII (проконвертин), фактор IX (Кристмаса), фактор X (Стюарта). Находящиеся в крови факторы Va (акцелерин) и VIIIa (антигемофильный фактор), а также мембранный белок - тканевый фактор (ТФ, фактор III) являются белками-активаторами этих ферментов. При повреждении сосуда "включается" каскадный механизм активации ферментов с последовательным образованием трёх связанных с фосфолипидами клеточной мембраны ферментных комплексов. Каждый комплекс состоит из протеолитического фермента, белка-активатора и ионов Са2+: VIIa-TO-Ca2+, IXa-VIIIa-Са2+ (теназа), Xa-Va-Са2+ (протромбиназа). Комплекс Xa-Va-Са2+ (протромбиназный комплекс) активирует протромбин (фактор II). Каскад ферментативных реакций завершается образованием мономеров фибрина и последующим формированием тромба. В активации ферментов каскада выделяют три основных механизма: частичный протеолиз, взаимодействие с белками-активаторами и взаимодействие с модифицированными клеточными мембранами. |
