Биохимия. ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Экзаменационные вопросы по биологической химии для студентов лечебного, педиатрического и медикопрофилактического факультетов
 Скачать 6.22 Mb. Скачать 6.22 Mb.
|
|
Активация частичным протеолизом.Все ферменты прокоагулянтного пути являются сериновыми протеазами, синтезируются в печени в виде неактивных проферментов и в такой форме циркулируют в крови. В процессе реализации тромбогенного сигнала проферменты (факторы VII, IX, X и II) частичным протеолизом превращаются в активные ферменты. Тромбин (фактор IIа)- гликопротеин с молекулярной массой 39 кД. Он образуется в крови из неактивного предшественника протромбина. Протромбин синтезируется в печени, имеет молекулярную массу 70 кД и содержит остатки. -карбоксиглутаминовой кислоты. Концентрация этого белка в крови в норме составляет 0,1 г/л. Он фиксируется на мембранном ферментном комплексе Xa-Va-Са2+, взаимодействуя, с одной стороны, остатками у-карбоксиглутамата с Са2+, а с другой - непосредственно с белком-активатором Va. Таким образом, создаются наилучшие стерические условия для протекания ферментативной реакции. Фактор Ха гидролизует две пептидные связи в молекуле протромбина. В результате этого образуется молекула тромбина, состоящая из двух цепей - лёгкой и тяжёлой, связанных между собой одной дисульфидной связью Молекула тромбина не содержит остатков γ-карбоксиглутамата и освобождается из протромбиназного комплекса. Тромбин частичным протеолизом превращает фибриноген в фибрин и активирует факторы VII, VIII, V, XIII. Тромбин выполняет ряд важных физиологических функций: является ферментом прокоагулянтного и контактного путей свёртывания крови, инициирует реакции антикоагулянтной фазы, вызывает агрегацию тромбоцитов и оказывает митогенное действие, участвуя в пролиферации и репарации клеток. Частичным протеолизом активируются также факторы V и VIII, превращаясь, соответственно, в факторы Va и VIIIa. В результате активации этих факторов изменяется их конформация и повышается сродство к фосфолипидам мембран и ферментам, которые они активируют. Взаимодействие белков-активаторов с протеолитическими ферментами.Тканевый фактор, фактор Va и фактор VIIIa имеют центры связывания с фосфолипидами мембран и ферментами VIIa, IXa и Ха, соответственно. При связывании с белками-активаторами в результате конформационных изменений активность этих ферментов повышается. Тканевый фактор (фактор III)представляет собой комплекс, состоящий из белка и фосфатидилсерина. Белковая часть тканевого фактора (апопротеин III) экспонирована на поверхности многих клеток (мозга, лёгких, печени, селезёнки и др.) и связана с фосфатидилсерином плазматических мембран. Однако появление апопротеина III на поверхности клеток, соприкасающихся с кровью (эвдотелиальных и моноцитов), происходит только при определённых условиях: при повреждении сосуда и/или нарушении нормальной асимметрии их плазматических мембран. Тканевый фактор в протеолитической активации не нуждается. Фактор V и фактор VIII -доменные белки, циркулирующие в крови. Фактор V синтезируется в печени, а фактор VIII - эндотелиальными клетками. Оба фактора активируются частичным протеолизом под действием тромбина. Фактор VIII в плазме крови находится в комплексе с белком - фактором тромбоцитов фон Виллебранда. Фактор фон Виллебранда в этом комплексе стабилизирует фактор VIII, препятствуя его разрушению прогеолитическим ферментом антикоагулянтной фазы фактором Са. Взаимодействие ферментных комплексов с клеточными мембранамипроисходит с участием ионов Са2+. Все проферменты прокоагулянтного пути (II, VII, IX, X) содержат остатки у-кар-боксиглутаминовой кислоты, образующиеся в результате посттрансляционой модификации этих белков в ЭР гепатоцитов. Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXa и Ха обеспечивают взаимодействие этих ферментов посредством Са2+ с отрицательно заряженными фосфолипидами клеточных мембран. В отсутствие ионов Са2+ кровь не свёртывается. Роль витамина К в карбоксилировании остатков глутаминовой кислоты в проферментах прокоагулянтного пути свёртывания крови.Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой служит восстановленная форма витамина К (нафтохинона) - дигидрохинон витамина К. Поступивший в организм витамин К (нафтохинон) восстанавливается в печени NADPH-зависимой витамин К редуктазой с образованием дигидрохинона витамина К. В ходе реакции кар-боксилирования остатков глутаминовой кислоты в проферментах прокоагулянтного пути дигидрохинон окисляется и эпоксидируется с образованием 2,3-эпоксида витамина К. Регенерация эпоксида в дигидрохинон витамина К происходит следующим образом: сначала 2,3-эпоксид витамина К восстанавливается в витамин К тиолзависимой эпоксидредуктазой, коферментом которой является белок, подобный тиоредоксину. Затем образующийся в этой реакции витамин К восстанавливается ферментом витамин К тиолзависимой редуктазой в дигидрохинон витамина К. Донором водорода в этой реакции, так же, как и в предыдущей, служит тиоредоксинподобный белок. Недостаточность витамина К приводит к нарушению карбоксилирования проферментов прокоагулянтного пути и сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями. Структурные аналоги витамина К дикумарол и варфарин ингибируют тиолзависимые ферменты витамин К 2,3-эпоксидредуктазу и витамин К редуктазу, вызывая торможение свёртывания крови Инициация каскада реакций прокоагулянтного пути.Ферментные мембранные комплексы прокоагулянтного пути образуются только при наличии на внешней поверхности плазматической мембраны клеток тканевого фактора и отрицательно заряженных фосфолипидов. Поперечная асимметрия плазматических мембран, в частности, определяется преобладанием в наружном слое нейтральных фосфолипидов (фосфатидил-холина и сфингомиелина), а во внутреннем - отрицательно заряженных (фосфатидилинозитол-бисфосфата и фосфатидилсерина). Специальная ферментная сисгема обеспечивает трансмембранный перенос и такое распределение фосфолипидов в клеточных мембранах, при котором в норме внешняя поверхность плазматических мембран клеток не заряжена. При нарушении поперечной асимметрии мембран тромбоцитов и эндотелиальных клеток на их поверхности формируются отрицательно заряженные (тромбогенные) участки и экспонируется апопротеин III тканевого фактора. Такие нарушения могут возникнуть при физической травме. В этом случае тканевый фактор и внутренняя поверхность клеточной мембраны становятся доступными для плазменных факторов прокоагулянтного пути. Кроме того, взаимодействие сигнальных молекул, вызывающих тромбогенез, с рецепторами эндотелиальных клеток и тромбоцитов активирует Са2+-зависимые регуляторные системы. В конечном итоге это приводит к повышению содержания в цитоплазме Са2+, который ингибирует АТФ-зависимую аминофосфолипидтранслоказу. Этот фермент играет важную роль в сохранении поперечной асимметрии мембран, так как переносит фосфа-тидилсерин из внешнего липидного слоя во внутренний. Снижение активности аминофосфолипидтранслоказы приводит к увеличению содержания во внешнем слое клеточной мембраны фосфатидилсерина и образованию отрицательно заряженных участков, необходимых для формирования мембранных ферментных комплексов. Кроме того, в результате такого нарушения структуры плазматической мембраны на её внешней поверхности экспонируется тканевый фактор и формируется первый ферментный комплекс прокоагулянтного пути свёртывания крови VII-ТФ-Са2+. Активация ферментов каждого комплекса - результат взаимодействия всех его компонентов. Если факторы IX, X и II требуют активации, то фактор VII обладает невысокой протеолитической активностью. Фактор VII мембранного комплекса VII-ТФ-Са2+ частичным протеолизом активирует факторы IX и X. Активные факторы IХа и Ха включаются в образование мембранных комплексов IXa-VIIIa-Са2+ и Ха-Va-Са2+. При этом фактор Ха протеолитически активирует фактор V, а протромбиназный комплекс не только превращает протромбин в тромбин, но и активирует фактор VII, протеолитическая активность которого в комплексе VIIa-Тф-Са2+ в 10 000 раз выше, чем в комплексе VII-Тф-Са2+. Образовавшийся в результате каскада реакций тромбин катализирует реакции частичного протеолиза фибриногена, фактора XIII и по принципу положительной обратной связи протеолитически активирует факторы V, VII и VIII. В процессе свёртывания действуют 2 механизма усиления сигнала: каскад реакций, в котором каждое ферментативное звено обеспечивает усиление сигнала, и положительные обратные связи. 147. Основные механизмы фибринолиза. Активаторы плазминогена как тромболитические средства. Основаные антикоагулянты крови: антитромбин III, макроглобулин, антиконвертин. Гемофилии. Тромб растворяется в течение нескольких дней после образования. Фибринолиз - ферментативное расщепление волокон фибрина с образованием растворимых пептидов, которые удаляются из сосудистого русла. Разрушение фибрина в составе тромба происходит под действием сериновой протеазы плазмина. 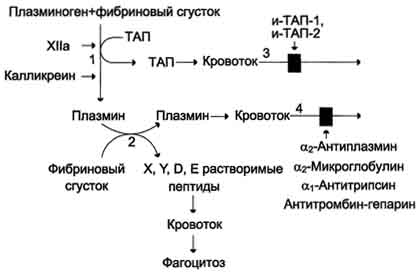 Плазминобразуется из плазминогена под действием активаторов. Неактивный профермент плазмина плазминоген синтезируется в печени, почках и костном мозге. Тканевый активатор плазминогена (ТАЛ) -протеолитический фермент, содержащийся в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе. ТАЛ частичным протеолизом превращает неактивный плазминоген в активный плазмин. Активаторами плазминогена также служат фактор ХIIа и калликреин. Растворение фибринового сгустка происходит при взаимодействии фибрина, плазминогена и ТАП Формирование сети фибриновых волокон при образовании тромба сопровождается сорбцией на ней плазминогена и его активаторов. В молекуле плазмина и плазминогена есть участки, комплементарные доменам фибрина, причём одна молекула плазмина может связывать несколько молекул фибрина. Молекулы ТАП тоже имеют центры связывания с фибрином. Образующийся из плазминогена под действием ТАП плазмин гидролизует фибрин с образованием пептидов X и Y, активирующих фибринолиз, и пептидов D и E, его тормозящих. Растворимые пептиды X, Y, D, E поступают в кровоток и там фагоцитируются. Разрушение тромба приводит к освобождению из него плазмина и ТАП. В кровяном русле последние быстро инактивируются специфическими ингибиторами и улавливаются печенью. ТАП ингибируется ингибиторами тканевого активатора плазмина первого (и-ТАП-1) и второго (и-ТАП-2) типов, а плазмин - α2-антиплазмином или другими ингибиторами сериновых протеаз. В почках синтезируется протеолитический активатор плазминогена урокиназа, которая, превращая плазминоген в плазмин, способствует освобождению почечных клубочков от фибриновых волокон. Из β-гемолитического стрептококка выделили белок стрептокиназу, образующий комплекс с плазминогеном, в котором плазминоген аутокаталитически превращается в плазмин. Урокиназу, стрептокиназу и ТАП используют при тромболитической терапии инфаркта миокарда, тромбозах вен и артерий, гемодиализе. Такие ингибиторы ферментов свёртывания крови, как α2-макроглобулин, α1-антитрипсин и комплекс антитромбин III-гепарин также обладают небольшой фибринолитической активностью. Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазминогена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина). Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Однако следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии. Например, частота разных форм гемофилии колеблется в разных странах от 6 до 18 на 100 000 мужчин, в то время как тромбофилии, вызванные дефицитом антитромбина III, встречаются у 1-2 больных на 5000, а при недостатке протеина С - у одного на 15 000 человек. Ингибиторы ферментов свёртывания крови.Физиологические ингибиторы ферментов свёртывания крови ограничивают распространение тромба местом повреждения сосуда. Белок плазмы крови антитромбин III- наиболее сильный ингибитор свёртывания крови; на его долю приходится около 80-90% антикоагулянтной активности крови. Он инактивирует ряд сериновых протеаз крови: тромбин, факторы IХа, Ха, ХIIа, калликреин, плазмин и урокиназу. Антитромбин III не ингибирует фактор VIIIa и не влияет на факторы в составе мембранных комплексов, а устраняет ферменты, находящиеся в плазме крови, препятствуя распространению тромбо-образования в кровотоке. Взаимодействие антитромбина с ферментами свёртывания крови ускоряется в присутствии гепарина. Гепарин - гетерополисахарид, который синтезируется в тучных клетках. В результате взаимодействия с гепарином антитромбин III приобретает конформацию, при которой повышается его сродство к сериновым протеазам крови. После образования комплекса антитромбин III-гепарин-фермент гепарин освобождается из него и может присоединяться к другим молекулам антитромбина. При наследственном дефиците антитромбина III в молодом возрасте наблюдают тромбозы и эмболии сосудов, опасные для жизни. α2-Макроглобулинобразует комплекс с сериновыми протеазами крови. В таком комплексе их активный центр полностью не блокируется, они могут взаимодействовать с субстратами небольшого размера. Однако высокомолекулярные субстраты, например фибриноген, становятся недоступными для действия протеаз в комплексе α2-макроглобулинтромбин. Антиконвертин (тканевый ингибитор внешнего пути свёртывания)синтезируется в эндотелии сосудов. Он специфически соединяется с ферментным комплексом Тф-VIIа-Са2+, после чего улавливается печенью и разрушается в ней. α1-Антитрипсинингибирует тромбин, фактор ХIа, калликреин, однако он не рассматривается как важный ингибитор факторов свёртывания крови, α1-Антитрипсин в основном на тканевом уровне ингибирует панкреатические и лейкоцитарные протеазы, коллагеназу, ренин, урокиназу. Пептиды, образующиеся в результате протеолитической активации проферментов и профакторов, тоже обладают выраженными антикоагулянтными свойствами, но механизм их действия в настоящее время не выяснен. Гемофилия — наследственное заболевание, связанное с нарушением коагуляции (процессом свёртывания крови); при этом заболевании возникают кровоизлияния в суставы, мышцы и внутренние органы, как спонтанные, так и в результате травмы или хирургического вмешательства. При гемофилии резко возрастает опасность гибели пациента от кровоизлияния в мозг и другие жизненно важные органы, даже при незначительной травме. Больные с тяжёлой формой гемофилии подвергаются инвалидизации вследствие частых кровоизлияний в суставы (гемартрозы) и мышечные ткани (гематомы). Гемофилия относится к геморрагическим диатезам, обусловленным нарушением плазменного звена гемостаза (коагулопатия). Гемофилия появляется из-за изменения одного гена в хромосоме X. Различают три типа гемофилии (A, B, C). Гемофилия А (рецессивная мутация в X-хромосоме) вызвана генетическим дефектом, отсутствием в крови необходимого белка — так называемого фактора VIII (антигемофильного глобулина). Такая гемофилия считается классической, она встречается наиболее часто, у 80-85 % больных гемофилией. Тяжёлые кровотечения при травмах и операциях наблюдаются при уровне VIII фактора — 5-20 %. Гемофилия B вызвана дефектным фактором крови IX (рецессивная мутация в X-хромосоме). Нарушено образование вторичной коагуляционной пробки. Гемофилия С вызвана дефектным фактором крови XI (аутосомная рецессивная мутация), известна в основном у евреев-ашкеназов. В настоящее время гемофилия С исключена из классификации, т.к. ее клинические проявления значительно отличаются от А и В. Обычно болезнью страдают мужчины (наследование, сцепленное с полом), женщины же выступают как носительницы гемофилии, которые сами ей обычно не болеют, но могут родить больных сыновей или дочерей-носительниц. 148. Клиническое значение биохимического анализа крови. Среди медицинских анализов особенное значение имеет анализ крови — связующего звена между всеми системами и органами тела. Распространенным лабораторным методом изучения ее состава является биохимический анализ крови. Большое число параметров позволяет составить их оптимальный набор для конкретного пациента. Он может зависеть от жалоб больного, его общего состояния, выбора той системы органов, работу которой прежде всего следует проверить по мнению врача. В связи со своей универсальностью биохимический анализ крови назначается врачами разных медицинских специальностей — терапевтами, кардиологами, гастроэнтерологами, ревматологами и другими. Он позволяет оценить функциональное состояние практически всех систем органов. Биохимический анализ крови включает следующие основные группы показателей: обмен белков (общий белок, альбумин, креатинин, мочевина, мочевая кислота) обмен липидов и липопротеинов (триглицериды, холестерин, аполипопротеин) обмен углеводов (глюкоза, фруктозамин) обмен пигментов (билирубин, желчные кислоты) специфические белки ( С-реактивный белок, трансферрин, миоглобин, ферритин, тропонин) ферменты (фосфотаза, амилаза, липаза) электролиты (К, Na, Mg, Fe, Cl, P, Cu, Zn) витамины 149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость. Все клетки имеют мембраны. Кроме того, почти во всех эукариотических клетках существуют органеллы, каждая из которых имеет свою мембрану. Мембраны ответственны за выполнение многих важнейших функций клетки. Согласованное функционирование мембранных систем - рецепторов, ферментов, транспортных механизмов помогает поддерживать гомеостаз клетки и в то же время быстро реагировать на изменения внешней среды. К основным функциям мембран можно отнести: отделение клетки от окружающей среды и формирование внутриклеточных компартментов(отсеков); контроль и регулирование транспорта огромного разнообразия веществ через мембраны; участие в обеспечении межклеточных взаимодействий, передаче внутрь клетки сигналов; преобразование энергии пищевых органических веществ в энергию химических связей молекул АТФ. Основные принципы структурной организации всех мембран одинаковы, однако одна из самых характерных особенностей - огромное их разнообразие. Мембраны органелл эукариотических клеток уникальны по своему составу и по характеру выполняемых функций. Плазматическая мембрана. Плазматическая мембрана, окружающая каждую клетку, определяет её величину, обеспечивает транспорт малых и больших молекул из клетки и в клетку, поддерживает разницу концентраций ионов по обе стороны мембраны. Мембрана участвует в межклеточных контактах, воспринимает, усиливает и передаёт внутрь клетки сигналы внешней среды. С мембраной связаны многие ферменты, катализирующие биохимические реакции. |
