В реакциях данного типа перемещение электронов осуществляется между различными молекулами, атомами или ионами, т.е. окислитель и восстановитель являются различными веществами, например
MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
Здесь MnO2 – окислитель, HBr — восстановитель
Реакции внутримолекулярного окисления-восстановления.
В реакциях такого типа перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы), например
2AgNO3 = 2Ag + 2NO2 + O2
Здесь Ag+1 – окислитель, O-2 – восстановитель.
Реакции диспропорционирования (реакции самоокисления-самовосстановления).
В реакциях этого типа окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления, например
3HNO2 = HNO3 + 2NO + H2O
Здесь N+3 (в молекуле HNO2) является и окислителем и восстановителем.
БИЛЕТ 26
Методы электронного баланса и электронно-ионных полуреакций. Правила стяжения.
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители.
1) Составить схему реакции:
2) Определить окислитель и восстановитель
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H+ — кислая среда, OH— — щелочная среда и H2O – нейтральная среда.
Составить схему реакции:
Записать уравнение в ионном виде
Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
Найти коэффициенты для окислителя и восстановителя
Просуммировать обе полуреакции
Записать молекулярное уравнение
Правила стяжения:
1. В кислой или нейтральной среде ионы металлов с зарядом I+, 2+, 3+, 4+ с кислотными остатками образуют соли.
2. Образующиеся в реакциях окисления-восстановления атомы с положительной степенью окисления +4, +5, +6, +7 стягиваются с кислородом и образуют отрицательные ионы кислотных остатков типа , .Исключения: , которые в нейтральной или кислой среде образуют диоксиды.
3. Ионы амфотерных металлов с зарядом 2+, 3+, 4+ в щелочной среде образуют гидроксокомплексы типа
4. Избыточный кислород в кислой среде образует с ионами водорода воду: .
5. Избыточный кислород в нейтральной и щелочной среде стягивается с молекулами воды с образованием гидроксид-ионов: .
6. Ионы водорода в щелочной среде стягиваются с гидроксид-ионами с образованием молекул воды: .
7. Ионы водорода с ионами фтора, серы, селена и других элементов, находящихся в низших степенях окисления, образуют и д.т.
БИЛЕТ 27
Возникновение скачков потенциалов на границе фаз. Двойной электрический слой.
Механизм возникновения скачка потенциала на границе металл-электролит за счет окисления и восстановления самого металла, находящегося в растворе своей соли, может быть представлен следующим образом. Находящиеся на поверхности металла катионы имеют в среднем запас потенциальной энергии. Перемещение катиона влево, т.е. вдавливание его в металл или сближение с соседними катионами кристаллической решетки металла, что выражается на восходящей энергетической кривой. Перемещение катиона вправо, т.е. отрыв его от поверхности металла с переходом в вакуум, требует настолько большой работы, соответствующей энергии испарения Qисп., что при обычной температуре этот процесс практически не имеет места.
Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд.
БИЛЕТ 28
Гальванические элементы. Проводники первого и второго рода. Устройство медно-цинкового гальванического элемента. Схема медно-цинкового гальванического элемента. Концентрационный гальванический элемент.
Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую, используя электрохимию, а в быту называется батареей.
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии. Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Проводники первого рода – это проводники, в которых носителями зарядов являются электроны. Например, металлы в твердом и в жидком состояниях.
В проводниках второго рода носителями зарядов являются положительные или отрицательные ионы. Это электролиты – расплавы оксидов, гидроксидов металлов, солей или водные растворы солей.
 Медно-цинковый гальванический элемент состоит из медной и цинковой пластин, опущенных соответственно в растворы сульфатов меди и цинка, которые отделены друг от друга пористой перегородкой, пропускающей только анионы SO4. Медно-цинковый гальванический элемент состоит из медной и цинковой пластин, опущенных соответственно в растворы сульфатов меди и цинка, которые отделены друг от друга пористой перегородкой, пропускающей только анионы SO4.
Концентрационным гальваническим элементом называется гальванический элемент, составленный из одинаковых электродов, погруженных в раствор одного и того же электролита, концентрации которого различны.
БИЛЕТ 29
Расчёт электродных потенциалов по уравнению Нернста. Электродвижущая сила.
Понятие электродного потенциала электрода. Водородный электрод. Потенциал водородного электрода, его зависимость от pH раствора.
Значения электродных потенциалов рассчитывают по уравнению Нернста:
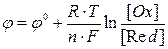 , (1) , (1)
где  ‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное ‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное
96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Электродвижущая сила (ЭДС) — скалярная физическая величина, характеризующая работу сторонних сил (то есть любых сил, кроме электростатических и диссипативных) действующих в квазистационарных цепях постоянного или переменного тока.
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю.
БИЛЕТ 30
Определение стандартных электродных потенциалов. Ряд напряжений металлов. Его теоретическое и практическое значение. Связь ЭДС гальванического элемента с энергией Гиббса и константой равновесия.
БИЛЕТ 31
Поляризация гальванического элемента. Электрохимическое перенапряжение.
Виды поляризации гальванического элемента (анодная, катодная, концентрационная, химическая, электрохимическая). Деполяризация ГЭ.
БИЛЕТ 32
Электролиз. Катодные и анодные процессы. Последовательность разрядки ионов на электродах. Электролиз с нерастворимыми и растворимыми анодами. Электролиз расплавов.
БИЛЕТ 33
Законы электролиза М. Фарадея. Выход по току. Практическое значение электролиза.
БИЛЕТ 34
Поляризация при электролизе (химическая, концентрационная). Потенциал разложения и перенапряжение.
БИЛЕТ 35
Периодичность свойств химических элементов. Энергия ионизации, сродство к электрону и их изменение в периодах и группах.
БИЛЕТ 36
Отклонения коллигативных свойств растворов электролитов от общих законов разбавленных растворов. Изотонический коэффициент. |
 Скачать 120.51 Kb.
Скачать 120.51 Kb.
