билеты по химии. свои билеты химия. Экзаменационные вопросы по химии
 Скачать 120.51 Kb. Скачать 120.51 Kb.
|
1 2 ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО ХИМИИ 1. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Корпускулярно - волновые свойства микрочастиц. Уравнение де-Бройля. Понятие о принципе неопределённости Гейзенберга. Волновая функция. Квантово-механическая модель электрона в атоме. Электронное облако. Атомная орбиталь. 2. Энергетическое состояние электрона в атоме. Квантовые числа. Главное квантовое число и энергетические уровни. Орбитальное квантовое число. Форма орбиталей S-, P-, d-, f- подуровней. Магнитное квантовое число. Спиновое квантовое число. Структура многоэлектронных атомов. Принцип Паули. Принцип наименьшей энергии. Последовательность энергетических подуровней в многоэлектронных атомах. Правило Гунда. Порядок распределения электронов по орбиталям. Изображение электронных структур атомов с помощью электронных формул и схем распределения электронов по ячейкам. 3. Периодическая система элементов как выражение периодического закона Д.И. Менделеева. Связь периодической системы со строением атомов. Периоды, группы, подгруппы, электронные семейства элементов: S-, P-, d-, f- элементы и их размещение в периодической системе. Валентные электроны. Составление электронных формул. 4. Периодичность свойств химических элементов. Атомные радиусы. Энергия ионизации, сродство к электрону и их изменение в периодах и группах. 5. Оксиды: основные, кислотные и амфотерные. Номенклатура оксидов. Зависимость кислотно-основного характера оксидов от положения в периодической системе и степени окисления элемента. Химическое взаимодействие между оксидами с образованием солей. 6. Гидроксиды основные и амфотерные. Их номенклатура и получение. Кислотно-основное взаимодействие между оксидами, гидроксидами и кислотами. 7. Кислоты: классификация, химические свойства, названия кислот. 8. Соли: нормальные, кислые и основные. Номенклатура солей. Получение и свойства солей. 9. Энергетические эффекты химических процессов. Внутренняя энергия и энтальпия и их изменение в различных процессах. Термохимические уравнения. Закон Гесса и следствия, вытекающие из него. Стандартные энтальпии. Расчёты по термохимическим уравнениям. 10. Энтропия. Свободная энергия Гиббса. Условия самопроизвольного протекания химических процессов. 11. Скорость химической реакции. Средняя и истинная скорости реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ. 12. Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Теория активных столкновений Аррениуса. Энергия активации химической реакции. 13. Теория бинарных соударений. Теория абсолютных скоростей. Активированный комплекс. 14. Зависимость скорости химической реакции от катализатора. 15. Кинетическая классификация химических реакций. Молекулярность и порядок реакции. 16. Понятие химического равновесия. Константа химического равновесия. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье. 17. Типы растворов. Растворимость. Теплота растворения. Способы выражения концентрации растворов. 18. Идеальные растворы. Законы идеальных растворов. 19. Растворы электролитов. Сильные и слабые электролиты. Понятия активности, коэффициента активности, ионной силы раствора. Изотонический коэффициент. 20. Теория электролитической диссоциации Аррениуса. Степень и константа диссоциации. 21. Ионное произведение воды. Водородный показатель (рН). 22. Гидролиз солей. Различные случаи гидролиза. Степень и константа гидролиза. 23. Окислительно-восстановительные реакции. Общие понятия и определения. Важнейшие окислители и восстановители. 24. Классификация окислительно-восстановительных реакций. Составление уравнений окислительно-восстановительных реакций. Методы электронного баланса и электронно-ионных полуреакций. Правила стяжения. 25. Гальванические элементы. Возникновение скачков потенциалов на границе фаз. Двойной электрический слой. 26. Медно-цинковый гальванический элемент. Расчёт электродных потенциалов по уравнению Нернста. Электродвижущая сила. 27. Водородный электрод. Определение стандартных электродных потенциалов. Ряд напряжений металлов. Термодинамика гальванического элемента. 28. Поляризация гальванического элемента. Электрохимическое перенапряжение. 29. Электролиз. Катодные и анодные процессы. Последовательность разрядки ионов на электродах. Электролиз с нерастворимыми и растворимыми анодами. Электролиз расплавов. 30. Законы электролиза М. Фарадея. Выход по току. Поляризация при электролизе. Потенциал разложения и перенапряжение. Практическое значение электролиза. 31. Химическая коррозия металлов. Газовая коррозия. Электрохимическая коррозия металлов. Факторы, влияющие на скорость электрохимической коррозии. 32. Методы защиты металлов от коррозии. Защитные покрытия. Электрохимическая защита. БИЛЕТ 1 Уравнение Планка для энергии кванта. Корпускулярно - волновая двойственность микрочастиц. Уравнение де-Бройля для фотона и электрона. Принцип неопределённости Гейзенберга. Э 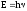 нергия кванта определяется уравнением Планка: нергия кванта определяется уравнением Планка: О 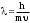 бобщение представлений о двойственной природе фотона на все объекты микромира и прежде всего на электрон. Математически это нашло выражение в соотношении Луи де-Бройля. Согласно которому частице с массой m, движущейся со скоростью, соответствует длина волны: бобщение представлений о двойственной природе фотона на все объекты микромира и прежде всего на электрон. Математически это нашло выражение в соотношении Луи де-Бройля. Согласно которому частице с массой m, движущейся со скоростью, соответствует длина волны: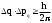 В. Гейзенберг в 1927г сформулировал соотношение неопределенности: г 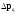 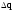 де - неопределённость координаты частицы, де - неопределённость координаты частицы,- неопределённость импульса по этой координате БИЛЕТ 2 Волновая функция. Квантово-механическая модель электрона в атоме. Электронное облако. Атомная орбиталь. 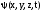 Функция , зависящая от координат x,y,z и времени t, называется волновой функцией или пси-функцией. Волновой функция названа потому, что в ней находит выражение волновая природа электрона. В качестве модели состояния электрона в атоме принято представление об электронном облаке. Плотность соответствующих участков этого облака пропорциональна вероятности нахождения там электрона. Пространство, в котором наиболее вероятно пребывание электрона, называется орбиталью. О 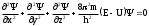 рбиталь - понятие математическое, смысл его вытекает из волнового уравнения Э. Шреденгера (1926 г), которое связывает волновую функцию с потенциальной энергией электрона U и его полной энергией E: рбиталь - понятие математическое, смысл его вытекает из волнового уравнения Э. Шреденгера (1926 г), которое связывает волновую функцию с потенциальной энергией электрона U и его полной энергией E: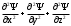 где - сумма вторых производных волновых функций по координатам x, y, z m – масса электрона, h – постоянная Планка БИЛЕТ 3 Квантовые числа. Главное квантовое число и энергетические уровни. Орбитальное квантовое число. Форма орбиталей S-, P-, d-, f- подуровней. Магнитное квантовое число. Спиновое квантовое число. Орбитальное квантовое число - l - определяет геометрическую форму атомной орбитали. Орбитальное квантовое число принимает любые целочисленные значения, начиная с l=0 (l=0,1,2,3,…n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень. Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). С увеличением порядкового номера энергия орбиталей увеличивается. Орбитали, для которых l = 0, имеют форму сферы и называются s-орбиталями. Они содержатся на всех энергетических уровнях, причем на К-уровне есть только s-орбиталь. Орбитали, для которых l = 1, имеют форму вытянутой восьмерки и называются р-орбиталями. Они содержатся на всех энергетических уровнях, кроме первого (К). Орбитали, для которых l = 2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня. Заполнение f-орбиталей, для которых l = 3, начинается с четвертого энергетического уровня. Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Es< Ep< Ed < Ef, поэтому на одном уровне выделяют разные энергетические подуровни. Магнитное квантовое число ml характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Спиновое квантовое число ms, спин (от англ. spin – кружение, вращение) – характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: БИЛЕТ 4 Принцип Паули. Принцип наименьшей энергии. Последовательность энергетических подуровней в многоэлектронных атомах. Правило Гунда. Порядок распределения электронов по орбиталям. Изображение электронных структур атомов с помощью электронных формул и схем распределения электронов по ячейкам. П р и н ц и п П а у л и. В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. П р и н ц и п н а и м е н ь ш е й э н е р г и и. Основное (устойчивое) состояние атома характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии. Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют: 1) принцип наименьшей энергии; 2) правило Клечковского; 3) принцип запрета Паули; 4) правило Гунда. Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией. При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Правило Гунда: устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально. Строение атома описывается с помощью схемы электронного строения атома, электронной формулы атома, электронно-графической формулы атома. Схемы электронного строения атомов показывают распределение электронов по энергетическим уровням. БИЛЕТ 5 Периодическая система элементов как выражение периодического закона Д.И. Менделеева. Связь периодической системы со строением атомов. Периоды, группы, подгруппы, электронные семейства элементов: S-, P-, d-, f- элементы и их размещение в периодической системе. Валентные электроны. Составление электронных формул. Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что «… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра. Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы. В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне). Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды). Высшая валентность элемента и высшая степень окисления (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится. Низшая степень окисления элемента равна БИЛЕТ 6 Определение оксидов. Номенклатура оксидов. Оксиды основные. Оксиды кислотные. Оксиды амфотерные. Зависимость кислотно-основного характера оксидов от положения в периодической системе и степени окисления элемента. Химическое взаимодействие между оксидами с образованием солей. Оксиды – бинарные соединения, в состав которых входит кислород в степени окисления -2. Названия оксидов строятся по следующим правилам систематической номенклатуры: Сначала указывают слово оксид, после него, в родительном падеже, – название второго элемента. Если элемент, образующий оксид, имеет единственную валентность, то её в названии оксида можно не указывать. Если же элемент имеет переменную валентность и образует несколько оксидов, то валентность элемента обязательно указывается римскими цифрами в скобках в конце записи названия оксида. При записи химической формулы оксида кислород записывается на последнем месте. Основные оксиды - оксиды, которым соответствуют основные гидроксиды (основания). Основные оксиды образованы типичными металлами (щелочными, щелочноземельными, магнием), а также переходными металлами в низких степенях окисления. Кислотные оксиды - оксиды, которым соответствуют кислотные гидроксиды (кислоты). Кислотные оксиды образованы неметаллами (за исключением несолеобразующих оксидов CO, SiO, NO, N2O), а также переходными металлами в высоких степенях окисления. Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства. Им соответствуют амфотерные гидроксиды. К амфотерным оксидам относятся оксид бериллия BeO, оксид алюминия Al2O3, оксид цинка ZnO, а также оксиды переходных металлов в промежуточных степенях окисления. Слева направо по периоду у элементов происходит ослабление металлических свойств, и усиление неметаллических. Основные свойства оксидов ослабевают, а кислотные свойства оксидов усиливаются. По главным подгруппам неметаллические свойства элементов ослабевают, а металлические усиливаются, поэтому сверху вниз по главной группе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства. Например, Pb+2O – основной оксид, Pb+4O2 – амфотерный. Cr+2O - основный оксид, Cr2+3O3 – амфотерный, Cr+6O3 – кислотный. БИЛЕТ 7 Определение гидроксидов. Их номенклатура и получение. Гидроксиды основные и амфотерные. Кислотно-основное взаимодействие между оксидами, гидроксидами и кислотами. Гидроксидами называются сложные вещества, содержащие группировку OH-, которая связана через атом кислорода одинарной химической связью с различными химическими элементами. Согласно международной номенклатуре названия гидроксидов составляются из слова «гидроксид» и названия металла в родительном падеже. Если металл образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках сразу после названия элемента. Например, NaOH – гидроксид натрия; Fe(OH)3 – гидроксид железа (III); Ca(OH)2 – гидроксид кальция; CuOH – гидроксид меди (I). Получение Взаимодействие активного металла с водой: 2Na + 2H2O → 2NaOH + H2 Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):Na2O + H2O → 2NaOH, Промышленным способом получения щелочей является электролиз растворов солей:2NaCI + 4H2O 2NaOH + 2H2 + CI2 Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4 Основные гидроксиды — это сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (—OH) и в водном растворе диссоциируют с образованием анионов ОН− и катионов. Амфотерные гидроксиды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или основных гидроксидов. Все амфотерные гидроксиды являются твёрдыми веществами. 1. Основные оксиды взаимодействуют с водой с образованием оснований. Условие протекания реакции: должны образовываться растворимые основания! Na2O + H2O → 2NaOH CaO + H2O → Ca(OH)2 Al2O3 + H2O → реакция не протекает, так как должен образовываться Al(OH)3, который нерастворим. 2. Взаимодействие с кислотами с образованием соли и воды: CaO + H2SO4 → CaSO4 + H2O. 3. Взаимодействие с кислотными оксидами с образованием соли: СaO + SiO2 → CaSiO3 4. Взаимодействие с амфотерными оксидами: СaO + Al2O3 → Сa(AlO2)2 БИЛЕТ 8 Определение кислот. Названия кислот. Основность кислоты. Взаимодействие сильных кислот с металлами. Диссоциация растворимых в воде кислот. Кислоты - это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков. Общая формула кислот: Hx(Ac)−n, где Ac - кислотный остаток (acid - англ. кислота), х - число атомов водорода, n - степень окисления кислотного остатка. В кислотах x=n. Названия бескислородных кислот образуются от названия элемента с суффиксом -о и прибавлением слов «водородная кислота»: HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная. Названия кислородосодержащих кислот строятся следующим образом: название элемента+суффикс (ная, овая, истая и пр.) кислота. Основностью кислот зазывают число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода Н, а также замещаться на атомы металла: одноосновные, двухосновные, трехосновные. С разбавленными кислотами, которые проявляют окислительные свойства за счет ионов водорода реагируют металлы: • расположенные в ряду напряжений до водорода (эти металлы способны вытеснять водород из кислоты); • образующие с этими кислотами растворимые соли Окислительные свойства кислотных остатков и значительно сильнее, чем нона водорода Н, поэтому азотная и концентрированная серная кислоты взаимодействуют практически со всеми металлами, расположенными в ряду напряжений как до водорода, так и после него, кроме золота и платины. При диссоциации кислот роль катионов играют ионы водорода (H+), других катионов при диссоциации кислот не образуется: HF ↔ H+ + F- HNO3 ↔ H+ + NO3- БИЛЕТ 9 Соли определение. Номенклатура. Соли: нормальные, кислые и основные. Получение и свойства солей. Солями называются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д. Номенклатура: Соли бывают – средние, кислые, основные, двойные, смешанные, комплексные. Нормальные, или средние соли представляют собой продукт полной нейтрализации кислоты основанием (полное замещение атомов водорода атомами металла (более строго - катионами оснований) или полное замещение гидроксид-ионов основания кислотными остатками. Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода. Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы. Получение 1. Взаимодействием металлов и металло-неметаллов с неметаллами: 2Na + Cl2 = 2NaCl, 2. Взаимодействием неметаллов с другими солями: 2KI + Br2 = 2KBr + I2Ї, 2KBrO3 + I2 = 2KIO3 + Br2. 3. Вытеснением более активным металлом более поссивного из его соли: CuSO4 + Fe = FeSO4 + Cu. 4. Взаимодействием основных, амфотерных и кислотных оксидов: Li2O + ZnO = Li2ZnO2, 5. Взаимодействием основных, амфотерных и кислотных оксидов с основными, амфотерными и кислотными гидроксидами: 2LiOH + ZnO = Li2ZnO2 + 2H2O, 6. Взаимодействием основных, амфотерных гидрооксидов с кислотами: Al(OH)3 + KOH = K[Al(OH)4], 7. Путем обменных реакций основных, амфотерных гидрооксидов, кислот и солей с солями: Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH, Свойства 1. Диссоциируют в растворах или расплавах 2. Способны подвергаться гидролизу 3. Могут взаимодействовать с основными и амфотерными гидроксидами, кислотами и солями, вступая в реакции обмена 4. Способны вступать в многочисленные окислительно-восстановительные реакции, реакции диспропорционирования: 3KClO = KClO3 + 2KCl, БИЛЕТ 10 Термодинамические параметры. Термодинамические функции состояния. Внутренняя энергия и её изменение в различных процессах. Энтальпия и её изменение в различных процессах. Термохимические уравнения. Термодинамические параметры — явления, описывающие макроскопические движения системы. С греческого слово «parametron» переводится как «отмеривающий» или «соразмеряющий». Таким образом, термодинамические параметры это то, что измеряет систему. намагниченность; электрическая поляризация; масса; химический состав компонентов; энтропия. Функция состояния - количественная характеристика системы, которая зависит только от равновесного состояния системы и не зависит от того, по какой траектории в пространстве параметров достигнуто это состояние. Через этот набор параметов определяют четыре характеристические функции состояния системы: внутреннюю энергию (Е), энергию Гельмгольца (F), энергию Гиббса (G), энтальпию (Я). Внутренняя энергия вещества − сумма кинетических энергий молекул и потенциальных энергий их взаимодействия друг с другом. Способы изменения внутренней энергии: теплопередача, совершение работы. Энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Изменение; совершение работы внутри организма, связанной с дыханием, кровообращением; нагревание вдыхаемого воздуха, потребляемой воды, пищи; совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью Уравнения химических реакций, в которых указан тепловой эффект, называют термохимическими. По признаку выделения или поглощения теплоты различают экзотермическую и эндотермические реакции. Экзотермическая реакция – выделяется тепло эндотермическая реакция – тепло поглощается БИЛЕТ 11 Закон Гесса. Следствия закона Гесса. Стандартные энтальпии. Закон Гесса Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса. Следствия из закона Гесса 1. Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов). 2. Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов). Стандартная энтальпия образования Ноf,298 (или Нообр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре. Например, Нof,298(Н2О(ж)) = - 285,83 кДж/моль соответствует изменению энтальпии в процессе Н2(г) + ½O2(г) = Н2О(ж) при Т = 298,15 К и Р = 1 атм. Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре). Стандартной энтальпией сгорания Нoсгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии. БИЛЕТ 12 Энтропия как вероятность состояния системы. Физический смысл энтропии. Изменение энтропии химической реакции. Изменение энтропии вещества с ростом температуры, изменения агрегатного состояния, изменения числа частиц. Свободная энергия Гиббса. Условия самопроизвольного протекания химических процессов. БИЛЕТ 13 Скорость химической реакции. Закон действующих масс. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность реакции. Порядок реакции. Частный порядок реакции. БИЛЕТ 14 Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Теория активных столкновений Аррениуса. БИЛЕТ 15 Теория бинарных соударений. Энергия активации химической реакции. Теория абсолютных скоростей. Активированный комплекс. БИЛЕТ 16 Катализ. Виды катализа. Причины ускоряющего действия катализатора. Энергетическая схема реакции с участием и без участия катализатора. БИЛЕТ 17 Понятие химического равновесия. Константа химического равновесия. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье. БИЛЕТ 18 Определение растворов. Типы растворов. Растворимость. Теплота растворения. Изменение энтропии и энергии Гиббса при растворении. Теории растворов. БИЛЕТ 19 Концентрация раствора. Способы выражения концентрации растворов. Концентрация — величина, количественно характеризующая содержание компонента относительно всей смеси. БИЛЕТ 20 Идеальные растворы. Изменение энтальпии, энтропии, объёма. Законы идеальных растворов (Рауля, повышение и понижение температуры замерзания раствора, осмотическое давление). Понятие осмоса и осмотического давления. БИЛЕТ 21 Электролиты. Сильные и слабые электролиты. Понятия активности электролита. Коэффициент активности, ионная сила раствора. БИЛЕТ 22 Сущность теории электролитической диссоциации Аррениуса. Степень и константа диссоциации. Закон разбавления Оствальда. БИЛЕТ 23 Ионное произведение воды. Водородный показатель (рН). При определенных условиях, вода может вести себя как акцептор протонов или как донор протонов. Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации, т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе. 2H2O ↔ H3O+ + OH— Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+ H2O ↔ H+ + OH— Запишем выражение для константы равновесия, опираясь на закон действия масс: K = [H+]·[OH—]/[H2O] Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды: KН2О = [H+]·[OH—] При температуре 25ºС ионное произведение воды KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений. KН2О = [H+]·[OH—] = 1·10-14 При повышении температуры ионное произведение воды сильно возрастает. Полученное выражение применимо не только к чистой воде, но и к растворам. Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14) БИЛЕТ 24 Гидролиз солей. Различные случаи гидролиза. Степень гидролиза. Константа гидролиза. Расчёт константы гидролиза для различных случаев. Гидролиз соли – это обменное взаимодействие ионов соли с молекулами воды, приводящее к увеличению кислотности или щелочности раствора и образованию слабодиссоциируемых соединений. Различают четыре случая взаимодействия соли и воды. Соли, образуемые сильной кислотой и слабым основанием. Соль образована слабой кислотой и сильным основанием. Соли, образуемые слабыми кислотами и слабыми основаниями. соль образована сильным основанием и сильной кислотой. Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Константа гидролиза – величина, равная произведению констант всех стадий, из которых складывается процесс гидролиза с учетом стехиометрических коэффициентов. Константа гидролиза Kг может быть рассчитана на основе значений ионного произведения воды Kw и константы диссоциации Kд образующихся в результате гидролиза слабой кислоты или слабого основания: Кг = Кw/Кд Чем выше величина константы, тем сильнее соль подвергается гидролизу. Константа гидролиза первой и последующих ступеней для многозарядных слабых ионов сильно отличается: константа гидролиза по первой ступени в несколько раз больше, чем константа гидролиза по второй ступени. Поэтому гидролиз протекает преимущественно по первой ступени БИЛЕТ 25 Окислительно-восстановительные реакции. Степень окисления. Понятия окисления и восстановления. Важнейшие окислители. Важнейшие восстановители. Классификация окислительно-восстановительных реакций (межатомного и межмолекулярного окисления-восстановления, диспропорционирования, внутримолекулярного окисления-восстановления). Окислительно -восстановительные реакции (ОВР) - реакции, протекающие с изменением степени окисления одного или нескольких элементов. Степень окисления - это условный заряд атома в соединении в предположении, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Атом, отдающий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается) – окислителем. Процесс отдачи атомом электронов называется окислением, а процесс принятия атомом электронов - восстановлением. Атомы с минимальными значениями степени окисления могут быть только восстановителями. Атомы с максимальными значениями степени окисления могут быть только окислителями. Атомы с промежуточными значениями степени окисления могут быть и окислителями, и восстановителями. 1 2 |
