химия. методуказ для лаб химия. Электрохимическая коррозия. Введение
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
Электрохимическая коррозия. ВведениеЦель работы – изучение электрохимической коррозии металлов в нейтральной среде. Анодное и катодное защитное металлическое покрытие. ТеорияКоррозия - это процесс самопроизвольного разрушения металла под действием окружающей среды, протекающий на границе раздела фаз. Коррозия является окислительно-восстановительной реакцией, протекающей на поверхности металла. Металлы при коррозии окисляются, а вещества, в контакте с которыми протекает коррозия (кислород воздуха, газы, вода, растворы электролитов, органические вещества), восстанавливаются. Электрохимическая коррозия – это окислительно–восстановительный процесс, протекающий в среде электролита. Электрохимическая коррозия – гетерогенная окислительно-восстановительная реакция, сопровождающаяся, кроме передачи электронов (химический процесс), переносом электронов (электрический процесс). Электрохимическая коррозия возникает при контакте с электролитом двух металлов различной активности. Это возможно при сочетании в одном узле деталей из металлов различной активности или использовании деталей, изготовленных из сплава типа механической смеси При контакте металлов различной активности (например, железо – алюминий) более активный металл – алюминий (анод) окисляется и посылает электроны менее активному металлу – железу (катоду). Атомы металлов не способны связывать электроны (низкая электроотрицательность). В результате перехода электронов с анода на катод происходит выравнивание потенциалов, и процесс останавливается. Однако, если конструкция из разных металлов находится в среде электролита, то реагенты окружающей среды способны принимать электроны. Возникает гальванический элемент, в котором более активный металл (анод) окисляется, электроны перемещаются по металлу к менее активному металлу (катоду) /направленное движение электронов/, на поверхности которого протекает процесс восстановления реагентов электролита. Реагенты (окислители), которые восстанавливаются, при электрохимической коррозии называют катодными деполяризаторами. В водной среде электрохимическая коррозия может протекать с участием ионов водорода (водородная деполяризация): 2H + + 2e = H2 2H2O + 2e = H2 + 2OH-, или с участием кислорода, связываемого ионами водорода из воды (кислородная деполяризация): O2 + 2H2O + 4e = 4OH- Характер процесса деполяризации при электрохимической коррозии зависит от среды, в которой протекает коррозия (кислой, нейтральной и щелочной). При коррозии в кислой среде происходит водородная деполяризация на катоде. Коррозия конструкции, содержащей алюминий – железо, в среде хлороводородной кислоты происходит следующим образом: e0Al/Al3+ = –0,76В, e0Fe/Fe2+ = –0,44В 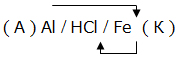 Алюминий, как более активный металл (более низкое значение электродного потенциала окисления), в образовавшемся гальваническом элементе окисляется (анод). Электроны переходят на менее активный металл – железо (катод), где происходит водородная деполяризация. 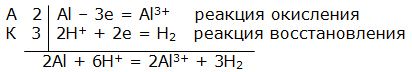 или в молекулярном виде 2Al + 6HСl = 2AlCl3 + 3H2 При коррозии в нейтральной среде (pH = 7) в отсутствие растворенного кислорода также происходит водородная деполяризация на катоде 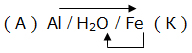 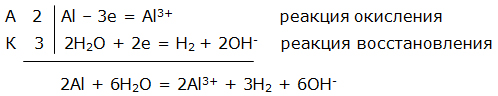 или в молекулярном виде 2Al + 6H2O = 2Al(OH)3 + 3H2. При коррозии в нейтральной среде (pH = 7) в присутствии растворенного кислорода или в щелочной среде (pH > 7) происходит кислородная деполяризация на катоде 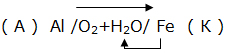 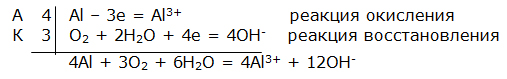 восстановления 4Al + 3O2 + 6H2O = 4Al3+ + 12OH-, или в молекулярном виде 4Al + 3O 2 + 6H2O = 4Al(OH)3 Возможность протекания электрохимической коррозии рассчитывается по Э.Д.С. электрохимического процесса Э.Д.С. = e восстановления – e окисления Если Э.Д.С. имеет положительное значение, то коррозия возможна. Скорость коррозии теоретически тем выше, чем больше Э.Д.С. процесса. Э.Д.С. электрохимической коррозии (скорость коррозии) определяется средой (электродным потенциалом восстановления окислителя) и активностью металла (электродным потенциалом окисления восстановителя). Электродный потенциал процесса восстановления в зависимости от среды:  Для одного и того же металла скорость коррозии будет возрастать: нейтральная среда в отсутствии растворенного кислорода – кислая среда – щелочная среда и нейтральная среда в присутствии растворенного кислорода. Защита металлов от коррозииМетоды защиты металлов от коррозии можно разделить на три типа: 1. Защита поверхности металла покрытиями: неметаллические покрытия; металлические покрытия. 2. Электрохимические методы защиты поверхности: протекторная защита; электрозащита (катодная защита). 3. Использование ингибиторов коррозии. Защита поверхности металла покрытиямиЗащитное действие заключается в том, что в гетерогенной системе разрывается контакт между металлом и окислителем. Все защитные покрытия можно подразделить на: 1. Неметаллические защитные покрытия, к которым относятся краски, эмали, лаки, полимерные пленки и другие полимерные материалы. 2. Металлические защитные покрытия, которые подразделяются на: анодные защитные покрытия, катодные защитные покрытия. К анодным защитным металлическим покрытиям относят металлы, которые являются более активными металлами, чем защищаемый металл. Такие металлы имеют более низкое значение электродного потенциала окисления, чем защищаемый металл. Для железа анодными покрытиями могут быть металлы – цинк, алюминий, магний, титан. Как правило, выбираются металлы, которые подвергаются процессу пассивации. Однако при нарушении защитного покрытия (например, железо покрыто цинком) в случае появления электролита (например, «влажный воздух») возникает микрогальванический элемент, в котором цинк является анодом, а железо – катодом. Электрохимическая схема возникшего гальванического элемента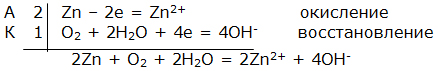 или в молекулярном виде 2Zn + O 2 + 2H2O = 2Zn(OH)2 При нарушении анодного защитного покрытия защищаемая металлическая конструкция не разрушается в результате электрохимической коррозии. Коррозия конструкции протекает значительно медленнее, чем без защитного покрытия. К катодным защитным металлическим покрытиям относят металлы, которые являются менее активными металлами, чем защищаемый металл. Такие металлы имеют более высокое значение электродного потенциала окисления, чем защищаемый металл. Для железа катодными покрытиями могут быть металлы – медь, серебро, олово, никель. Менее активный металл эффективно защищает металлическую конструкцию от коррозии до тех пор, пока не нарушена целостность защитного покрытия. Однако при нарушении защитного покрытия (например, железо покрыто оловом) в случае появления электролита (например, «влажный воздух») возникает микрогальванический элемент, в котором железо является анодом, а олово – катодом. Электрохимическая схема возникшего гальванического элемента 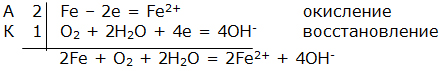 или в молекулярном виде: 2Fe + O 2 + 2H2O = 2Fe(OH)2 . При нарушении катодного защитного покрытия защищаемая металлическая конструкция разрушается в результате электрохимической коррозии. Коррозия протекает значительно быстрее, чем без защитного покрытия. 1. Первоначально провести качественный опыт определения ионов Fe2+. Заполнить мерные бюретки из лабораторных склянок растворами: 1 - K3[Fe(CN)6], 2 - H2O, 3 - Na2SO4, 4 - FeSO4 2. Взять коническую колбу и из мерной бюретки с надписью FeSO4 в коническую колбу добавить 5 мл раствора сульфата железа. Из мерной бюретки с надписью H2O в коническую колбу добавить 5 мл воды. Раствор прозрачный. Из мерной бюретки с надписью K3[Fe(CN)6] в коническую колбу добавить раствор красной кровяной соли. Раствор из прозрачного приобретает темно-синий цвет. Этот качественный опыт демонстрирует, что при добавлении реагента K3[Fe(CN)6] (красной кровяной соли) к раствору содержащему, ионы Fe2+ образуется осадок темно-синего цвета (турнбулева синь). Составить молекулярное и ионно-молекулярное уравнения качественной реакции FeSO4 + K3[Fe(CN)6] → K2SO4 + Fe3[Fe(CN)6]2 3. Для изучения анодной и катодной металлической защиты железной конструкции в опыте используются металлы цинк и медь. 4. Для изучения электрохимической коррозии в два стакана из мерной бюретки с надписью Na2SO4 добавляют по 6 мл раствора. Из мерной бюретки с надписью K3[Fe(CN)6] туда же добавить по 2 мл раствора. Растворы приобретают ярко-желтый цвет. 5. В каждый стакан внести по кусочку железа. В первый стакан в раствор внести кусочек цинка, а во второй стакан в раствор внести кусочек меди. 6. Ввести в соприкосновение металлы. В контакте первого стакана цинк-железо, второго стакана медь-железо. 7. Через 30 сек раствор во втором стакане становится темно-синим. Раствор в первом стакане свой цвет не изменяет. 8. Составить электрохимические схемы получившихся микрогальванических элементов. 9. Составить уравнения окислительно–восстановительного процесса коррозии в воде с растворенным кислородом для пары металлов: цинк-железо и медь-железо. ОборудованиеАктивные клавишиДля работы в этой лабораторной работе применяются следующие клавиши: W, S, A, D – для перемещения в пространстве; F2, E – аналоги средней клавиши манипулятора (при первом нажатии берется объект, при последующем – ставится); Ctrl – присесть; Z – визуальное приближение. F10 – выход из программы.  Рис. 3.1. Активные клавиши клавиатуры  Рис. 3.3. Функции манипулятора Левая клавиша манипулятора (ЛКМ) – управление объектами (в режиме манипуляции). Средняя клавиша манипулятора (СКМ) – взять (применить) объект (в режиме манипуляции). Также данная клавиша позволяет проводить ускоренную работу с некоторыми объектами (например, ускоренное закручивание (откручивание) рукоятки тормозного устройства). Правая клавиша манипулятора (ПКМ) – переход в режим манипуляции (управление объектами), возврат в режим навигации (перемещения по сцене). Примечание: При появившемся курсоре невозможно перевести взгляд вверх и стороны. Оборудование в лабораторной работе Рис. 3.3. Оборудование и реагенты Для проведения виртуальной лабораторной работы используется следующее оборудование: 1. На штативах закреплены 4 мерные бюретки объемом 10 мл с градуировкой по 1 мл для: K3[Fe(CN)6], H2O, Na2SO4, FeSO4. На лабораторном столе стоят: 1. 4 лабораторные склянки: K3[Fe(CN)6], H2O, Na2SO4, FeSO4. 2. Коническая колба. 3. 2 стакана. 4. Кусочек металла цинка (белый цвет). 5. Кусочек металла меди (желтый цвет). 6. 2 кусочка металла железа (серый цвет). Порядок выполнения работыОпыт №11. Открутите крышку у склянки с K3[Fe(CN)6], крышка автоматически поместится рядом. Примените склянку без крышки к мерной бюретке с надписью K3[Fe(CN)6], откройте кран, произойдет налив жидкости в бюретку (15 мл). Крышку закрутите. Аналогичные действия произведите с H2O, Na2SO4 и FeSO4. 2. Коническую колбу примените к бюретке с надписью FeSO4 (колба установится под выходным отверстием бюретки), откройте кран, автоматически произойдет налив 5 мл жидкости. Аналогично в колбу налейте H2O и K3[Fe(CN)6], по 5 мл. Понаблюдайте. Опыт №21. Стакан примените к бюретке с надписью Na2SO4, откройте кран, произойдет налив 6 мл жидкости. В этот же стакан налейте K3[Fe(CN)6] (2 мл). Понаблюдайте. 2. Аналогично п.1 заполните второй стакан. 3. Кусок цинка поместите в первый стакан. 4. Во второй стакан положите кусок меди. 5. В первый (цинк) и во второй стаканы (медь) опустите по куску железа. Понаблюдайте. Последующие действия1. Составьте электрохимические схемы получившихся микрогальванических элементов. 2. Составьте уравнения окислительно–восстановительного процесса коррозии в воде с растворенным кислородом для пары металлов: цинк-железо и медь-железо. Отчет6.1 Форма отчета Цель работы ___________________________________________ 1. Молекулярное и молекулярно-ионное уравнения химической реакции качественного определения ионов Fe2+ _________________________________________________ 2. Составить электрохимические схемы образовавшихся гальванических элементов _________________________________________ 3. Составить уравнения окислительно–восстановительных процессов коррозии в воде для пары металлов: цинк-железо; медь-железо. 4. Сделать вывод, если принять кусочек железа за конструкцию, указать в каком случае имеет место анодное и катодное защитное металлическое покрытие. Работу выполнил _________________________________________________ Отчет принял ____________________________________________________ «____» _______________________201___г Контрольные вопросы1. Химическая коррозия металлов. 2. Электрохимическая коррозия металлов. 3. Коррозия в кислой среде. 4. Коррозия в нейтральной среде в отсутствии и присутствии растворенного кислорода. 5. Коррозия в щелочной среде. 6. Методы защиты металлов от коррозии. 7. Анодное и катодное защитные металлические покрытия. 8. Электрохимические методы защиты металлов от коррозии. 9. Протекторная защита металлов от коррозии. 10. Электрозащита (катодная защита). Литература1. Глинка Н.Л. Общая химия / Н.Л. Глинка. - Л.: Химия, 2004 г. 2. Коровин Н.В. Общая химия / Н.В. Коровин. - М.: Высшая школа, 2002 г. 3. Обухов В.М. Общая химия: Учебное пособие / В.М. Обухов. – Тюмень: ТюмГНГУ, 2004 г. |
