|
|
Таблица потенциалов. Электрохимия Стандартные электродные потенциалы в водных растворах
Электрохимия
Стандартные электродные потенциалы в водных растворах
В таблице приведены значения стандартных электродных потенциалов (Е0) при температуре 250С и нормальном атмосферном давлении 101,3 кПа. Все величины выражены по отношению к потенциалу стандартного водородного электрода.
Если условия отличаются от стандартных (250С, 101,3 кПа, концентрации окисленной и восстановленной формы равны 1), то электродный потенциал рассчитывают по уравнению Нернста:
 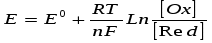 , где: , где:
Е- электродный потенциал при заданных условиях;
Е0-стандартный электродный потенциал(из справочника);
R-универсальная газовая постоянная(3,14);
Т- заданная температура
[Ox]-концентрация окисленной формы вещества;
[Red]-концентрация восстановленной формы вещества
Элемент
|
Электродный процесс
|
Е0, В
|
Азот
|
3N2+2e=2N3-
3N2+2H++2e=2HN3
N2+4H2O+2e=2NH2OH+2OH-
N2+2H2O+4H++2e=(2NH2OH)H+
N2+4H2O+4e=N2H4+4OH-
N2+8H2O+6e=NH4OH+6OH-
N2+5H++4e=(N2H4)H+
N2+6H++6e=2NH3
N2+8H++6e=2NH4+
|
-3,400
-3,100
-3,040
-1,870
-1,160
-0,740
-0,230
+0,057
+0,260
|
N3-+7H2O+6e=N2H4+NH3+7OH-
HN3+11H++8e=3NH4+
|
-0,620
+0,690
|
Элемент
|
Электродный процесс
|
Е0, В
|
Азот
|
N2H4+4H2O+2e=2NH4OH+2OH-
(N2H4)H++3H++2e=NH4+
|
+0,100
+1,270
|
NH2OH+2H2O+2e=NH4OH+2OH-
(NH2OH)H++2H++2e=NH4++H2O
H2N2O2+6H++4e=(2NH2OH)H+
|
+0,420
+1,350
+0,500
|
H2N2O2+2H++2e=N2+2H2O
NO2-+H2O+e=NO+2OH-
|
+2,650
-0,460
|
NO2-+6H2O+6e=NH4OH+7OH-
2NO2-+4H2O+6e=N2+8OH-
2HNO2+4H++4e=H2N2O2+2H2O
HNO2+7H++6e=NH4++2H2O
HNO2+H++e=NO+H2O
2HNO2+4H++4e=N2O+3H2O
2HNO2+6H++6e=N2+4H2O
|
-0,150
+0,410
+0,830
+0,860
+0,990
+1,290
+1,440
|
N2O+H2O+2e=N2+2OH-
N2O+2H++2e=N2+H2O
|
+0,940
+1,770
|
2NO+2H2O+4e=N2+4OH-
2NO+4H++4e=N2+2H2O
|
+0,850
+1,680
|
N2O4(2NO2)+4H2O+8e=N2+8OH-
N2O4(2NO2)+2e=2NO2-
N2O4(2NO2)+2H++2e=2HNO2
N2O4(2NO2)+8H++8e=N2+4H2O
|
+0,530
+0,880
+1,070
+1,350
|
NO3-+H2O+e=NO2+2OH-
NO3-+2H2O+3e=NO+4OH-
|
-0,860
-0,140
|
NO3-+7H2O+8e=NH4OH+9OH-
NO3-+H2O+2e=NO2-+2OH-
NO3-+8H++6e=(NH2OH)H++2H2O
NO3-+2H++e=NO2+H2O
2NO3-+17H++14e=(N2H4)H++6H2O
NO3-+10H++8e=NH4++3H2O
NO3-+3H++2e=HNO2+H2O
NO3-+4H++3e=NO+2H2O
2NO3-+12H++10e=N2+6H2O
|
-0,120
+0,010
+0,730
+0.800
+0,840
+0,870
+0,940
+0,960
+1,240
|
Элемент
|
Электродный процесс
|
Е0, В
|
Актиний
|
Ac3++3e=Ac
|
-2,600
|
Алюминий
|
A1O2-+2H2O+3e=A1+4OH-
[A1(OH)4]-+3e=A1+4OH-
A1(OH)3+3e=A1+3OH-
A1F63-+3e=A1+6F-
A13++3е=A1
A1(OH)3(т)+3H++3e=A1+3H2O
|
-2,350
-2,336
-2,310
-2,070
-1,660
-1,538
|
Барий
|
Ba2++2e=Ba
|
-2,900
|
Бериллий
|
Be2O32-+3H2O+4e=2Be+6OH-
Be2++2e=Be
|
-2,620
-1,850
|
Бор
|
H2BO3-+H2O+3e=B+4OH-
BF4-+3e=B+4F-
H3BO3+3H2O+4e=B+3H2O
|
-1,790
-1,040
-0,870
|
Бром
|
Br3-+2e=3Br-
Br2 + 2e =2 Br−
Br2 (р-р) + 2e = 2 Br−
|
+1,050
+1,066
+1,087
|
2BrO2-+2H2O+2e=Br2+4OH-
BrO-+H2O+2e=Br-+2OH-
HBrO + H2O + 2e = Br− + 2OH−
HBrO +H+ + 2e = Br− + H2O
2HBrO +H+ + 2e =Br2 (р-р) + H2O
|
+0,450
+0,760
+0,761
+1,331
+1,574
|
2BrO3− + 6H2O + 10е = Br2 + 12OH−
BrO3-+2H2O+4e=BrO-+4OH-
BrO3− + 3H2O + 6е = Br− + 6OH−
BrO3− +6H+ + 6е =Br− + 3H2O
BrO3-+5Н++4е=HBrO+2H2O
2BrO3− +6H+ + 5е =Br2 + 3H2O
|
+0,500
+0,540
+0,610
+1,440
+1,450
+1,520
|
Ванадий
|
V2++2e=V
|
-1,175
|
V3++3e=V2+
|
-0,255
|
VO2++e=VO+
VO+ + 2H+ + е =V3+ + H2O
VO2++4H++5e=V+2H2O
VO2++4H++3e=V2++2H2O
VO2++4H++2e=V3++2H2O
V2O5+6H++2e=2VO2++3H2O
VO2++2H++e=VO2++3H2O
|
-0,044
+0,337
-0,250
+0,360
+0,668
+0,958
+1,004
|
Элемент
|
Электродный процесс
|
Е0, В
|
Ванадий
|
VO43-+6H++2e=VO++3H2O
H2VO4-+4H++e=VO2++3H2O
Bi+3H++3e=BiH3
|
+1,256
+1,314
<-0,800
|
Висмут
|
Bi2O3+3H2O+6e=2Bi+6OH-
BiOC1+2H++3e=Bi+H2O+C1-
BiC14-+3e=Bi+3C1-
|
-0,460
+0,160
+0,160
|
Bi2O4+H2O+2e=Bi2O3+2OH-
Bi2O4+4H++2e=2BiO++2H2O
NaBiO3+4H++2e=BiO++Na++2H2O
|
+0,560
+1,590
>+1,800
|
Водород
|
H2+2e=2H-
|
-2,250
|
2H2O+2e=H2+2OH-
2H+(10-7M)+2e=H2
2H++2e=H2
HO2-+H2O+2e=3OH-
H2O2+2H++2e=2H2O
|
-0,828
-0,414
0,000
+0,880
+1,770
|
Вольфрам
|
WO2(ТВ) + 4H+ + 4е= W(ТВ) + 2H2O
|
-0,120
|
W2O5(ТВ) +2H++2е= 2WO2(ТВ) + H2O
W(CN)83- + е = W(CN)84 -
|
-0,031
+0,457
|
WO42-+4H2O+6e=W+8OH-
2WO3.(ТВ)+6H+ + 6e =W(ТВ) + 3H2O
2WO3.(ТВ)+2H+ + 2e = W205 (ТВ)+H2O
WO42-+8H++6e=W+4H2O
WO42- + 4H+ + e= W02(ТВ) + 2H2O
2WO42- + 6H+ + 2e= W205(ТВ) + 3H2O
|
-1,050
-0,090
-0,029
+0,049
+0,386
+0,801
|
Гадолиний
|
Gd3++3e=Gd
|
-2,397
|
Галлий
|
H2GaO3-+H2O+3e=Ga+4OH-Ga3++3e=Ga
|
-1,220
-0,530
|
Гафний
|
HfO(OH)2+H2O+4e=Hf+4OH-
Hf+4+4e=Hf
HfO2+4H++4e=Hf+2H2O
|
-2,500
-1,700
-1,570
|
Германий
|
Ge+4H++4e=GeH4
|
<-0,300
|
GeO+2H++2e=Ge+H2O
Ge2++2e=Ge
|
-0,200
0,000
|
HGeO3-+2H2O+4e=Ge+5OH-
GeO2+4H++4e=Ge+2H2O
|
-1,000
-0,150
|
Элемент
|
Электродный процесс
|
Е0, В
|
Германий
|
H2GeO3+4H++4e=Ge+3H2O
GeO2+2H++2e=GeO(коричневый)+H2O
|
-0,130
-0,120
|
Гольмий
|
Ho3++3e=Ho
|
-2,319
|
Диспрозий
|
Dy3++3e=Dy
|
-2,353
|
Европий
|
Eu2++2e=Eu
Eu3++e=Eu2+
|
|
Железо
|
FeS+2e=Fe+S2-
Fe(OH)2+2e=Fe+2OH-
FeCO3+2e=Fe+CO32-
Fe2++2e=Fe
Fe(OH)2+2H++2e=Fe+2H2O
|
-0,950
-0,877
-0,756
-0,440
-0,047
|
Fe(OH)3+e=Fe(OH)2+OH-
Fe2O3+H2O+2H++2e=2Fe(OH)2
Fe2O3+6H++6e=2Fe+3H2O
Fe3++3e=Fe
Fe(OH)3+3H++3e=Fe+3H2O
Fe(OH)3+H++e=Fe(OH)2+H2O
Fe(CN)63-+3e=Fe(CN)64-
Fe3++e=Fe2+
Fe(C12H8N2)33++e= Fe(C12H8N2)32+
|
-0,560
-0,057
-0,051
-0,037
+0,059
+0,271
+0,356
+0,770
+1,060
|
Fe3O4+8H++8e=3Fe+4H2O
Fe3O4+8H++2e=3Fe3++4H2O
FeO42-+8H++3e=Fe3++4H2O
|
-0,085
+0,980
+1,700
| |
|
|
 Скачать 81.06 Kb.
Скачать 81.06 Kb.
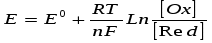 , где:
, где: