|
|
Электролиты 11класс. химия электролиты 11 класс б. Электролитическая диссоциация
III. Обобщение знаний по теме «Электролитическая диссоциация»
1. Что такое электрический ток?
электрический ток – это движение электронов (электронная проводимость)
электрический ток – это движение ионов (ионная проводимость)
Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами.
Электролиты – вещества обладающие электропроводностью ионного типа.
Соответственно, вещества, растворы или расплавы которых не проводят электрического тока, называются неэлектролитами.
Почему электролиты проводят электрический ток?
3. Объясните значение термина электролитическая диссоциация
HNO2 ↔ H+ + NO2
→ диссоциация (ионизация)
← ассоциация (моляризация)
4. Назовите главную причину диссоциации.
Гидратация ионов
В растворе или расплаве электролиты распадаются на ионы - диссоциируют.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Электролитическая диссоциация происходит вследствие взаимодействия полярных молекул растворителя с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя разрушают кристаллическую решетку и переводят ионы в раствор в форме сольватированныхзаряженных частиц. Растворенное вещество и растворитель оказывают обоюдное влияние: полярные молекулы растворителя разрушают кристаллическую решетку, а высвобождающиеся ионы, переходя в раствор, вызывают упорядочивание молекул растворителя. В то же время полярные молекулы растворителя ориентированы в соответствии с зарядом ионов.
5. Классификация ионов:
ионы
|
Заряд иона
|
Положительный (катион)
|
Отрицательный (анион)
|
Простые
|
H+ ; K+; Al3+
|
Cl-; F-; S2-
|
Сложные
|
NH4+;
|
SO42-; PO43-
|
Идеи С. Аррениуса, разработанные в 1887 г. составили основу теории электролитической диссоциации. Согласно ей, при растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные частицы. Под действием постоянного электрического тока неупорядоченное движение ионов в растворе или расплаве прекращается: положительно заряженные ионы (они называются катионами) движутся к катоду, отрицательно заряженные (называются анионами) - к аноду. Соответственно, на катоде минус, а на аноде – плюс. Одновременно с распадом электролита на ионы происходит объединение ионов в молекулы. Поэтому электролитическая диссоциация является обратимым процессом и при написании уравнений диссоциации указывается, что реакция идет в обе стороны.
6. ∑ сумма зарядов ионов в молекуле электролита = 0
Упражнение: Напишите формулы электролитов, в водном растворе которых имеются ионы:
а) Na+ и S2-
б) Co3+ и NO2
в) K+ и OH-
г) Ca2+ и HCO3-
д) CuOH+ и Cl-
Назовите эти электролиты.
7. Сила электролита - способность образовывать ионы.
8. Степень диссоциации выражается отношением числа распавшихся на ионы молекул к общему числу молекул в растворе.
Важной характеристикой электролитов служит степень диссоциации α:
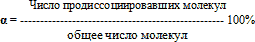
Сила электролита
|
Степень диссоциации - α
|
Электролит
|
Сильные
|
100%
|
Растворимые в воде соли, основания (Li – Fr; Ca – Ra)
Сильные минеральные кислоты *
|
Средней силы
|
3….7 %
|
HNO2; HF; H2CO3; H2CO3; H3PO4
|
Слабые
|
< 3%
|
Гидроксиды d-элементов в низкой степени окисления; амфотерные соединения, органические кислоты, NH4OH, H2O
|
Иcключения: Mg(OH)2 нерастворимое основание является сильным электролитом;
HgCl2; Fe(SCN)3 растворимые соли не являются электролитами.
*9. Силу кислородсодержащих кислот можно определить по следующему правилу
HmROn
R – кислотообразующий элемент
m – число атомов водорода
n – число атомов кислорода
если m - n = 0 очень слабая
m - n = 1 слабая
m - n = 2 сильная
m - n = 3 очень сильная
упражнение: рассчитайте силу кислоты
1 вариант
|
2 вариант
|
HNO2 2-1 =1 слабая
HNO3 3-1=2 сильная
H2SO4 4-2=2 сильная
|
H2SO3 3-2=1 слабая
HClO4 4-1=3 очень сильная
HClO3 3-1=2 сильная
|
Сила бескислородных кислот:
Сильные: HI, HBr, HCl
Слабые: остальные бескислородные кислоты
Количественные характеристики силы электролита
α (степень электролитической диссоциации) определяется опытным путем
|
КД (константа диссоциации) более точная характеристика способности электролита к диссоциации
|
зависит от
|
а) от природы электролита и растворителя
б) концентрации
в) от температуры раствора
г) от репрессии ионизации
|
а) от температуры раствора
|
Значение константы диссоциации определяется по справочнику.
Чем больше Кд (константа диссоциации), тем больше ионов в растворе, тем сильнее электролит
Запомнить!
Чем меньше концентрация электролита в водном растворе, тем больше степень диссоциации.
Чем выше температура раствора электролита, тем выше степень диссоциации
Репрессия ионизации под влиянием одноименных ионов α (степеньэлектролитической диссоциации) подавляется
|
|
|
 Скачать 24.24 Kb.
Скачать 24.24 Kb.