Тарасиков ХТОВ. Этого класса соединений происходит от греческого слова фено несущий свет. Первый представитель гомологического ряда фенолов оксибензол C
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное автономное образовательное учреждение высшего образования «Уральский Федеральный Университет имени первого Президента России Б. Н. Ельцина» Химико-технологический институт Кафедра технологии органического синтеза Домашнее задание по дисциплине «Химия и технология органических веществ» Методы получения фенола и анилина Преподаватель Берсенева В.С. Выполнил: студент гр. Х-300003 Тарасиков С.В. Екатеринбург, 2022 СодержаниеВведение Органические соединения, содержащие гидроксильную группу, связанную непосредственно с атомом углерода ароматического ядра, называются фенолами. Органические соединения, содержащие гидроксильную группу, связанную непосредственно с атомом углерода ароматического ядра, называются фенолами.Название этого класса соединений происходит от греческого слова «фено» - «несущий свет». Первый представитель гомологического ряда фенолов - окси-бензол C6H5OH называют обычно просто фенолом или карболовой кислотой. Фенол – простейший представитель класса фенолов, представляет собой бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления. Обладает специфическим запахом – запах гуаши. Умеренно растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. Токсичен, Класс опасности 2. При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Основными областями применение фенола являются производство фенолформальдегидных смол, получение бисфенола А, капролактама и в медицине, например в качестве консерванта для вакцин. Мировое производство фенола составляет 10 млн т/год. По объёму производства фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ. История фенола насчитывает уже более 160 лет. Впервые он был выделен из каменноугольной смолы в 1834 г., откуда и получил свое название - карболовая (угольная) кислота. Быстрый рост потребления фенола поставил вопрос об искусственных способах его получения, создание которых является одной из самых ярких страниц в истории органической химии. Синтетические методы синтеза фенола различаются природой используемого сырья, химизмом и экономичностью процесса. Из синтетических методов производства фенола промышленное значение имеют следующие: - каталитическое окисление толуола - прямое окисление бензола в среде уксусной кислоты - окислительное хлорирование бензола - кумольный метод совместного производства фенола и ацетона через изопропилбензол; - из бензола через циклогексан. Анили́н (фениламин) — органическое соединение с формулой С6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и даже с аммиаком. С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15 %. В 1842 году профессором Казанского университета Н. Н. Зининым был разработан более рациональный способ получения анилина восстановлением нитробензола (реакция Зинина). При взаимодействии концентрированной соляной кислоты с железом выделялся атомарный водород, более химически активный по сравнению с молекулярным. В реакционную массу вливали нитробензол, восстанавливавшийся до анилина. Промышленное производство фиолетового красителя мовеина на основе анилина началось в 1856 году. В настоящий момент в мире основная часть (85 %) производимого анилина используется для производства метилдиизоцианатов, (MDI) используемых затем для производства полиуретанов. Анилин также используется при производстве искусственных каучуков (9 %), гербицидов (2 %) и красителей (2 %). В России он в основном применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты), но в связи с ожидаемым ростом производства полиуретанов возможно значительное изменение картины потребителей в среднесрочной перспективе. Методы получения фенола1. Кумольный метод. Кумольный метод заключается в алкилировании бензола, окислении полученного изопропилбензола в гидропероксид кумола и последующем разложении его на фенол и ацетон: 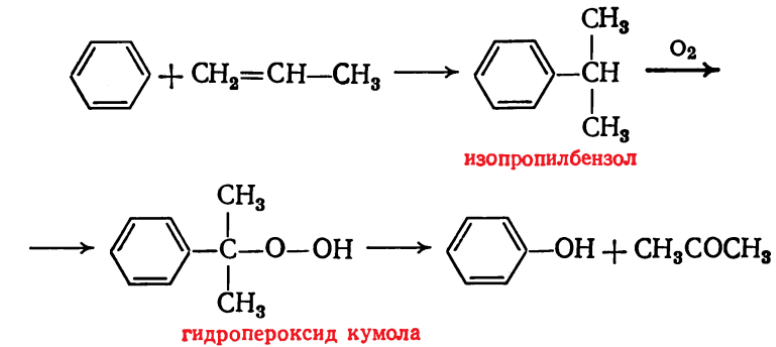 Рис. 1. Стадии превращения кумола в фенол. Изопропилбензол получают действием на бензол чистого пропилена или пропан-пропиленовой фракции нефтекрекинга, очищенной от других ненасыщенных соединений, влаги, меркаптанов и сероводорода, отравляющих катализатор. В качестве катализатора используют трихлорид алюминия, растворенный в полиалкилбензоле, например. в диизопропилбензоле. Алкилирование ведут при 85 °С и избыточном давлении 0,5 МПа, что обеспечивает протекание процесса в жидкой фазе. Изопропилбензол окисляют в гидропероксид кислородом воздуха или техническим кислородом при 110—130°С в присутствии солей металлов переменной валентности (железо, никель, кобальт, марганец) Разлагают гидропероксид разбавленными кислотами (серной или фосфорной) или небольшими количествами концентрированной серной кислоты при 30—60 °С. После ректификации получают фенол, ацетон и некоторое количество α-метилстирола. Кумол подается в реактор окисления, где его смешивают с разбавленным водным раствором карбоната натрия. Затем добавляют небольшое количество стеарата натрия, чтобы смесь стала эмульсией и обеспечивался хороший контакт с кислородом. Кислород подают в составе воздуха в нижнюю часть реактора и барботируют вверх сквозь эмульсию. Происходит превращение кумола в гидропероксид. Температуру удерживают на уровне 120 °С за счет регулирования скорости потока, проходящего через реактор. При такой температуре поток, выходящий из нижней части реактора окисления, состоит на 25% из гидропероксида и 75% непрореагировавшего кумола. В верхней части сосуда находится система трубопроводов, необходимая для удаления азота, поступившего с воздухом, и избытка кислорода. Поток, вышедший из нижней части реактора, поступает в колонну фракционирования для отделения непрореагировавшего кумола, который возвращается в реактор окисления. Гидропероксид кумола с концентрацией примерно 80% поступает в другой реактор – на вторую стадию реакции. Для разложения пероксида с получением фенола и ацетона используется разбавленная серная кислота. Реакцию проводят при температуре 70–80 °С и давлении 1,75–3,5 атм. Масса, выходящая из реактора, состоит приблизительно на 60% из фенола, на 35% из ацетона, а также содержит прочие продукты, в основном α‑метилстирол и ацетофенон. Проток проходит через сепаратор, где кислота, вода и соль осаждаются. Для дальнейшей обработки вещества проходят через ряд ректификационных колонн, где отделяются друг от друга. 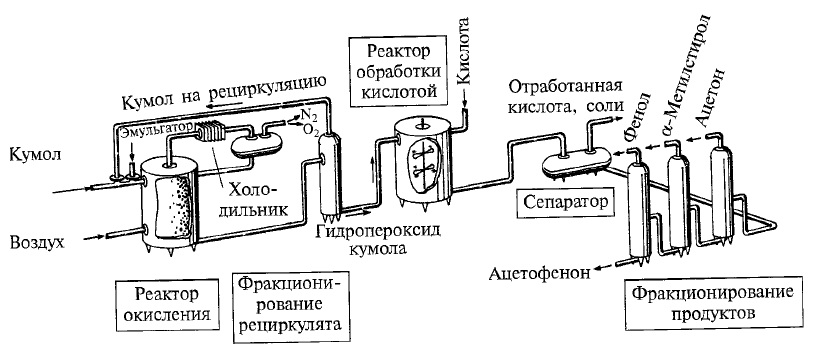 Рис. 2. Технологическая схема производства фенола кумольным методом. α-Метилстирол обычно обрабатывают водородом в присутствии катализатора, и он превращается обратно в кумол и возвращается в процесс. Несмотря на прекрасно отлаженную технологию и длительный опыт эксплуатации, кумольный метод имеет ряд недостатков. Прежде всего это наличие взрывоопасного промежуточного соединения (гидропероксид кумола), а также многостадийность метода, что требует повышенных капитальных затрат и делает труднодостижимым высокий выход фенола в расчете на исходный бензол. Так, при выходе полезного продукта 95% на каждой из трех стадий итоговый выход составит лишь 86%. Приблизительно такой выход фенола и дает кумольный метод в настоящее время. Но самый важный и принципиально неустранимый недостаток кумольного метода связан с тем, что в качестве побочного продукта образуется ацетон. Это обстоятельство, которое первоначально рассматривалось как сильная сторона метода, становится все более серьезной проблемой, поскольку ацетон не находит эквивалентного рынка сбыта. В 90-х годах эта проблема стала особенно ощутимой после создания новых способов синтеза метилметакрилата путем окисления углеводородов С4, что резко сократило потребность в ацетоне. Об остроте ситуации говорит тот факт, что в Японии разработана технология, предусматривающая рецикл ацетона. С этой целью к традиционной кумольной схеме добавляются еще две стадии, гидрирование 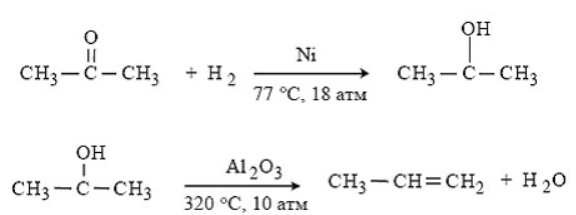 ацетона в изопропиловый спирт и дегидратация последнего в пропилен. Образующийся пропилен снова возвращают на стадию алкилирования бензола. В 1992 году фирма «Mitsui» пустила крупное производство фенола (200 тыс. т/год), основанное на этой пятистадийной кумольной технологии. ацетона в изопропиловый спирт и дегидратация последнего в пропилен. Образующийся пропилен снова возвращают на стадию алкилирования бензола. В 1992 году фирма «Mitsui» пустила крупное производство фенола (200 тыс. т/год), основанное на этой пятистадийной кумольной технологии.2. Метод Рашига Получение фенола методом парофазного гидролиза хлорбензола может быть совмещено с получением хлорбензола окислительным хлорированием бензола хлороводородом в присутствии кислорода воздуха 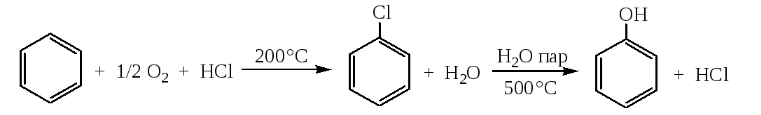 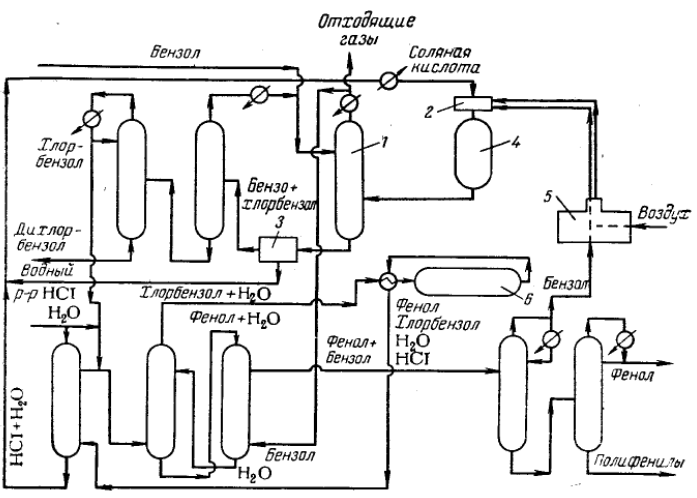 Рис. 4. Получение фенола способом Рашига. 1 – холодильник; 2 – смеситель; 3 – разделитель; 4 – реактор хлорирования; 5 ‑ подогреватель; 6 – гидролизный аппарат. Хлорирование бензола соляной кислотой протекает в присутствии воздуха. Температура реакции 250-270°. Катализатором служат окислы алюминия, меди и железа. Так как реакция является сильно экзотермической, то требуется интенсивное охлаждение. Наилучшее использование соляной кислоты достигается при потреблении ее 73 кг/м3/час. При 5,25%-ной конверсии при хлорировании образуется хлорбензол наряду с дихлорбензолом в отношении 20 : 1. Дихлорбензол содержит 70% п-дихлорбензола и 30% м-дихлорбензола. При доведении конверсии до 24% количество дихлорбензола значительно возрастает; на пять частей хлорбензола приходится одна часть дихлорбензола. При 10%-ной конверсии на 1000 кг бензола требуется 305 кг 18%-ной соляной кислоты и 218 кг воздуха. Реакционные газы охлаждаются, и непрореагировавший бензол и продукты реакции конденсируются. Несконденсировавшиеся фракции поглощаются адсорбентами. Бензол и хлорбензол отделяются друг от друга в трех последовательно установленных дистилляционных колоннах. Хлорбензол переводится в фенол в паровой фазе при каталитическом действии фосфата кальция. Температура поддерживается в интервале 450-500°. Здесь также нужно вести процесс с небольшой конверсией (8-15 % из расчета на фенол), чтобы получать выход фепола 85-95%. При большей степени конверсии выход фенола быстро падает. Съем фенола с 1 м3 катализатора составляет 95-110 кг/час. Катализатор выдерживает только 3-4 часа работы, так как быстро забивается углеродом и теряет свою активность. Катализатор регенерируется воздухом, температура при этом не должна превышать 580°. Поскольку этот производственный процесс ведется с небольшой степенью превращения на отдельных стадиях, то он требует тщательной разработки. В настоящее время этот процесс также экономичен, как и другие методы производства синтетического фенола. При разработке производственного процесса возникали большие трудности, прежде всего с выбором материала для аппаратуры, так как при всех операциях происходит значительная коррозия. Наряду с керамическими материалами применялся также тантал. Выделяющийся хлористый водород вновь может быть использован для окислительного хлорирования. Теоретически в этом процессе должны расходоваться только бензол и кислород воздуха; на практике приходится компенсировать потери хлористого водорода. На 1 т фенола, получаемого по способу Рашига, расходуется примерно 0,998 т бензола и 0,172 т хлористого водорода. Недостатками метода Рашига являются высокие температуры, а также высокая агрессивность среды, что приводит к необходимости применения специального коррозионностойкого оборудования 3. Гидролиз хлорбензола В 1927 году впервые в промышленном масштабе был осуществлен синтез фенола через хлорбензол – способом Дау. Без катализатора процесс может быть осуществлен действием 15‑20%‑го раствора едкого натра на хлорбензол при 360–400 °С и давлении свыше 30 МПа. Процесс можно провести при обычном давлении, пропуская смесь паров воды и хлорбензола через нагретый до высокой температуры катализатор. Установлено, что оптимальная температура 550–600 °С. В качестве катализатора используется хлорид магния, нанесенный на силикагель и активированный соединениями меди. При этом активность катализатора снижается быстро и его регенерируют в токе воздуха при 600–700 °С. 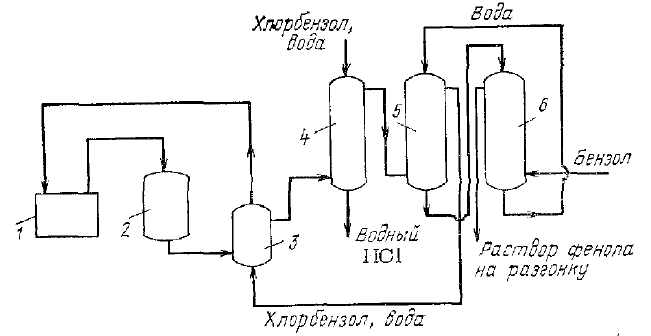 Рис. 3. Принципиальная схема производства фенола гидролизом хлорбензола. 1 – перегреватель; 2 – контактный аппарат; 3 – теплообменник; 4 – колонна для удаления хлороводорода; 5 – колонна для отделения хлорбензола; 6 – колонна для экстракции фенола из воды. Смесь паров хлорбензола и воды из колонны 5 проходит теплообменник 3 и поступает в перегреватель 1, где нагревается до 420 °С, и подается в контактный аппарат 2, где происходит гидролиз при 450–550 °С в присутствии катализатора. Конверсия хлорбензола за один проход составляет 8–15%, выход фенола 90–95%. После контактного аппарата прореагировавшие пары проходят через теплообменник 3, где охлаждаются до 200 °С и поступают в скруббер 4, орошаемый хлорбензолом с водой. Хлороводород при этом поглощается, а хлорбензол и фенол поступают в колонну 5, орошаемую водой для отмывки фенола. Раствор фенола направляется в колонну 6, где происходит экстракция фенола бензолом. Хлорбензол и вода из колонны 5, замыкая цикл, поступают в теплообменник 3 и перегреватель 1. Бензольный раствор фенола из колонны 6 направляют на разгонку для выделения фенола. Процесс можно осуществить и в жидкой фазе под давлением. При интенсивном перемешивании и температуре 350–370 °С и давлении 20 МПа процесс ускоряется, что создает возможность вести непрерывный процесс в трубчатом реакторе из меди или из стальных труб, выложенных медью. 3. Окислением толуола Процесс состоит из двух стадий: окисление толуола в бензойную кислоту в жидкой фазе и окисление бензойной кислоты в фенол жидкофазным или парофазным процессами. На первой стадии окисление осуществляется воздушной смесью при давлении около 0,6 МПа и температуре 160–180 °C в присутствии катализатора – углекислый марганец или кобальт в смеси с бромистым натрием. Выход бензойной кислоты 90–95%. Бензойную кислоту отделяют от непрореагировавшего толуола с помощью ректификации. 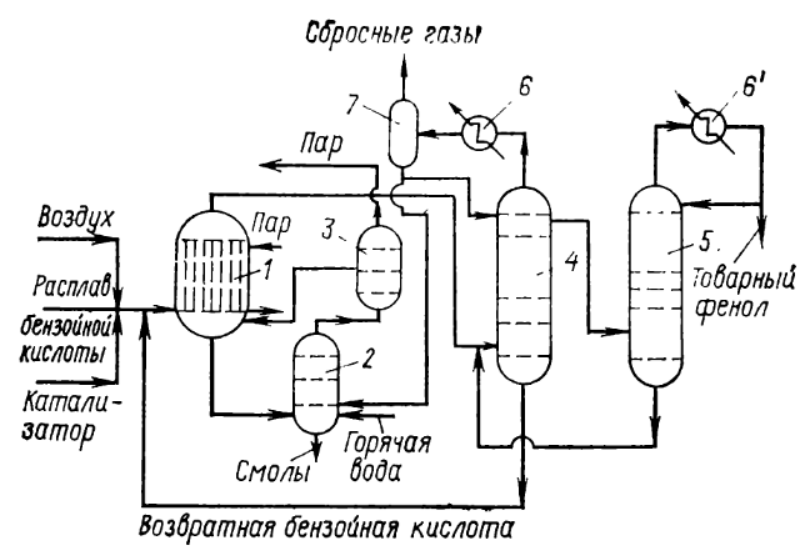 Рис. 5. Технологическая схема получения фенола окислением толуола. 1 – реактор; 2 – экстрактор; 3 – испаритель; 4,5 – ректификационные колонны; 6, 6’ ‑ холодильники-конденсаторы; 7 – газосепаратор. На второй стадии процесса окисления в расплав бензойной кислоты, содержащей катализатор – бензоаты меди и промотор - соли магния, подают воздух и пар при температуре в реакторе 1 220-245 °C, образующийся фенол в двух ректификационных колонных 4 и 5 отпаривается из системы, а непрореагировавшая бензойная кислота возвращается в процесс. Раствор бензойной кислоты концентрируется в испарителе 3 и рециркулирует в реактор. Выход фенола составляет 80% на толуол. 4. Сульфурационный метод Основан на сульфировании бензола серной кислотой и щелочным плавлением сульфокислоты. Процесс состоит из четырех стадий: сульфирование бензола, действие сульфита натрия на бензолсульфокислоту с образованием бензолсульфоната натрия, сплавление бензолсульфоната натрия с твердой щёлочью при 320 °C, 19‑29 МПа с образованием фенолята натрия и подкисление раствора фенолята натрия сернистым ангидридом с небольшим количеством серной кислоты с образованием фенола: 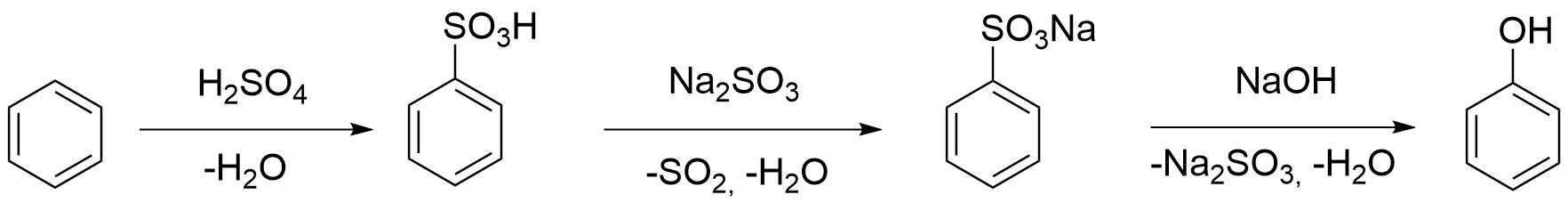 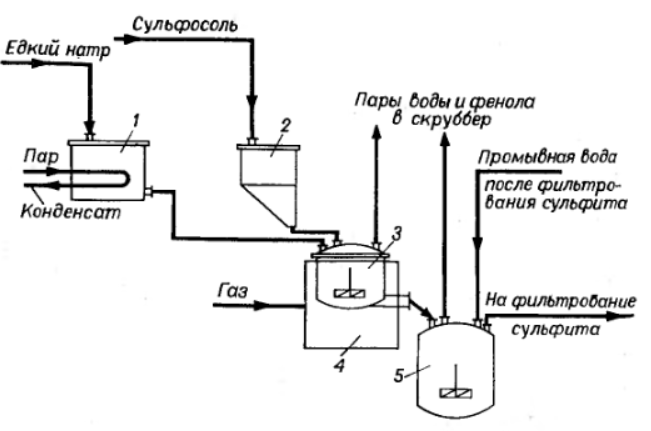   Рис. 7. Технологическая схема парофазного сульфирования углеводородов. 1 – сульфуратор; 2 – конденсатор; 3 – сепаратор; 4 – емкость для углеводородного сырья; 5 – насос; 6 – испаритель. Потоки: I – серная кислота; II и II’ – свежее и оборотное УВ сырье; III – вода; IV – сульфомасса. Рис. 8. Схема щелочного плавления бензолсульфокислоты. 1 – сборник; 2 – мерник; 3 – котел для плавления; 4 – печь; 5 – гаситель. 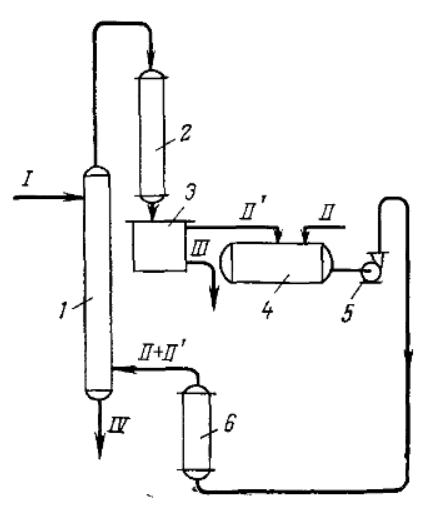 Для сульфирования бензола применяют концентрированную серную кислоту с соотношением Н2SО4 : бензол = 2 : 1. Периодический процесс сульфирования проводят при 120—150 °С. Перед началом щелочного плавления загружают 70–75% раствор щелочи и упаривают его. Из стальных мерников 2 в котел постепенно вводят раствор бензолсульфоната. Пары воды, содержащие фенол конденсируются в скрубберах, орошаемых водой, и образующийся конденсат передают на выделение фенола. По окончании операции щелочной плав сливают в наполненный водой стальной гаситель 5, снабженный мешалкой. Пары воды с фенолятом и фенолом, выделяющие из гасителя также конденсируются. Выход фенола на стадии плавления 96%. Очистку фенола осуществляют перегонкой в вакууме. 5. Из бензола через циклогексан Процесс включает стадии гидрирования бензола, окисления циклогексана и каталитического дегидрирования продуктов окисления. 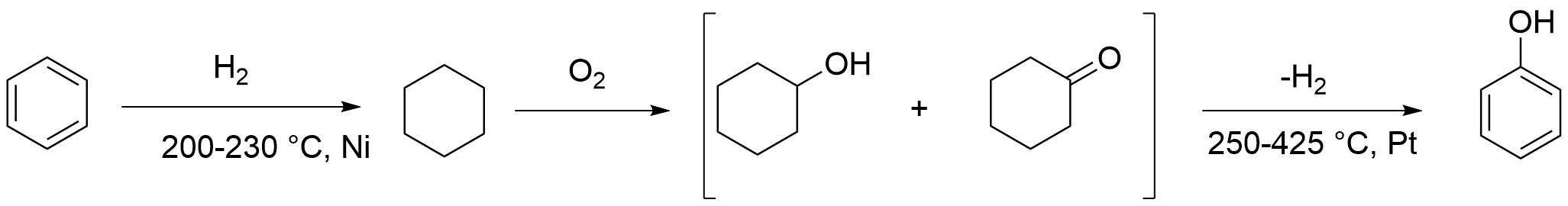 Свежий и рециркулирующий водород смешиваются с бензолом и поступают в реактор гидрирования 1, в котором бензол на 99,9% превращается в циклогексан. Продукты реакции после охлаждения направляются в газосепаратор 2 для отделения рециркулирующего водорода, часть которого выводится из системы для удаления накапливающихся инертных примесей. 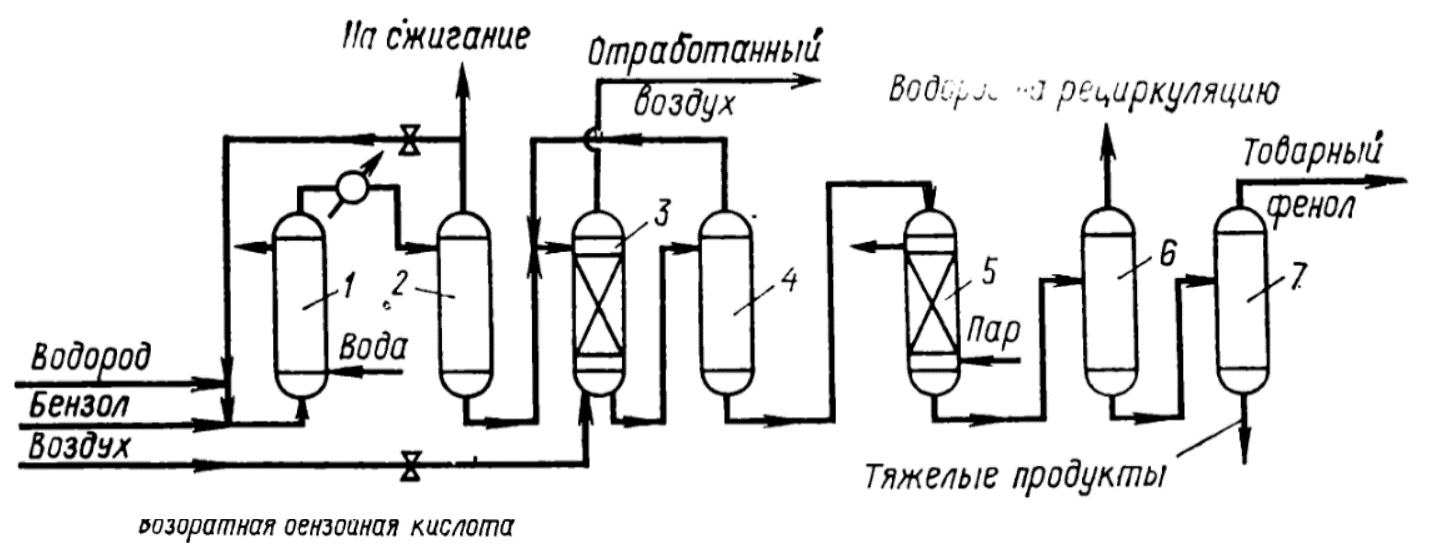 Рис. 6. Схема производства фенола из бензола через циклогексан. 1 – реактор гидрирования; 2,6 – газосепараторы; 3 – реактор окисления; 4 – колонна отгонки циклогексана; 5 – реактор дегидрирования; 7 – колонна товарного фенола. Циклогексан и сжатый воздух подаются в реактор окисления 3, где происходит частичное окисление циклогексана до циклогексанола и циклогексанона. Продукты реакции поступают в реактор дегидрирования 5. Продукты реакции в газосепараторе 6 отделяются от водорода, выделившегося при дегидрировании, и подвергаются ректификации в колонне 7 с выделением товарного фенола. Важной особенностью процесса является возможность производства товарных циклокегсанола и циклогексанола. Вывод по фенолу Сравнение различных методов производства фенола представляет значительные трудности, поскольку каждому процессу присущи свои специфические особенности. Так, экономика кумольного метода в значительной степени зависит от реализации одновременно получаемого ацетона. Процесс Рашига связан с большими капитальными вложениями и рентабелен только при большой мощности установок. Хлорбензольный процесс рентабелен при наличии в структуре завода цеха электролиза образующегося хлористого натрия, что, в свою очередь, требует дешевой электроэнергии. Сравнительная характеристика технико-экономических показателей различных процессов производства фенола приведена в табл. 35. 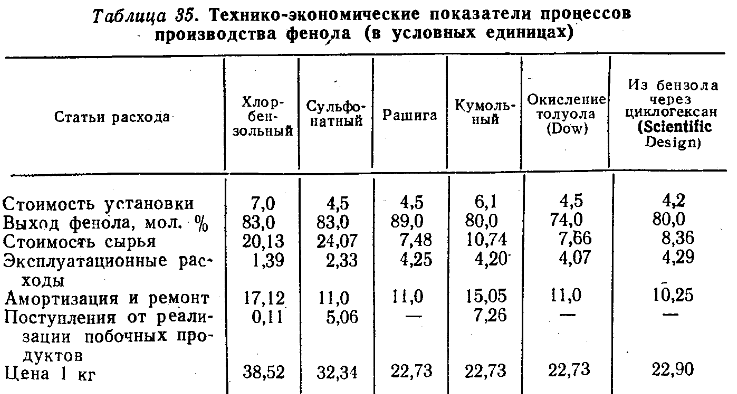 Эти данные показывают, что три нефтехимических процесса (кумольный, из толуола и из бензола) равноценны. С ними конкурирует процесс Рашига. Достаточно популярен метод получения из циклогексана через циклогексанол. Преимущество данного метода заключается в доступности сырья – циклогексана, который стал одним из важнейших полупродуктов основного органического синтеза в связи с получением из него найлона и капролактама. Другие методы, такие как сульфурационный и гидролизом хлорбензола с изобретением кумольного метода стали менее востребованы, а разрабатываемые методы, связанные с прямым окислением бензола еще недостаточно исследованы и не готовы составить конкуренцию кумольному методу. Методы получения анилина1. Непрерывное восстановление нитробензола При непрерывном восстановлении нитробензола используется чугунная стружка, равномерно измельченную и очищенную от примесей и хлорид аммония – активный электролит, обеспечивающий условия влажной коррозии железа. 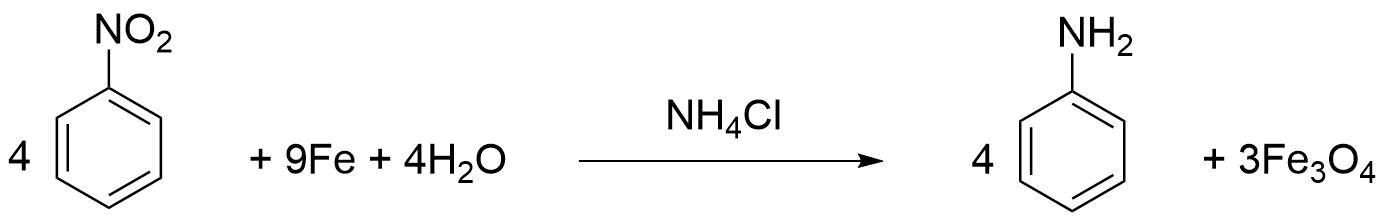 Нитробензол, раствор хлорида аммония и анилиновая вода из напорных емкостей 1, 2, 3 поступают через регулирующие ротаметры 4, 5, 6 в смеситель 7, смешиваются там и нагнетаются под слой чугунной стружки в редуктор 9 через сопла под давлением, создаваемым насосом 8. 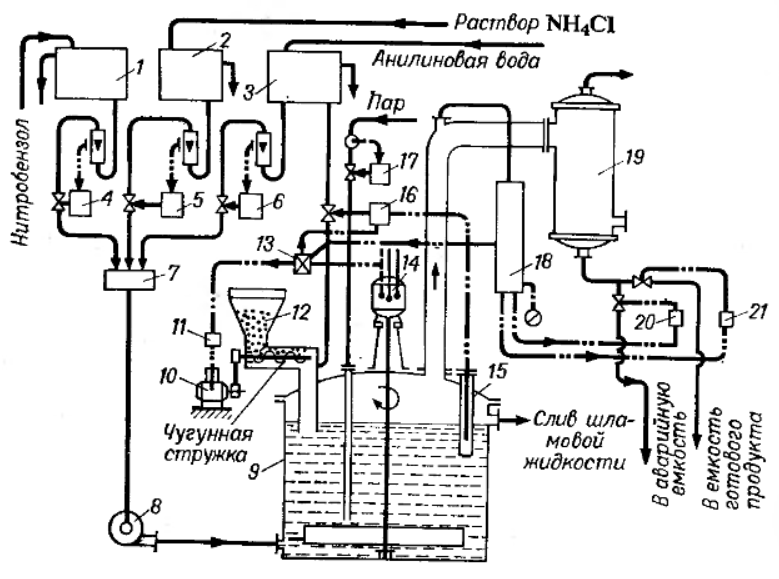 Рис. 3. Схема непрерывного восстановления нитробензола чугунной стружкой. 1, 2, 3 – напорные баки; 4, 5, 6 – регулирующие ротаметры; 7 – смесители; 8 – насос; 9 – редуктор; 10, 14 – двигатели; 11 – регулятор числа оборотов двигателя; 12 – питатель для чугунной стружки; 13 – вычислительное устройство; 15 – датчик прибора для определения магнитной проницаемости реакционной массы; 16 – регулятор расхода анилиновой воды; 17 – регулятор расхода пара; 18 – прибор для определения нитробензола в парах анилина; 19 – конденсатор; 20, 21 – исполнительный механизм, переключающий краны. Основным приемом, обеспечивающим полное превращение нитробензола в анилин в условиях непрерывного процесса, является автоматическое регулирование подачи в редуктор нитробензола, раствора хлорида аммония и анилиновой воды. Чугунная стружка непрерывно подается в редуктор шнековым питателем 10. Электродвигатели питателя 10 и мешалки 14 сбалансированы. При избыточной загрузке редуктора стружкой возрастает расход мощности электродвигателя и в этом случае автоматически временно прекращается подача стружки шнековым питателем. Автоматические приборы регулируют процесс в зависимости от двух факторов: магнитных свойств реакционной массы и содержания нитробензола в парах, отгоняющихся из редуктора. Это самый распространенный метод получения анилина. В качестве восстановителей могут быть использованы самые разнообразные неорганические и органические вещества. Применение в технике нашли соединения, наиболее доступные по цене и удобные для практического использования: металлы (железо, цинк, олово), соли (хлорид олова, сульфиды щелочных металлов, гидросульфиты), сероводород. Кроме того, восстановление можно вести каталитическим или электрохимическим методом. В лабораторной, а в последние годы — и в заводской практике все большее значение приобретает восстановление нитробензола смешанными гидридами металлов: алюмогидридом лития, боргидридом натрия. 2. Восстановление нитробензола в жидкой фазе В условиях периодического жидкофазного процесса нитросоединение, смешанное с твердым катализатором, обрабатывают водородом под давлением до прекращения поглощения последнего. После отстаивания образовавшегося амина его сифонируют и очищают от катализатора. Через несколько циклов катализатор отфильтровывают и регенерируют. Гидрирование проводят при энергичном перемешивании реакционной массы для равномерного распределения катализатора по всему объему. 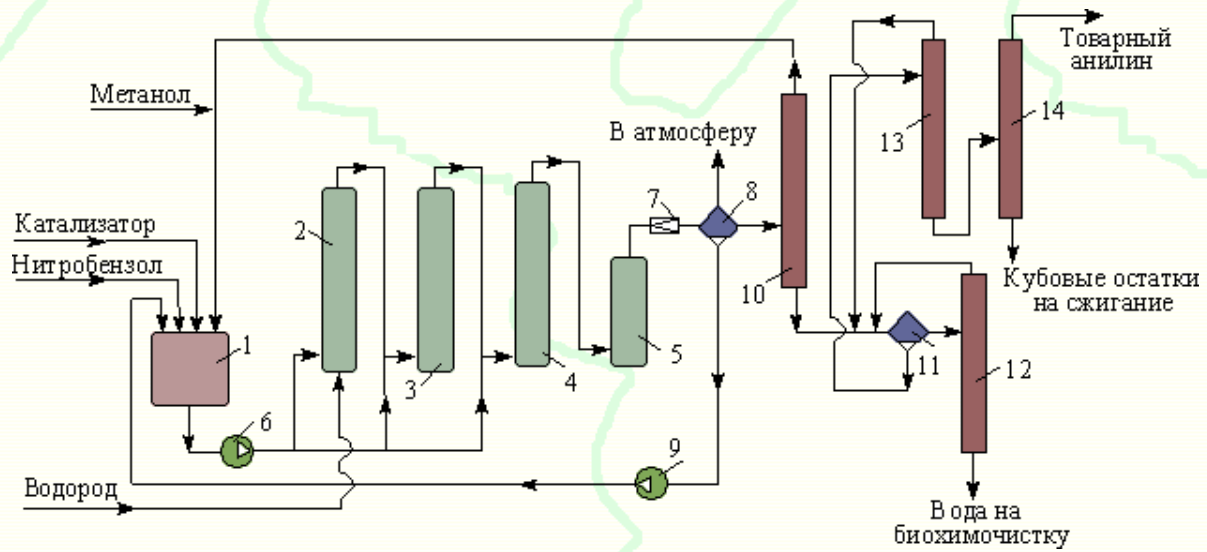 Рис. 2. Схема восстановления нитробензола в жидкой фазе в присутствии растворителя 1 – смеситель; 2-5 – реакторы; 6,9 – насосы; 7 – дросселирующий клапан; 8, 11 – сепараторы; 10, 12-14 – ректификационные колонны Нитробензол, растворитель например метанол, и катализатор – никель Ренея смешивают в аппарате 1 и подают в систему реакторов 2–5, одновременно подавая в реакторы водород. В реакторе 5, меньшем по размеру, происходит окончательное восстановление нитробензола. Давление в системе 15–20 МПа. Из сепаратора 8 часть катализаторной суспензии в метанольном растворе анилина насосом 9 направляют на рециркуляцию через смеситель 1. Основное количество реакционной смеси после отстаивания направляют в ректификационную колонну 10, где отгоняют метанол. После этого кубовую жидкость расслаивают в сепараторе 11 на водный и анилиновый слои. Водный слой поступает в колонну 12, а в колонне 13 отгоняется вода из органического слоя. Водная фракция направляется обратно в сепаратор 11, а органический слой в колонну 14, где в виде дистиллята отгоняют товарный анилин, а кубовые остатки отправляют на сжигание. Выход анилина составляет 99%. 3. Аммонолиз фенола При действии на фенол аммиаком гидроксигруппа замещается на аминогруппу. Эта реакция требует достаточно жестких условий: при пропускании паров фенола и аммиака над катализатором при 425 °С выход анилина составляет 88%. 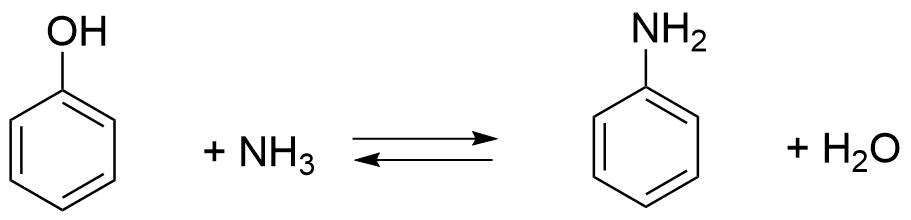 Несмотря на то, что реакция аминирования фенола известна давно, в промышленности этот способ долгое время не был реализован в основном из-за проблем, связанных с созданием экономичного катализатора, защитой аппаратуры от коррозии и повышением качества готового продукта. Промышленный процесс получения анилина из фенола состоит из следующих основных стадий: 1) аминирование фенола в газовой фазе в присутствии катализатора; 2) отделение избытка аммиака от продуктов реакции и возврат аммиака в реактор; 3) отделение воды от продуктов реакции; 4) разделение анилина и фенола и возврат фенола в реактор. 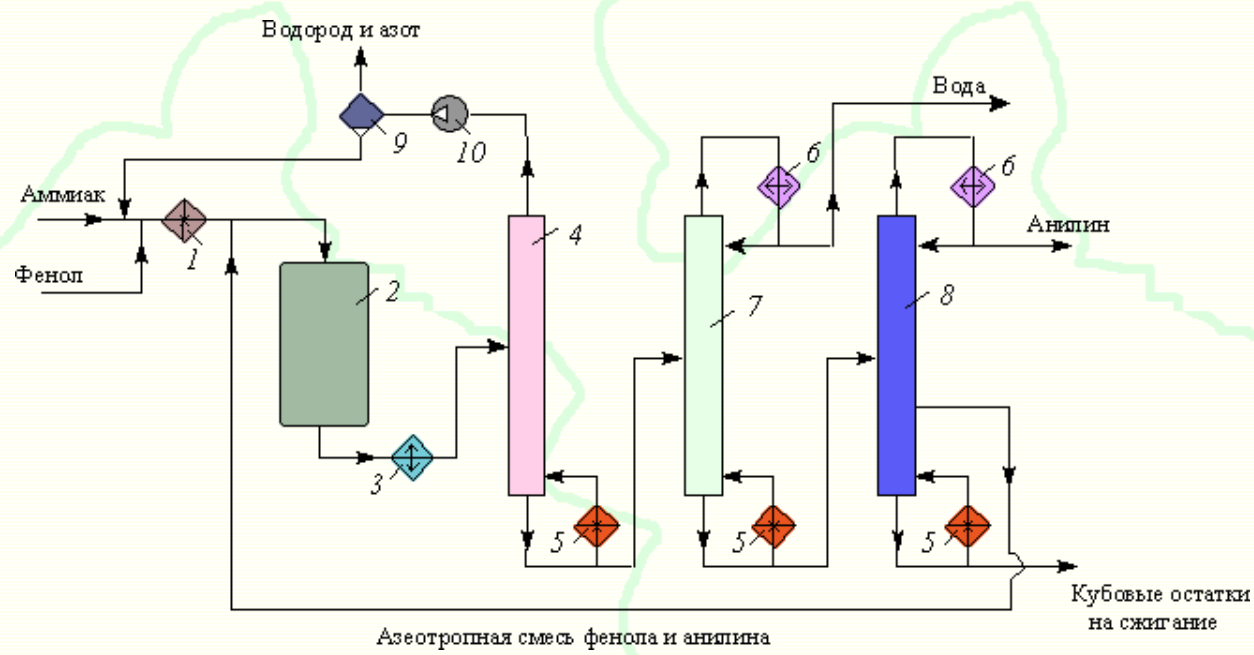 Рис. 4. Схема аммонолиза фенола. 1— смеситель; 2 — реактор; 3 — холодильник; 4 — колонна для отгонки аммиака; 5 — кипятильники; 6 — дефлегматоры; 7 — осушительная колонна; 8 — колонна выделения анилина; 9 — сепаратор; 10 — компрессор. Фенол и жидкий аммиак испаряют частично за счет утилизации теплоты реакции, а частично за счет тепла, подводимого в смеситель 1, и подают в адиабатический трубчатый реактор 2 с неподвижным слоем катализатора. В этот же реактор подают смесь фенола и анилина со стадии выделения азеотропной смеси. Проходя через слой катализатора, фенол, реагируя с аммиаком, превращается в анилин. Процесс проводят при 300–400 °С и давлении 1 МПа. Соотношение фенола и аммиака от 1 : 5 до 1 : 20. Степень превращения фенола 98–99 %. Продукты реакции частично конденсируются в теплообменнике 3. Жидкую фазу, состоящую в основном из анилина и растворенного аммиака, отделяют и подают в систему ректификационных колонн. В колонне 4 отгоняют аммиак, который возвращается в реактор 2 компрессором 10, некоторое количество аммиака при этом диссоциирует на водород и азот. По мере накопления примесей циркулирующий аммиак сбрасывают в систему очистки отходящих газов. Кубовая жидкость колонны 4 поступает в осушительную колонну 7, в которой отгоняют реакционную воду, а затем в колонну 8. Из колонны 8 анилин отгоняют в виде дистиллята, а с нижних тарелок колонны отбирают азеотропную смесь фенола и анилина, которую возвращают в реактор 2. Из куба колонны 8 выводят остатки, содержащие дифениламин, и направляют их на сжигание. Разделение фенола и анилина для увеличения их относительной летучести проводят в вакууме. Полученный анилин не нуждается в дополнительной очистке. 4. Аммонолиз бензойной кислоты В начале 1970-х гг. была разработана технология получения анилина аммонолизом бензойной кислоты, синтезированной путем жидкофазного окисления толуола в присутствии солей кобальта 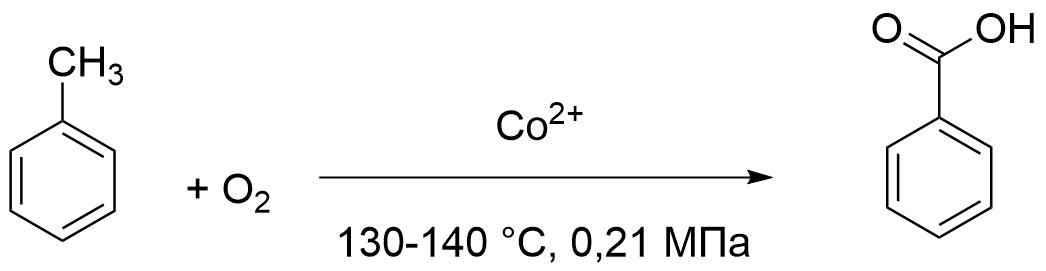 При действии на бензойную кислоту водным раствором аммиака в присутствии оксида меди(II) при 215–220 °С и 3,5–4,2 МПа образуется анилин. 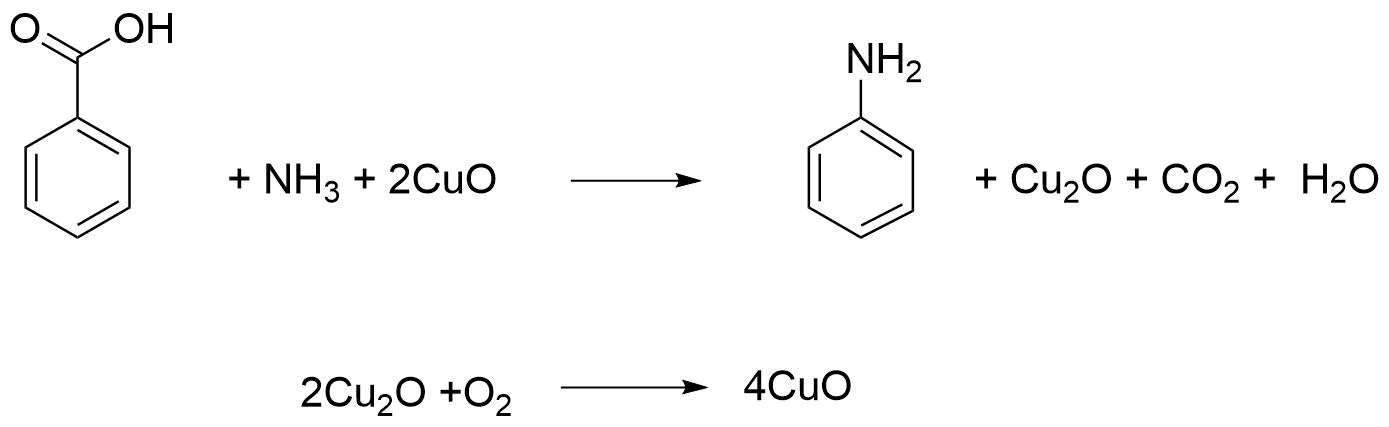 Процесс начинается с приготовления суспензии катализатора в толуоле в аппарате 1, снабженном мешалкой. Катализатором обычно служит нафтенат кобальта. Суспензию направляют в реактор 2, в нижнюю часть которого подают воздух. Окисление толуола проводят при 130‑140 °С и 0,21–0,22 МПа. Так как реакция окисления сопровождается большим экзотермическим эффектом, необходимо постоянно отводить тепло. Степень конверсии толуола в бензойную кислоту 30–40%. 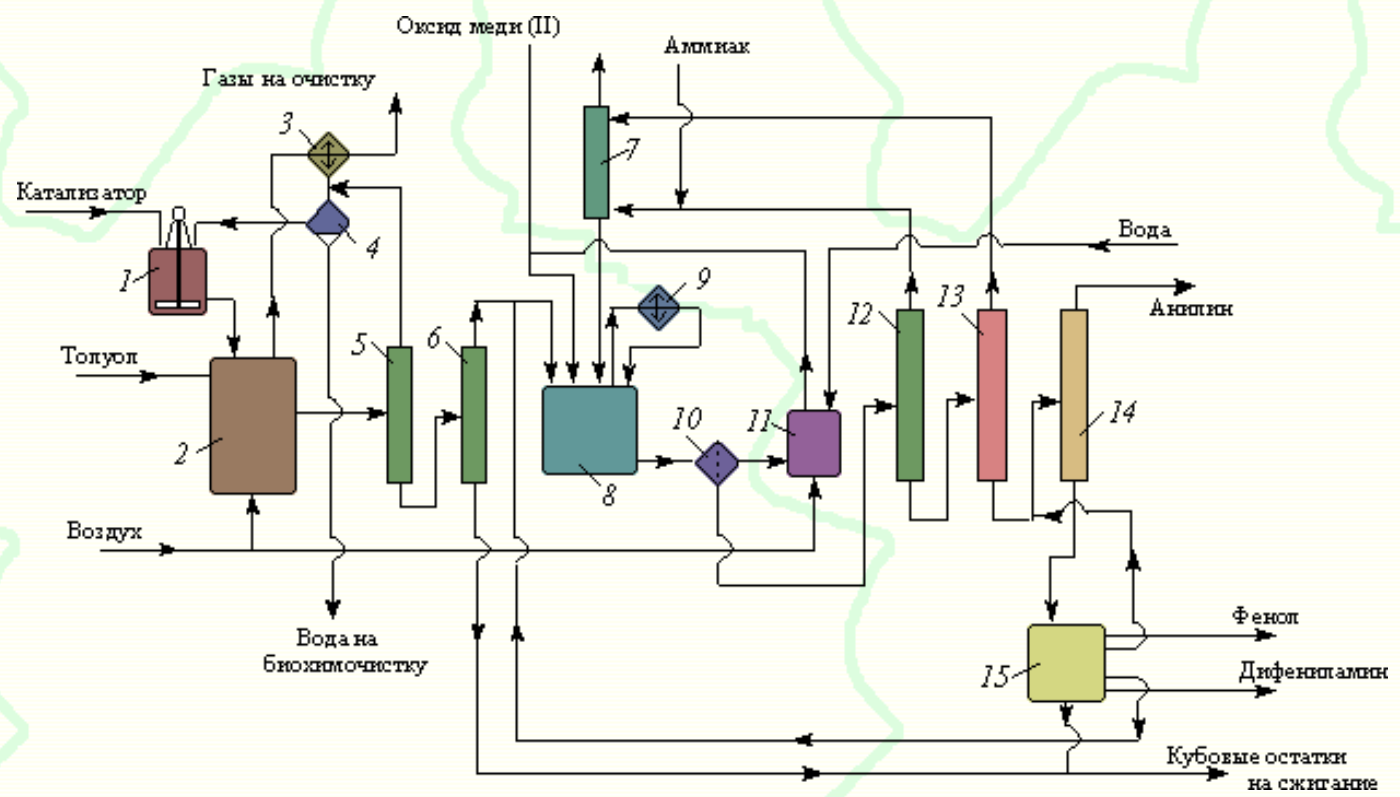 Рис. 4. Схема получения анилина из толуола. 1 – аппарат для приготовления суспензии катализатора; 2 – реактор окисления толуола; 3 – конденсатор; 4 – сепаратор; 5, 6, 12 – отгонные колонны; 7 – абсорбер; 8 – реактор аммонолиза; 9 – обратный холодильник; 10 – фильтр; 11 – реактор окисления Cu2O; 13 – колонна осушки анилина; 14 – колонна дистилляции товарного анилина; 15 – аппарат для разделения реакционной смеси. Выходящие из реактора 2 газы направляются в конденсатор 3, в котором конденсируются органические продукты, унесенные отработанным воздухом. Из конденсатора конденсат направляется в жидкостный сепаратор 4 для расслоения на водный и органический слои. Органическую фазу, богатую толуолом, возвращают в реактор, а водную направляют на биохимическую очистку. Газы, выходящие из конденсатора 3, очищаются в угольных адсорберах, где улавливается большая часть органических примесей. Для десорбции уловленных продуктов через адсорберы продувают водяной пар. Полученную смесь расслаивают. Органический слой, содержащий толуол, возвращают в реактор, а воду направляют на биохимическую очистку. Реакционная масса из реактора 2 после отделения катализатора фильтрованием поступает в отгонную колонну 5, работающую при атмосферном давлении. Дистиллятом является толуол, возвращаемый в реактор. Кубовая жидкость поступает в вакуум-отгонную колонну 6, в которой бензойная кислота отделяется от высококипящих примесей. Бензойная кислота в расплавленном состоянии направляется на стадию аммонолиза для получения анилина. В абсорбере 7 готовят водный раствор аммиака. Бензойную кислоту, суспензию оксида меди(II) и аммиачную воду подают в реактор 8, снабженный мешалкой и обратным холодильником. Мольное соотношение бензойной кислоты, воды, аммиака и оксида меди составляет 1,5 : 1,8 : 3,4 : 1. Хотя вода и не участвует в реакции, показано, что ее избыток тормозит образование промежуточного соединения — бензамида. Осадок с фильтра 10поступает в реактор 10 для окисления образовавшегося Cu2O в CuO. Реакция протекает в среде аммиака. В нижнюю часть реактора подают воздух, и там при обычной температуре и атмосферном давлении протекает эндотермическая реакция с полным превращением Cu2O в CuO. Суспензия CuO из реактора 11 возвращается в реактор 8. Из фильтрата в колонне 12 десорбируют аммиак, который улавливают в абсорбере 7и возвращают в реакцию. В колонне 13удаляют воду и возвращают ее на стадию абсорбции аммиака. Небольшая часть воды используется для промывки CuO на фильтрах. В колонне 14при пониженном давлении отгоняют анилин. Из куба колонны 15 при более глубоком вакууме выделяют некоторое количество фенола, анилина, а также бензойную кислоту, возвращаемую в реактор 8, и дифениламин. Кубовые остатки направляют на сжигание. Суммарный выход анилина в расчете на толуол составляет 79,2%. 5. Восстановление нитробензола в паровой фазе Каталитическое восстановление нитросоединений водородом имеет большое значение в производстве анилина. В качестве катализатора обычно используется медь на носителе – силикате натрия или пемзе, но также могут быть использованы и такие металлы как Ni, Al, Mo, V, Cd и их соединения 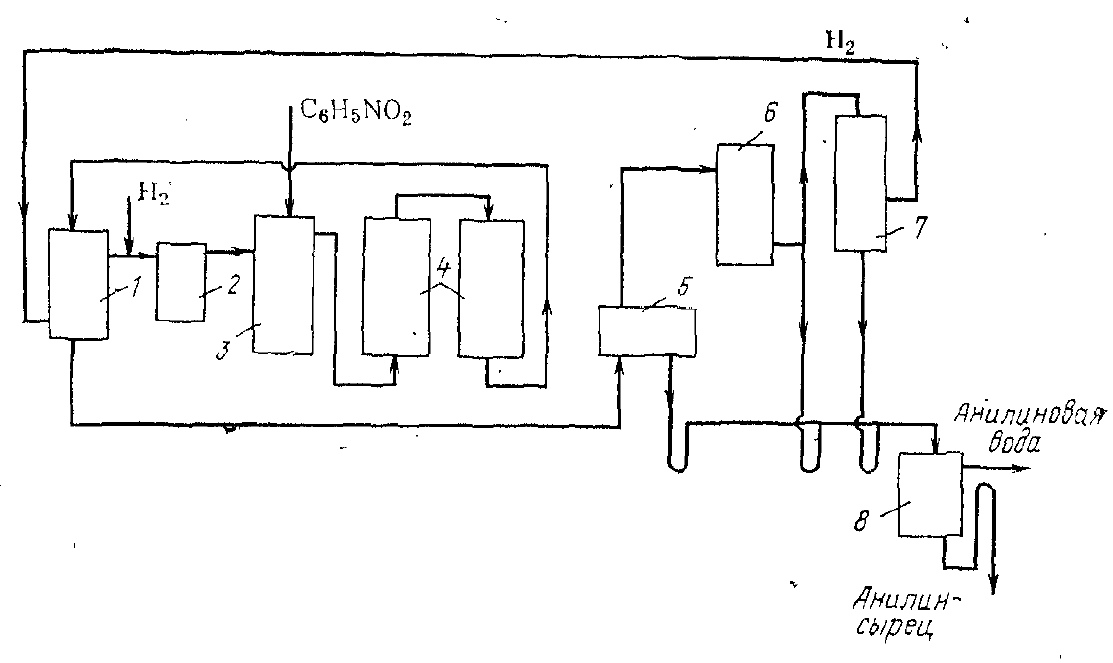 Рис. 1. Схема каталитического восстановления нитробензола 1,2 – теплообменники, 3 – испаритель, 4 – контактные аппараты, 5, 6 – холодильники‑конденсаторы; фазоразделитель; 8 – отстойник-сепаратор. Нитробензол подают в испаритель 3, где он испаряется в токе горячего водорода, нагретого при прохождении через теплообменники 1, 2. Смесь паров нитробензола и водорода с температурой 170 °C поступает в контактные аппараты 4, где происходит восстановление и откуда контактные газы, нагретые за счет тепла реакции до 350-370 °C проходят через теплообменник 1, нагревая водород. Затем контактные газы проходят через холодильник-конденсатор 5, где конденсируются пары анилина и воды. Для полного улавливания анилина и отделения циркулирующего водорода газы проходят холодильник конденсатор 6 и фазоразделитель 7. Избыток водорода из фазоразделителя 7 возвращается вновь в процесс, а конденсат стекает в отстойник сепаратор 8. Из отстойника-сепаратора 8 анилин подают на вакуум-перегонку, а «анилиновую воду» на экстракцию нитробензолом. Выход анилина 98% от теоретического. Также могут использоваться кожухотрубные контактные аппараты, в трубки которых загружают катализатор. В этом случае регулирование температуры и отвод тепла обеспечивается высококипящим органическим теплоносителем, которым заполняют межтрубное пространство. Вывод по анилину Исходя из указанных методов и их достоинств и недостатков можно сделать вывод о том, что каталитическое восстановление нитробензола в парах является оптимальным методом получения анилина, т.к. имеет достаточную простую технологию и возможность ее автоматизации, высокую скорость реакции и качество получаемого анилина. Поэтому этот метод и является основным методом производства анилина в мире. В лабораторной практике чаще используется метод восстановления нитробензола активным металлом – например цинков в кислой или щелочной среде. Список литературыЧекалин М. А., Пассет Б. В., Иоффе Б. А. Технология органических красителей и промежуточных продуктов 2-е изд., перераб. – Л.: Химия, 1980. 472 с. Адельсон С. В., Вишнякова Т. П., Паушкин Я. М. Технология нефтехимического синтеза: Учеб. для вузов. 2-е изд., перераб. – М.: «Химия», 1985. – 608 с., илл. Беркман Б. Е. Промышленный синтез ароматических нитросоединений и аминов. - М.: "Химия", 1964. - 344 с. Харламович Г. Д., Чуркин Ю. В. Фенолы. М., «Химия», 1974. https://vuzlit.com/721825/parofaznyy_kataliticheskiy_gidroliz_hlorbenzola_metod_rashiga Лисицы В.Н. Химия и технология промежуточных продуктов. - М.: Химия, 1987. - 368 с. Бардик Д.Л., Леффлера У.Л. Нефтехимия. - М.: ЗАО "Олимп-Бизнес", 2001. - 416 с. https://www.newchemistry.ru/printletter.php?n_id=2464 https://mplast.by/encyklopedia/fenol-gidroksibenzol-karbolovaya-kislota/ https://www.chem21.info/info/62117/ https://studopedia.ru/21_14746_poisk-novih-putey-sinteza-fenola.html https://studfile.net/preview/3718745/page:14/ |
