методы фармакопейного анализа. мфа 1 итоговая. Фармацевтический анализ
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Фармацевтический анализ, его особенности и критерии Фармацевтический анализ – направление фармацевтической химии, основной задачей которого является оценка качества лекарственных средств (ЛС) на всех этапах жизненного цикла от создания и регистрации ЛС до их применения и утилизации непригодных по тем или иным причинам к медицинскому использованию. Фармацевтический анализ имеет свои специфические особенности, отличающие его от других видов анализа. Эти особенности заключаются в том, что: анализу подвергают вещества различной химической природы: неорганические, элементорганические, радиоактивные, органические соединения от простых алифатических до сложных природных биологически активных веществ; чрезвычайно широк диапазон концентраций анализируемых веществ; объектами фармацевтического анализа являются не только индивидуальные лекарственные вещества, но и смеси, содержащие различное число компонентов. КРИТЕРИИ ФАРМАЦЕВТИЧЕСКОГО АНАЛИЗА На различных этапах фармацевтического анализа в зависимости от поставленных задач имеют значение такие критерии, как: избирательность, чувствительность, точность, время, затраченное на выполнение анализа, израсходованное количество анализируемого препарата (лекарственной формы). Избирательность метода очень важна при проведении анализа смесей веществ, поскольку дает возможность получать истинные значения каждого из компонентов. Только избирательные методики анализа позволяют определять содержание основного компонента в присутствии продуктов разложения и других примесей. Требования к точности и чувствительности фармацевтического анализа зависят от объекта и цели исследования. При испытании степени чистоты препарата используют методики, отличающиеся высокой чувствительностью, позволяющие устанавливать минимальное содержание примесей. При выполнении постадийного контроля производства, а также при проведении экспресс-анализа в условиях аптеки важную роль имеет фактор времени, которое затрачивается на выполнение анализа. Для этого выбирают методы, позволяющие провести анализ в наиболее короткие промежутки времени и вместе с тем с достаточной точностью. При количественном определении лекарственного вещества используют метод, отличающийся избирательностью и высокой точностью. Чувствительностью метода пренебрегают, учитывая возможность выполнения анализа с большой навеской препарата. Мерой чувствительности реакции является предел обнаружения. Он означает наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью. На чувствительность качественных реакций оказывают влияние такие факторы, как объемы растворов реагирующих компонентов, концентрации реактивов, рН среды, температура, продолжительность опыта. Это следует учитывать при разработке методик качественного фармацевтического анализа. Высокой чувствительностью отличаются физико-химические методы анализа. Наиболее высокочувствительны радиохимические и масс-спектральный методы, полярографические и флуориметрические. Термин "точность анализа" включает одновременно два понятия: воспроизводимость и правильность полученных результатов. Воспроизводимость – характеризует рассеяние результатов анализа по сравнению со средним значением. Правильность отражает разность между действительным и найденным содержанием вещества. Точность анализа у каждого метода различна и зависит от многих факторов: калибровки измерительных приборов, точности отвешивания или отмеривания, опытности аналитика и т.д. Точность результата анализа не может быть выше, чем точность наименее точного измерения. Так, при вычислении результатов титриметрических определений наименее точная цифра – количество миллилитров титранта, израсходованного на титрование. Погрешность допускается также при взятии навески. К фармацевтическому анализу предъявляют высокие требования. Он должен быть достаточно специфичен и чувствителен, точен по отношению к нормативам, обусловленным ГФ XI, ВФС, ФС и другой НТД, выполняться в короткие промежутки времени с использованием минимальных количеств испытуемых лекарственных препаратов и реактивов. Формы контроля фармацевтического анализа. Фармакопейный анализ. Относительные показатели качества ЛВ. Целью исследования лекарственных веществ является установление пригодности лекарственного средства для медицинского применения, т.е. соответствия его нормативному документу на данный препарат. Фармацевтический анализ в зависимости от поставленных задач включает различные формы контроля качества лекарств: фармакопейный анализ, постадийный контроль производства лекарственных средств, анализ лекарственных форм индивидуального изготовления, экспресс-анализ в условиях аптеки и биофармацевтический анализ. Оригинальная Фармакопейная Статья включает комплекс испытаний лекарственного вещества, который состоит из четырех блоков: 1. Определение относительных показателей качества (внешний вид (описание), растворимости, прозрачности, цветности, кислотности– щелочности, и др.). 2. Испытание на подлинность. 3. Испытание на чистоту. 4. Количественное определение. ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНЫХ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ Внешний вид В соответствии со структурой ФС анализ лекарственного вещества начинается с описания его внешнего вида, при этом указывается: агрегатное состояние (твердое вещество, жидкость, газ), порошки аморфные или кристаллические, цвет, запах; гигроскопичность или свойство выветриваться в сухом воздухе; устойчивость к воздействию света, кислорода воздуха; летучесть, подвижность, воспламеняемость (для жидкостей). Изменение внешнего вида лекарственных средств может проходить под влиянием различных факторов окружающей среды (свет, влага, пониженная или повышенная температура, кислород, диоксид углерода, сухой воздух, пыль), при этом наблюдается изменение цвета, выпадение осадков в растворах, что свидетельствует о возможном прохождении химических реакций. Цвет Большинство лекарственных веществ – это белые кристаллические или мелкокристаллические порошки. Ряд лекарственных веществ имеет окраску: синюю (меди сульфат), серовато-черную с металлическим блеском (йод), темно- или красно-фиолетовую (калия перманганат). По окраске лекарственного вещества можно предположительно судить о подлинности и чистоте. Например, меди сульфат – синий кристаллический порошок, а при выветривании кристаллизационной воды на его поверхности появляются белые вкрапления. Запах Некоторые лекарственные вещества имеют специфический запах, по которому их можно предварительно идентифицировать (ментол, фенол, камфора, тимол, эфир медицинский, валидол, метионин, тиамина хлорид и бромид, формальдегид). Растворимость Растворимость является важным показателем качества лекарственного вещества. Как правило, в НД приводится некоторый перечень растворителей, наиболее полно характеризующий это физическое свойство с тем, чтобы в дальнейшем оно могло быть использовано для оценки качества на том или ином этапе исследования этого лекарственного вещества. Так, растворимость в кислотах и щелочах характерна для амфотерных соединений (цинка оксид), Изменение растворимости указывает на присутствие или появление при хранении менее растворимых примесей, что характеризует изменение его качества. Растворимость вещества при постоянной температуре и давлении является одним из параметров, по которому устанавливают подлинность и доброкачественность практически всех лекарственных средств выражают в условных терминах растворимости. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение одного грамма лекарственного вещества. Прозрачность и цветность При оценке качества ряда лекарственных средств предусматривается определение прозрачности, бесцветности, степени мутности или окраски их растворов. Растворы сравнивают с соответствующими эталонами мутности и цветности. Прозрачным считается раствор, в котором прозрачность не отличается от воды, а при испытании иных растворов от взятого растворителя, или не должна превышать мутность эталона Раствор сравнивают невооруженным глазом с растворителем, взятым для приготовления данной жидкости при освещении матовой электрической лампой (40 Вт), просматривая растворы перпендикулярно вертикальной оси пробирок на черном фоне через 5 минут после приготовления эталона. Бесцветными считают жидкости, не отличающиеся по цвету от воды, а при испытании иных растворов – от взятого растворителя или не должна быть окрашена более интенсивно, чем эталонный раствор Кислотность и щелочности или определение рН Определение кислотности и щелочности лекарственных средств осуществляется несколькими способами: по изменению окраски индикатора титрованием путем определения значения величины рН. Индикаторы, как известно, являются электролитами, существующими в двух таутомерных формах. В зависимости от концентрации водородных ионов (значении рН среды) преобладает одна из этих форм, обусловливающая определенную окраску раствора. Для ряда лекарственных средств (и обязательно для всех инъекционных растворов) НД предусматривается определение величины рН. Обычно в частных статьях указан интервал значений величины рН. Несоответствие препарата НД по величине рН может быть следствием наличия примесей более кислого или основного характера, чем само лекарственное вещество. Подобные примеси могут появиться при хранении лекарственных средств. Например, вследствие гидролиза растворов, под влиянием щелочности стекла, при взаимодействии с диоксидом углерода воздуха и т. д. Летучие вещества и вода Летучие вещества могут попасть в лекарственные средства либо вследствие недостаточной очистки от растворителей и промежуточных продуктов в процессе получения либо в результате накопления продуктов разложения. Вода в лекарственных веществах может содержаться в виде капиллярной, абсорбционно-связанной, химически связанной (гидратной и кристаллогидратной) или свободной. В ГФ включены два метода определения летучих веществ. Выбор метода определяется задачами исследования и физико-химическими свойствами лекарственных средств. 8 Метод высушивания; Метод применяют для определения потери в массе при высушивании, которая может происходить за счет влаги и некоторых летучих веществ (эфирных масел, летучих кислот, аминов, диоксида углерода и др.). Метод высушивания заключается в установлении разности массы вещества до и после высушивания. Образец сушат до постоянной массы при определенной температуре. Условия и температура процесса высушивания указываются в соответствующих частных статьях. Метод дистилляции Этим методом определяют содержание воды в жидкостях. Метод основан на физическом свойстве паров двух несмешивающихся жидкостей перегоняться при более низкой температуре, чем каждая из них в отдельности. Плотность Определение плотности проводят с помощью пикнометра: Стандартный пикнометр представляет собой небольшой стеклянный сосуд с горлышком и крышкой-колпачком. В верхней части прибора находится метка. Пикнометр можно использовать для определения показателя плотности различных веществ, в том числе и жидкостей. Определение плотности проводят с помощью ареометра. Ареометр представляет собой стеклянный, тонкостенный, цилиндрический сосуд, расширяющийся внизу и имеющий на конце стеклянный резервуар, заполненный дробью, реже ртутью. В верхней части ареометра имеется шкала с делениями, соответствующими плотности жидкости, и указанием температуры, при которой следует производить определение. Имеются ареометры для жидкостей легче и тяжелее воды, для серной кислоты, едких щелочей, а также ряд специальных ареометров для измерения плотности спирта (спиртометр). Испытание лекарственных веществ на подлинность. Для целей идентификации используют реакции, которые сопровождаются внешним эффектом, например: выпадением или растворением осадков. изменением окраски раствора, выделением газообразных продуктов, Установление подлинности неорганических лекарственных веществ заключается в обнаружении с помощью химических реакций катионов и анионов, входящих в состав молекул. Химические реакции, применяемые для идентификации органических лекарственных веществ, основаны на использовании функционального анализа. Реакции осаждения широко используют в качественном и количественном химическом анализе. Классическим примером выпадения осадка в результате химической реакции является выпадение нерастворимых галогенидов серебра при взаимодействии растворов солей серебра с хлорид-ионом, при этом, образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте, растворимый в растворах аммиака и карбоната аммония с образованием хлорида диамминсеребра. Ag + Cl AgCl Наиболее часто в неорганическом анализе, используют реакции комплексообразования. Соли висмута с иодидами щелочных металлов образуют черный осадок, растворимый в избытке реактива с образованием раствора оранжево-желтого цвета, содержащего тетрайодовисмутаты общей формулы Ме[BiJ4] Реакции окисления: Аммиачный раствор соли серебра (диамминсеребра гидроксид) вступает в реакцию с альдегидами, восстанавливающими серебро до металического, образующего налет на стенках пробирки (реакция серебрянного зеркала). Реакции нейтрализации и разложения: При действии на карбонаты и гидрокарбонаты кислот выделяются пузырьки углекислого газа вследствие разложения выделяющейся нестойкой угольной кислоты. Реакции прокаливания: При прокаливании пятиводного гидрата сульфата меди (медного купороса) меняется цвет кристаллов за счёт потери кристаллизационной воды от синего до грязно-белого. Испытание лекарственных веществ на чистоту. Оценка степени чистоты лекарственного препарата — один из важных этапов фармакопейного анализа. Все лекарственные препараты независимо от способа получения испытывают на чистоту. Для обеспечения качества фармацевтической субстанции, а также готовых лекарственных средств, во время процесса разработки, оптимизации и смены процесса, необходимо тщательно контролировать один из его важнейших показателей – примеси. Различные факторы влияющие на наличие примесей в лекарственном средстве: 1. Технологические факторы: степень чистоты исходных продуктов, температурный режим, давление, рН среды, растворители, режим и температура сушки, - все эти факторы могут привести к появлению примесей, которые накапливаются от одной стадии к другой. 2. Вторая группа факторов, влияющих на чистоту – это нарушение условий и длительности хранения, сушки, измельчений, транспортировки. 3. Третья группа факторов – запыленность и загазованность производственных помещений химико-фармацевтических предприятий. (перекрестное загрязнение). 4. Четвертая группа факторов – загрязненность ЛВ, получаемых из растительного сырья сопутствцющими природными соединениями. Таким образом, все факторы загрязнения делятся на «технологические» (1 и 4 ч.) и «приобретенные» (2. 3.). Все примеси можно разделить на две группы: примеси, оказывающие влияние на фармакологическое действие лекарственного препарата, и примеси, указывающие на степень очистки вещества. Последние не влияют на фармакологический эффект,, но присутствие их в больших количествах снижает концентрацию и соответственно уменьшает активность препарата. Поэтому фармакопеи устанавливают определенные пределы этих примесей в лекарственных препаратах. Таким образом, основным критерием доброкачественности лекарственного препарата являются наличие допустимых пределов физиологически неактивных примесей и отсутствие токсичных примесей. Понятие отсутствие условно и связано с чувствительностью способа испытания. Общие требования, которые предъявляются к испытаниям на чистоту, — чувствительность, специфичность и воспроизводимость используемой реакции, а также пригодность ее применения для установления допустимых пределов содержания примесей. Определить максимальное содержание примесей в испытуемом препарате можно двумя путями (эталонным и безэталонным). Один из них основан на сравнении с эталонным раствором (стандартом). При этом в одинаковых условиях наблюдают окраску или помутнение, возникающие под действием какого-либо реактива. Второй путь — установление предела содержания примесей по отсутствию положительной реакции. При этом используют химические реакции, чувствительность которых ниже, чем предел обнаружения допустимых примесей. Количественное определение лекарственных веществ. Количественные методы химического анализа подразделяют на гравиметрический, титриметрический, газометрический анализ и количественный элементный анализ. Гравиметрический (весовой) метод Гравиметрический метод основан на взвешивании осажденного вещества в виде малорастворимого соединения или отгонки органических растворителей после извлечения лекарственного вещества. Метод точен, но длителен, так как предусматривает такие операции, как фильтрование, промывание, высушивание (или прокаливание) до постоянной массы. Из неорганических лекарственных веществ гравиметрическим методом можно определять сульфаты, переводя их в нерастворимые соли бария, и силикаты, предварительно прокаливая до диоксида кремния. Титриметрические (объемные) методы Титриметрический метод анализа получил широкое распространение потому, что он позволяет использовать разнообразные химические реакции и определять вещества, учитывая их свойства и строение. Он выполняется быстро, с большой степенью точности, не нуждается в сложном оснащении и может использоваться как в лабораториях, так и в аптеках. Для количественного определения лекарственного вещества титриметрическим методом необходимы титрованный (стандартный) раствор, набор простой лабораторной посуды (бюретки, пипетки, мерные колбы колбы для титрования), средств фиксации точки эквивалентности (конечной точки титрования). К реакциям, используемым в титриметрическом методе, предъявляются следующие требования: возможность фиксировать точку эквивалентности (конечную точку титрования); количественное протекание реакции, т. е. в реакцию должно вступить 100 % анализируемого вещества. Для этого необходимо строго соблюдать определенные условия титрования: реакция должна протекать быстро; не допускаются побочные реакции. В зависимости от типа реакции, положенной в основу титрования, различают; кислотно-основное титрование; осадительное титрование; комплексиметрическое титрование; комплексонометрическое титрование; окислительно-восстановительное титрование. Кислотно-основное титрование осуществляется в воде и в неводных средах. Данный метод используется в 40 процентах методик, применяющихся для анализа лекарственных веществ. Им определяют концентрацию кислот, оснований, солей. В основе титрования лежит реакция взаимодействия протонов с гидроксид-ионами: Н3О + + ОН- = 2Н2О. Титрованными (стандартными растворами являются растворы сильных кислот и сильных оснований. В процессе титрования изменяется рН системы. В зависимости от свойств определяемого вещества точка эквивалентности при титровании в воде может соответствовать различным величинам рН: Очевидно важно подобрать индикатор таким образом, чтобы величина рН в точке эквивалентности находилась в интервале перехода окраски выбранного индикатора. В качестве индикаторов служат красители, изменяющие окраску в широком интервале рН от 1,2 до 10,5. Наиболее часто используются индикаторы: метиловый оранжевый (3,1—4,4); метиловый красный (4,8—6,0); фенолфталеин (8,2—10,0); тимол-фталеин (9,4—10,6). Осадительное титрование В основу метода положена реакция образования малорастворимого соединения. В фармацевтическом анализе широко используют аргентометрию, которая предполагает взаимодействие галогенов с нитратом серебра: МеНаl + АgNО3 → АgНаl↓ + МеNO3 . Применяется метод в виде прямого (методы Мора, Фаянса) и обратного титрования (метод Фольгарда) Титрантами являются растворы нитрата серебра и тиоцианата аммония. По методу Мора титрование раствором нитрата серебра выполняют в присутствии водного раствора хромата калия в качестве индикатора. В процессе титрования образуются малорастворимые галогениды серебра, и, когда и осаждение закончится полностью, образуется красный осадок хромата серебра, свидетельствующий о достижении точки эквивалентности: К2 СrО4 , + 2АgNO3 → Ag2 СrО4 ↓ + 2КNO3 Этим методом определяют концентрацию хлоридов и бромидов Метод Фаянса применяется для определения концентрации йодидов, но он может использоваться также для хлоридов и бромидов. В отличие от метода Мора, титрование выполняется не только в нейтральной среде, но и в среде уксусной кислоты с водным раствором эозината натрия в качестве индикатора. В точке эквивалентности наблюдается появление яркорозового окрашивания осадка. Хлориды и бромиды титруют в среде уксусной кислоты, индикатором служит раствор бром-фенолового синего. В точке эквивалентности зеленовато-желтое окрашивание переходит в сине-фиолетовое. Метод Фольгарда используется для определения концентрации хлоридов, бромидов, йодидов способом обратного титрования. Индикатором является раствор железоаммониевых квасцов. Анализ производится в среде азотной кислоты. К отобранному для определения концентрации раствора кислоты, 10 капель раствора железоаммониевых квасцов и титруют раствором тиоцианата аммония до появления розовой окраски: АgNО3 + NН4 SCN → AgSСN↓ + NH4 NO3 , 3NН4 SCN + FeNH4 (SO4 )2 → [Fe(SCN)3 ] + 2(NH4 )2 SO4 Комплексиметрический метод Метод основан на образовании комплексного соединения. Меркуриметрия используется для определения концентрации галогенидов, тиоцианатов, цианидов с помощью титрованного раствора – нитрата ртути (II). Титрованные растворы готовят с добавлением соответствующих кислот. При определении йодидов в процессе титрования образуется бесцветное комплексное соединение: 4КI + Hg(NO3 )2 = К2 [НgI4 ] + 2КNO3 16 Титрование выполняется в присутствии этанола. Комплексонометрический метод Метод основан на реакции образования прочных комплексов полиаминокарбоновых кислот с ионами металлов (Са2+ , Mg2+ ,Zn2+ , Вi2+ и др.). В качестве рабочего раствора наиболее широко применяется динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б). Трилон Б наряду с карбоксильными группами содержит аминный азот. Вследствие такого строения он является кислотой и комплексообразующим веществом. Процесс комплексонометрического титрования заключается в том, что к исследуемому раствору, содержащему определяемый катион, при строго определенном значении рН прибавляют индикатор, при этом образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с ионом определяемого металла. При титровании трилоном Б этот комплекс разрушается и образуется более прочный, как правило бесцветный, комплекс иона металла с трилоном Б. При этом выделяется анион индикатора, который окрашивает раствор в цвет, присущий свободному индикатору при данном значении рН: Са2+ + Н2 Ind- → CaInd- + 2Н+ CaInd- + H2 Tr2- → CaTr2- + H2Ind- Окислительно-восстановительное титрование Окислительно-восстановительное титрование основано на окислительных или восстановительных свойствах анализируемых веществ и титрантов. В процессе титрования происходит изменение окислительновосстановительных потенциалов взаимодействующих систем. В фармацевтическом анализе применяют такие методы окислительновосстановительного титрования, как перманганатометрия, йодометрия, йодхлорометрия, йодатометрия, броматометрия, дихроматометрия, цериметрия. Галогениды щелочных металлов – хлориды кали, натрия. ХЛОРИДЫ НАТРИЯ И КАЛИЯ NaCl, KCl Получение Натрия хлорид: Натрия хлорид - единственный галогенид из этой группы препаратов, который широко распространен в природе в виде массивных отложений каменной соли. Она и является основным источником для получения препарата. Водно-солевые растворы сначала очищают от примесей. Очистку производят последовательно. Вначале очищают от сульфатов и фосфатов, обрабатывая хлоридом бария: Na2SO4 + BaCl 2 = BaSO4 + Na2 SO4 Na2HPO4 + BaCl2 = BaHPO4 + 2NaCl Раствор натрия хлорида отделяют от осадка декантацией нагревают и обрабатывают карбонатом натрия для осаждения солей кальция, магния и бария: MgCl 2 + Na2 CO3 = 2NaCl + MgCO3 BaCl 2 + Na2 CO3= 2 NaCl + BaCO3 CaCl 2 + Na2 CO3= 2 NaCl + CaCO3 Раствор вновь декантируют и нейтрализуют соляной кислотой до удаления карбонатов: Na2 CO3 + 2 HCl NaCl + CO2 2 2 + H2O Затем раствор упаривают до начала кристаллизации. Кристаллы отфильтровывают и высушивают при 200 °С. Калия хлорид: Источники получения калия хлорида - минерал сильвинит КС1 ' NaCI или карналлит КС1 ' MgCl2 6 Н20. Из них выделяют калия хлорид методом флотации, а затем очищают аналогично натрия хлориду. Подлинность Реакции на ионы натрия: Окрашивание пламени: Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет. Реакция с цинкауранилацетатом : Соли натрия образуют желтый кристаллический осадок с цинка уранил ацетатом в разбавленной уксусной кислоте, который не растворим в уксусной кислоте:  Реакции на ионы калия: Окрашивание пламени: Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет, а если рассматривать его через фиолетовое стекло - в пурпурнокрасный. Реакция с винной кислотой: Соли калия взаимодействуют с раствором винной кислоты образуя белый кристаллический осадок кислой соли - гидротартрата калия. Средняя соль легко растворима в воде, поэтому при добавлении к осадку кислой соли избытка ионов калия - осадок растворяется. Осадок растворим и в минеральных кислотах и в растворах едких щелочей. Однако в уксусной кислоте осадок кислой калиевой соли - нерастворим. Образованию осадка способствует охлаждение реакционной смеси, встряхивание и потирание стеклянной палочкой о стенки пробирки:  Реакция с кобальтонитритом натрия: Ионы калия образуют нерастворимую двойную комплексную соль гексонитрокобальтата калия-натрия. Реакцию проводят в слабокислой среде. При потирании стеклянной палочкой о стенки сосуда выпадает желтый кристаллический осадок двойной соли гексанитрокобальтита калия-натрия. Определению мешают соли аммония, которые необходимо предварительно удалить: K + Na3 [Co(NO2 ) 6 ]= K2 Na[Co(NO2 ) 6 2 ] + 2 Na Реакции на хлорид-ионы: Образование хлорида серебра:. Хлориды с раствором нитрата серебра образуют белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте но растворимый в растворе аммиака и карбоната аммония: Ag + Cl= AgCl Применение Натрия хлорид содержится в крови и тканевых жидкостях организма. Концентрация в крови его составляет 0,5 %. Основная роль натрия хлорида - обеспечить постоянство осмотического давления. Натрий является внеклеточным ионом, а калий – внутриклеточным ионом. Калия хлорид применяется при нарушении сердечного ритма, особенно при интоксикации сердечными гликозидами, что связано с обеднением клеток миакарда ионами калия. Кроме того калия хлорид применяется при гипокалиемии, которая возникает при длительном приеме диуретиков. 7. Галогениды щелочных металлов – бромиды натрия, калия. БРОМИДЫ НАТРИЯ И КАЛИЯ NaBr, KBr Получение I способ: Железные стружки обрабатывают водой и добавляют бром, к образовавшемуся бромиду железа (II) добавляют еще брома до образования смешанной соли: 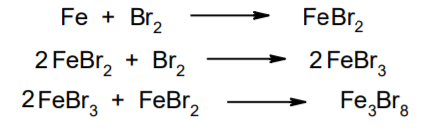 Бромид железа (II) и (III) имеет состав FeBr2•2FeBr3. Далее бромида закисно-окисного железа упаривают и добавляют раствор карбоната натрия: Гидроксиды железа (II) и (III) отфильтровывают, фильтрат подкисляют бромоводородной кислотой и упаривают до начала кристаллизации. Натрия бромид кристаллизуется в виде дигидрата NaBr . 2Н2О, который сушится при 110 - 130 °С до образования безводной соли. II способ: Широко применяется метод получения бромидов, основанный на взаимодействии брома с гидроксидом или карбонатом натрия в присутствии восстановителей (формиата натрия): III способ: Бромиды можно получить также путем пропускания брома в горячий раствор едкого натра. После выпаривания раствора осадок, представляющий собой смесь бромида и бромата натрия или калия, нагревают с древесным углем: 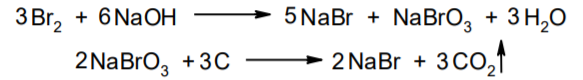 Бромиды натрия и калия белые кристаллические порошки, хорошо растворимые в воде. Натрия бромид гигроскопичен. Степень увлажнения его регламентируется путем определения потери в массе при высушивании (не более 4 %). Реакция среды водных растворов нейтральна. Для идентификации применяются реакции на катионы и анионы. Реакции на бромид-ионы: Окисление до свободного брома. Бромиды идентифицируют по реакции выделения брома окислительновосстановительной реакции между бромидом и хлорамином в кислой среде. Выделяющийся в результате реакции бром, извлекают хлороформом, в котором он растворим лучше, чем в воде, окрашивая его в желто-бурый цвет: 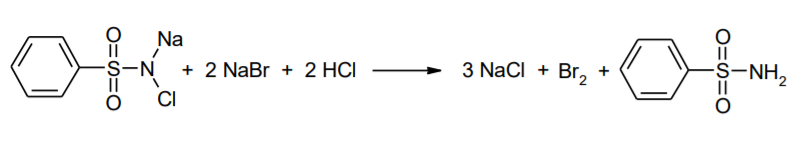 Образование бромидов серебра. Растворы бромидов с раствором нитрата серебра образуют бело-желтый творожистый осадок бромида серебра, нерастворимый в азотной кислоте и трудно растворимый в растворе аммиака: 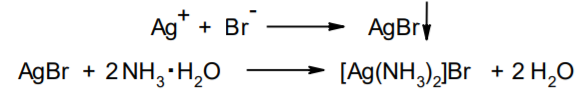 Определение примесей Примесь йодидов в натрия и калия бромиде: Примесь йодидов в натрия и калия бромиде открывается с раствором хлорида железа (III): йодиды являются восстановителями. Слабые окислители выделяют из йодидов йод, обнаруживаемый по характерному цвету и по посинению раствора крахмала. Растворы иодидов с раствором нитрата серебра образуют желтый творожистый осадок иодида серебра, нерастворимый в азотной кислоте и нерастворимый в растворе аммиака Концентрированная серная кислота разлагает йодиды даже на холоду. Йодид легко окисляется до свободного йода: Применение Успокаивающее действие препаратов брома основано на их способности усиливать процессы торможения в коре головного мозга. Бромиды могут восстанавливать равновесие между процессами возбуждения и торможения, особенно при повышенной возбудимости центральной нервной системы. Поэтому бромиды находят применение при неврастении, повышенной раздражительности. 8. Галогениды щелочных металлов – йодиды калия, натрия. Получение Йодиды получают также как и бромиды. Железные стружки обрабатывают водой и добавляют йод, к образовавшемуся йодиду железа (II) добавляют еще йода до образования смешанной соли: 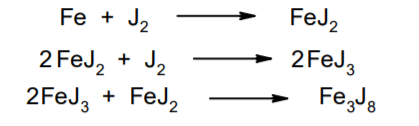 Йодид железа (II) и (III) имеет состав FeJ2 2 FeJ3. Далее йодида закисноокисного железа упаривают и добавляют раствор карбоната натрия: Калия и натрия йодиды - бесцветные или белые кристаллические порошки. Гигроскопичны, отсыревают во влажном воздухе. Являясь восстановителями, вступают в реакцию с кислородом воздуха, выделяя при этом йод, вследствие чего при неправильном хранении буреют. Катализатором реакции является свет, поэтому хранить эти препараты необходимо в склянках из оранжевого стекла в защищенном от света месте. Водные растворы имеют нейтральную реакцию среды. Идентификацию проводят по катионам и аниону. Реакции на йодид-ионы: Окисление до молекулярного иода. Иодиды являются восстановителями. Слабые окислители выделяют из йодидов йод, обнаруживаемый по характерному цвету и по посинению раствора крахмала. Сильные окислители могут окислить выделяющийся йод до бесцветных йодатов, поэтому большое значение имеет выбор окислителя и его концентрация. ГФ рекомендует использовать раствор хлорида железа (III) или нитрита натрия. Йод извлекается в несмешивающийся с водой хлороформ, в котором он имеет фиолетовую окраску. Реакцию с раствором нитрита натрия следует проводить под тягой (выделение оксидов азота).  Йодиды идентифицируют по реакции выделения йода окислительновосстановительной реакции между йодидом и хлорамином в кислой среде. Выделяющийся в результате реакции йод, извлекают хлороформом, в котором он растворим лучше, чем в воде, окрашивая его в розовосиреневый цвет цвет:  Образование йодида серебра. Растворы йодидов с раствором нитрата серебра дают желтый творожистый осадок, нерастворимый в азотной кислоте и растворе аммиака, но легко растворимый в растворе тиосульфата натрия: 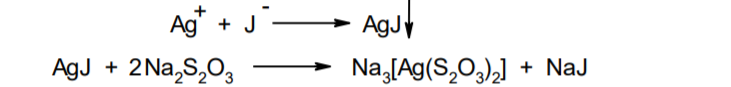 Окисление серной кислотой. При нагревании 0,1 г препарата с 1 мл концентрированной серной кислоты выделяются фиолетовые пары йода. Образование йодидов висмута, ртути и свинца. 14 Йодид-ион осаждается ионами металлов: висмута, свинца и ртути (II). Иодиды висмута и ртути - осадки белого цвета. С ионом свинца йодид-ион образует желтый осадок. Если осадок йодида свинца растворить при нагревании, а затем охладить, то он снова выделяется в виде блестящих золотистых чешуек. 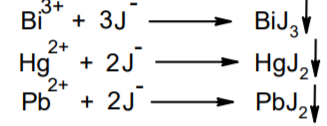 Доброкачественность  Количественное определение Аргентометрическое титрование. 1. Метод Фаянса (прямое титрование) Йодометрическое титрование (после окисления): При окислении йодидов нитритом натрия выделяется молекулярный йод. Его можно оттитровать тиосульфатом натрия. Это количественное определение йодидов можно проводить в присутствии хлоридов, бромидов и различных восстановителях. 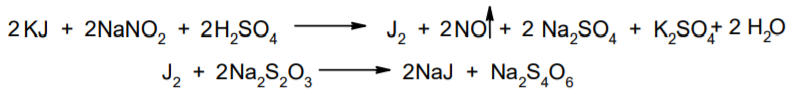 Применение Применяются йодиды как носители йода при гипертиреозе, эндемическом зобе. Если пища и вода не содержат достаточного количества йода, как это бывает в некоторых горных местностях, у местного населения появляется заболевание - кретинизм или зоб. 9. Галогениды щелочных металлов – натрия фторид. НАТРИЯ ФТОРИД NAF Получение В природе соединения фтора встречаются в виде минерала вилиомита, плавикового шпата (флюорита, криолита). Применяемый в медицине натрия фторид получают спеканием флюорита с песком и карбонатом натрия: Обнаружение фторид-ионов: Проба на травление стекла (образование плавиковой кислоты). 17 Концентрированная серная кислота разлагает фториды металлов с образованием газообразного фтористого водорода. Плавиковая кислота HF взаимодействует с оксидом кремния, входящим в состав стекла и разрушает его: После этого поверхность стекла становится мутной (протравленной). Реакцию проводят под тягой. При попадании на кожу HF образуются труднозаживаемые ожоги. 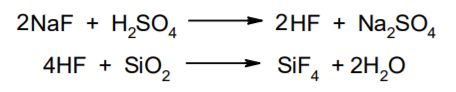 Образование осадков фторидов металлов. Ионы кальция, бария и свинца образуют с фторидом натрия белые осадки: 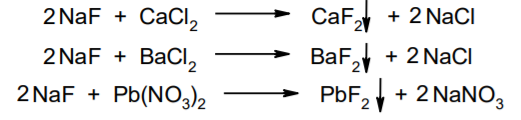 Взаимодействие с родановым комплексом железа. Комплекс тиоцианата железа (III) имеет ярко-красное окрашивание. В присутствии избытка фторида натрия окраска исчезает вследствие образования более устойчивого бесцветного соединения фторида железа. Определение проводят в среде хлористоводородной кислоты:  Взаимодействие с ализаринатом циркония (циркониевым лаком). При взаимодействии соли циркония с ализаринсульфокислым натрием образуется красно-фиолетовое соединение (лак), который от прибавления фторид-ионов разрушается вследствие связывания ионов Zr4+ в бесцветный комплексный ион и выделяется свободный ализарин, имеющий жёлтое окрашивание: 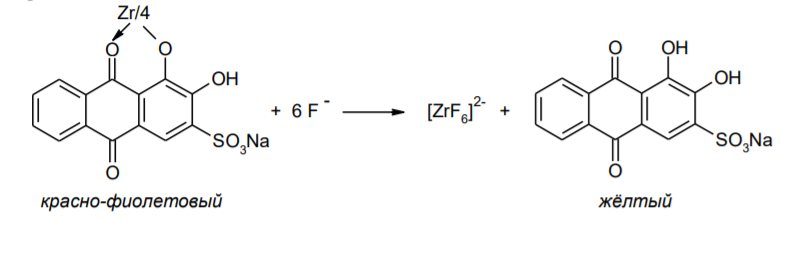 Количественное определение Гравиметрическое определение: Количественно натрия фторид можно определить гравиметрическим методом после осаждения фторид-ионов хлоридом свинца (II): NaF + PbCl 2 PbFCl + NaCl Неводное титрование Соль NaF подвергается гидролизу. Гидролиз усиливается в присутствии уксусного ангидрида с образованием малодиссоциирующего кислого комплекса Н[HF2]. На этом основан метод неводного титрования. Рабочим раствором является хлорная кислота. Титрование ведётся в среде уксусного ангидрида. Индикатор – кристаллический фиолетовый: NaF + (CH3 CO) 2O + H2O H2 F2 2 + 2 CH3 COONa CH3 COONa + HClO4 CH3 COOH + NaClO4 Потенциометрическое определение В таблетках натрия фторид определяют потенциометрическим методом с использованием фторидного и хлорсеребряного электродов. Содержание NaF рассчитывают по колибровочному графику. Применение Фториды восполняют дифицит фтора в организме. Ионы фтора накапливаются в организме, преимущественно в тканях зуба и костных тканях. Фториды способствуют созреванию и отвердеванию зубной эмали, а также способствует созреванию костной ткани и оказывают бактерицидное действие. Применяются натрия фторид в стоматологии для профилактики зубного кариеса и в качестве средства лечения и профилактики остеопороза различного происхождения. 10.Фармакопейный анализ препаратов VII группы ПС – Кислота хлористоводородная. КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ HCl Получение Основной промышленный способ получения хлороводорода – прямой синтез из хлора и водорода. Их получают при электролизе раствора натрия хлорида: 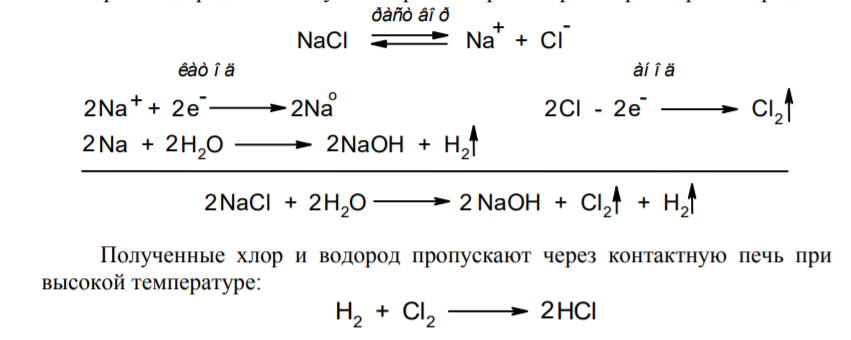 Подлинность Обнаружение хлорид-ионов:  Применение Разведенная хлористоводородная кислота применяется внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока. Нередко её назначают вместе с препаратами железа, так как она способствует улучшению его всасывания. 11.Йод. Спиртовые растворы йода. ЙОД. СПИРТОВЫЕ РАСТВОРЫ ЙОДА J2 Получение Источниками получения йода служат буровые воды и морские водоросли (в золе последних до 0,5% йода). До 0,3% иола содержится в виде примеси йодатов в чилийской селитре. В Чили в I9I4-1918 годах было сосредоточено до 74% мировой добычи йода. В 1924-1926 гг.) Магидсон О.Ю. совмесно с сотрудниками разработал оригинальную технологию получения йода из буровых вод, содержащих 0,001 -0,01 % йода в виде йодидов. Процесс состоял из ряда последовательных стадий: очистки буровых вод от примеси нефти и нафтеновых кислот, отстаивания от механических примесей, окисления йодид-ионов до свободного йода нитритом натрия в присутствии серной кислоты: Выделившийся йод адсорбируют активированным углем. Это наиболее важный этап производства, так как происходит концентрирование (в 200-300 раз) малых количеств йода. Затем йод подвергают десорбции с помощью раствора гидроксида натрия или сульфита натрия: 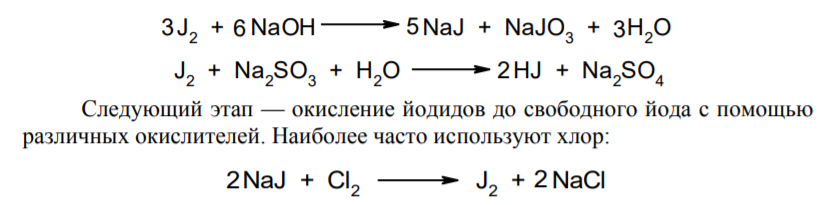 Процесс окисления может быть осуществлен электролизом. Заключительный этап — процесс очистки йода от примесей. Для этого йодсырец подвергают сублимации в стальных, чугунных или керамических ретортах. Кристаллический йод это серовато-черные с металлическим блеском пластинки с характерным запахом. Спиртовой раствор йода - прозрачная жидкость красно-бурого цвета с характерным запахом. Йод имеет характерные свойства, отличающие его от других лекарственных веществ. Он летуч при обычной температуре, при нагревании возгоняется, образуя фиолетовые пары. Т. пл. 113-114°С. Йод очень мало растворим в воде, растворим в органических растворителях (эфире, хлороформе). В водных растворах йодидов йод растворяется с образованием комплексной соли (полийодида): J2 + KJ= K[J3 ] Подлинность Окраска растворителей. Идентифицировать йод можно по окраске его растворов в различных растворителях. Растворы в кислородсодержащих растворителях (вода, эфир) имеют темно-бурую окраску, а в бескислородных (хлороформ) — фиолетовую Окраска крахмального клейстера. Подлинность йода и его лекарственных форм устанавливают с помощью специфической реакции. Она основана на образовании продукта синего цвета при взаимодействии йода и крахмального клейстера. При кипячении окраска исчезает и появляется вновь при охлаждении. С помощью рентгеноструктурного анализа и других физико-химических методов установлено, что синий йодид крахмала представляет собой соединения включения (клатраты). Молекула -амилозы в этих клатратах образует вокруг молекулы йода спираль, каждый виток которой содержит 6 остатков глюкозы. При получении йода из озоленных морских водорослей или буровых вод может образоваться очень токсичная примесь цианида йода: 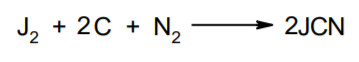 Для установления образовавшихся цианидов йод обесцвечивают, восстанавливая раствором сернистой кислоты, и обнаруживают цианид-ион по образованию берлинской лазури - гексацианоферрат (II) железа (III), имеющей синюю окраску: 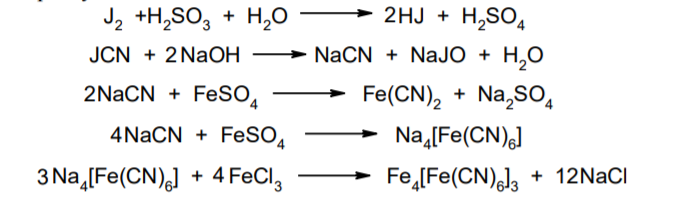 Примесь хлоридов также устанавливают после обесцвечивания раствора йода сернистой кислотой. Для этого раствором нитрата серебра в присутствии аммиака осаждают йодид- и хлорид-ионы. Хлорид серебра растворим в растворе аммиака, а йодид-ион не растворим. и отфильтровывают образовавшимся йодид серебра (не растворимый в аммиаке). Хлорид серебра растворяют в избытке аммиака с образованием 24 аммиаката серебра. Раствор фильтруют; на фильре остаётся иодид серебра, а фильтрат подкисляют азотной кислотой и определяют содержание примеси хлоридов по образованию хлорида серебра (в виде опалесценции): 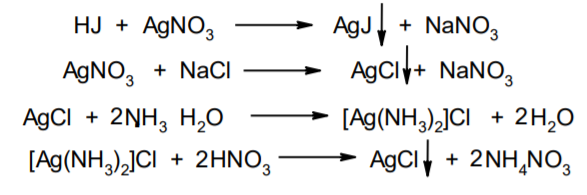 Применение Йод в медицинской практике применяют в качестве антисептического средства. Спиртовой 5%-ный раствор йода используют для обработки ран, подготовки операционного поля. Готовят 5%-ный раствор путем растворения йода и йодида калия в смеси равных объемов воды и 95%-ного этилового спирта. Йод ядовит, его пары раздражают слизистые оболочки. При частом воздействии йода на кожу возможны дерматиты. Удаляют йод с кожных покровов действием раствора тиосульфата или карбоната натрия. |
