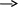Федеральное агентство по образованию московский государственный университет технологий и управления
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
|
Таблица 5. Важнейшие окислители.
Таблица 6 Взаимодействие металлов с азотной кислотой.
Взаимодействие металлов с кислотами и со щелочами. Кусочек металла помещают в пробирку и прибавляют раствор кислоты или щелочи. Zn + НСl (разб.) = Сu + НС1 = Fe + H2SO4 (разб.) = Fe + H2SO4 (конц.) = Сu + HNO3 (конц.) = Сu + HNO3 (разб.) = 11 Вывод: Zn + NaOH (конц.) = Al + NaOH + H2O = Упражнения. Закончите уравнения реакций и подберите к ним коэффициенты с помощью электронных схем: 1. K2Сг2O7 + HCL = 2. KMnO4 + K2S +H2SО4 = 3. Сl + КОН -> КСlOз + KСl + Н2O = -'■ Л. 4. КСrO2 + Вr2 + КОН = 5. КМnO4 + FeSO4 + H2SО4 = 12 6.Сu+Н2SO4(конц.) = 7.Mg + HNО3(paзб.) = 8. КМnО4 + HC1 = ОСНОВЫ ЭЛЕКТРОХИМИИ. Ряд напряжения металлов. K/K+ Ba/Ba2+ Ca/Ca2+ Na/Na+ Mg/Mg2+ Al/Al3+ Mn/Mn2+ -2,92 -2,90 -2,87 -2,71 -2,37 -1,70 -1,18 Zn/Zn2+ Fe/Fe2+ Co/Co2+ Ni/Ni2+ Sn/Sn2+ Pb/Pb2+ -0,76 -0,44 -0,28 -0,25 -0,14 -0,13 H22H+ Cu/Cu2+ Ag/Ag+ Hg/Hg2+ Pt/Pt2+ Au/Au+ 0,00 +0,34 +0,80 +0,85 +1,20 +1,50 Гальванический элемент.  Cu Сборка гальванического элемента Cu Сборка гальванического элемента/ - /Zn/ ZnSO4// Cu SO4/ Cu / +/ 13 Составить уравнение для процессов, происходящих на электрода гальванического элемента э.д.с.= Е° Cu/Cu2+ - Е° Zn/Zn2 Упражнения. 1. Напишите электронные схемы и уравнение реакции, лежащие в основе работы гальванического элемента: Pb/ PbNO3 // AgNО3 / Ag Что подвергается коррозии при повреждении поверхности луженой медной посуды: а) медь, б) олово, в) олово и медь (подчеркните) Составьте схемы амфотерной коррозии никелированного железа 4. Какой металл будет являться анодным покрытием для изделий из цинка: а) серебро, б) магний, в) железо (подчеркните) ЭЛЕКТРОЛИЗ. Таблица 7.
14
Меn+ + nê = Ме° Окислитель Анод растворимый Me - nê = Меn+ Восстановитель Количественные соотношения выделяющихся при электролизе веществ определяются законом Фарадея, из которого следует m=Э3jt/ 96500 m -масса в гр, Э - эквивалент вещества, j-сила тока в амперах, t- время в сек, V- объем газа, Vг-экв- объем г-экв газа. Схемы электролиза 1. Электролиз раствора ZnCl2 инертным анодом Катод /--/ Zn2++ 2Сl-. Анод /+/ Н2O Za2+ + 2ê = Zn° 2Сl- - 2ê = С12° 2. Электролиз раствора K2SO4 инертным анодом . Катод / -12К+ + SO422- Анод / + / Н2O 2Н2O+2ê = Н2 + 2ОH- 2Н2О - 4ё = O2 + 4H+ Ni Катод /—/ 3. Электролиз раствора с никелевым анодом Анод / + / Ni2+ + 2ê = Ni° Ni° - 2ê = Ni2+ 15 Лабораторная работа Опыт 1. Электролиз раствора сульфата натрия Na2SО4 Катод/-/ Н2О Анод/+/ Наблюдения: Опыт 2. Электролиз раствора медного купороса CuSО4 Катод/-/ Н2О Анод/+/ Наблюдения: Опыт 3. Электролиз раствора иодида калия. KI Катод/-/ Н2O : Анод/+/ Наблюдения: Опыт 4. Электролиз раствора серной кислоты с применением растворимого анода " H2SО4 Катод /-/ Н2О Анод/ + / Наблюдения: Упражнения. 1.При электролизе какой соли на катоде будет восстанавливаться водород из воды: а) сульфата никеля, б) хлорида калия, в) фосфата калия (подчеркните) Какой процесс произойдет на катоде при электролизе раствора нитрата алюминия: а) А13+ + Зê = А1° б) 2Н20 + 2ê= Н2 + 20НГ, в) 2Н+ + 2ê= Н2 (подчеркните) Сколько литров кислорода выделится при пропускании через раствор нитрата серебра 96500 кул электричества: а) 22.4 л, б) 11,2 л, в) 5,6 л (подчеркните) Составьте схемы электролиза : а) расплава СаСl2 б) раствора РЬ(NOз)2 с инертным анодом, в) раствора нитрата серебра с серебряным анодом. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. Строение комплексных соединений по координационной теории Вернера. Комплексообразователь     K4[Fe(CN)6] K4[Fe(CN)6] лиганды лигандыВнешняя сфера внутренняя координационное число комплекса сфера комплексообразователя Диссоциация комплексных соединений. По закону сильных электролитов: К, [ Fe (CN)6 ] → 4К+ + [ Fe (CN)6]4-- По закону слабых электролитов: 17 К4 [ Fe (CN)6 ] → 4K+ + [ Fe (CN)6 ]4- 2. По закону слабых электролитов: [ Fe (CN)6 ] ↔ Fe2+ + 6CN- 3. Выражение константы нестойкости комплексного иона; К= [Fe2+][CN-]6 [Fe(CN)64-] Классификация и номенклатура комплексных соединений. Комплексы бывают катионные, анионные, катионно-анионные и нейтральные в зависимости от заряда комплексного иона В названиях солей используется общее правило: сначала называют анион, а затем катион в родительном падеже. Название катиона начинают с координационного числа (используя греческие числительные: 2- ди, 3- три, 4- тетра, 5- пента, 6-гекса) и нейтральных лигандов: Н2О - аква, NНз - аммин, затем отрицательно заряженные лиганды: Сl-- хлоро, О2-- оксо, ОН- -гидроксо,NO2- -нитро, CN- - циано, SO42- сульфато и т.д. Последним называют комплексообразователь, в скобках указывая его степень окисления. Комплексообразователь в катионе называют по -русски. Например [Сu (NH3)4]S04 - сульфат тетраамминмеди /II/ Комплексообразователь в комплексном анионе называют употребляя латинское название элемента с окончанием "ат" впереди ставя его степень окисления. Например, К2[ Си (CN)4] - тетрациано /II/ купрат калия. Катноно-анионный комплекс: [ Pt (NH3)4][PtCl4] -тетрахлоро /II/ платинат тетрааминплатины /II/. В нейтральных комплексах комплексообразователь называют в именительном падеже, а степень окисления его не указывают: [Pt (NH3)2Cl2] - диамминдихлороплатина. Опыт 1 К 1 мл раствора соли меди прибавляют постепенно по каплям раствор аммиака. Первоначально выпавший осадок растворяется. I8 CuCl + NH4OH = CuOHCl + NH4C1 + NH4OH = KH= Наблюдения и вывод: Опыт 2. Распад комплексных соединений от действия кислот и щелочей. К растворами комплексных солей, полученных в предыдущем опыте, прибавляют соответственно растворы серной кислоты и щелочи. [Cu(NH3)4]Cl2+H2SO4 = Наблюдения: [Cu(NH3)4]Cl2 + NaOH = Наблюдения: Вывод: Упражнения. 1. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях: К2[ Zn (CN)4], Ba2[Ti Сl8], [Co(NH3)4 Cl2]Cl. Комплексообразователь Степень окисления Координационное Zn число 19 Ti Ti Co 2. Приведите названия следующих комплексных соединений: Формула КС Название [Ni(NH3)6]Cl2 [Сг(Н2O)5С1] Сl2 Н2[РtCl6] К[РtС16] [Cu(NH3)4] (ОН)2 К3[А1(ОН)6] ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Класс соединений Предельные углеводороды Непредельные углеводороды Ароматические углеводороды Спирты Общая формула СnН2n+2 CnH2n СnН2n-2 | |||||||||||||||||||||