Ацилирование. Федеральное агентство по образованию
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
3. С-Ацилирование 3.1. Ацилирование ароматических соединений (реакция Фриделя-Крафтса) Ацилирование ароматических соединений по Фриделю-Крафтсу осуществляется обычно хлорангидридами или ангидридами карбоновых кислот в присутствии более чем эквимолярных количеств безводных галоидных солей металлов (А1Вг3, А1С3, FeCl3 и т.п.): 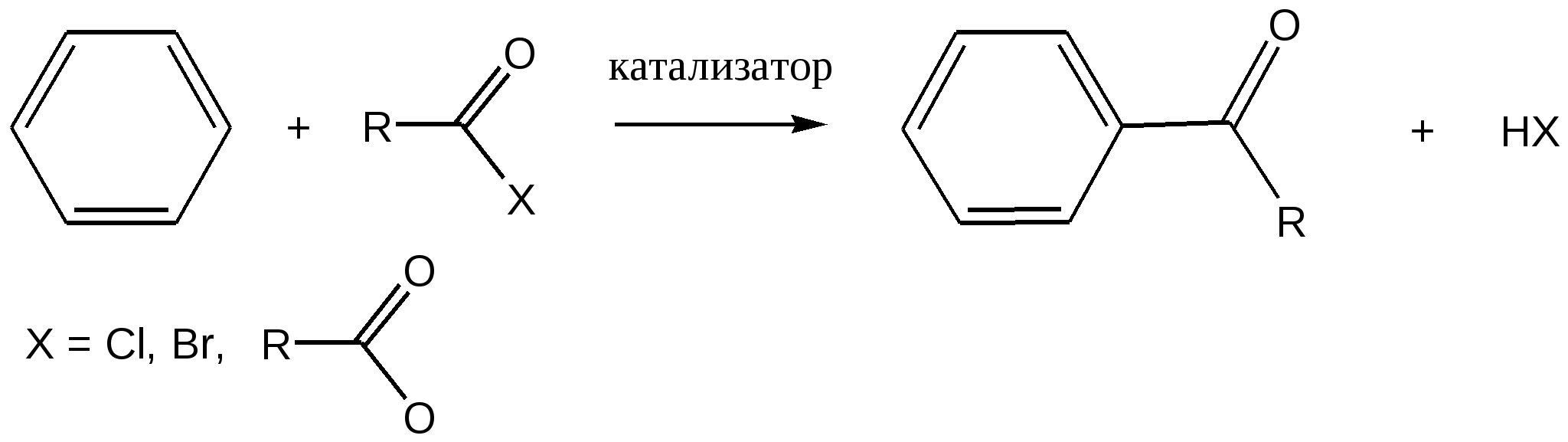 Ацилирование по Фриделю-Крафтсу относится к реакциям электрофильного замещения в ароматическом ядре: 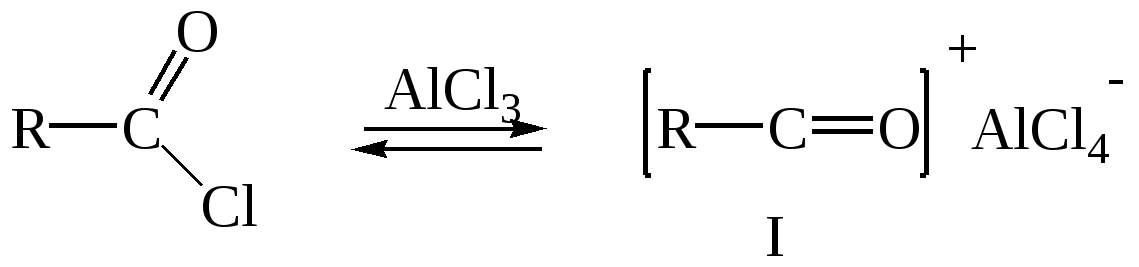 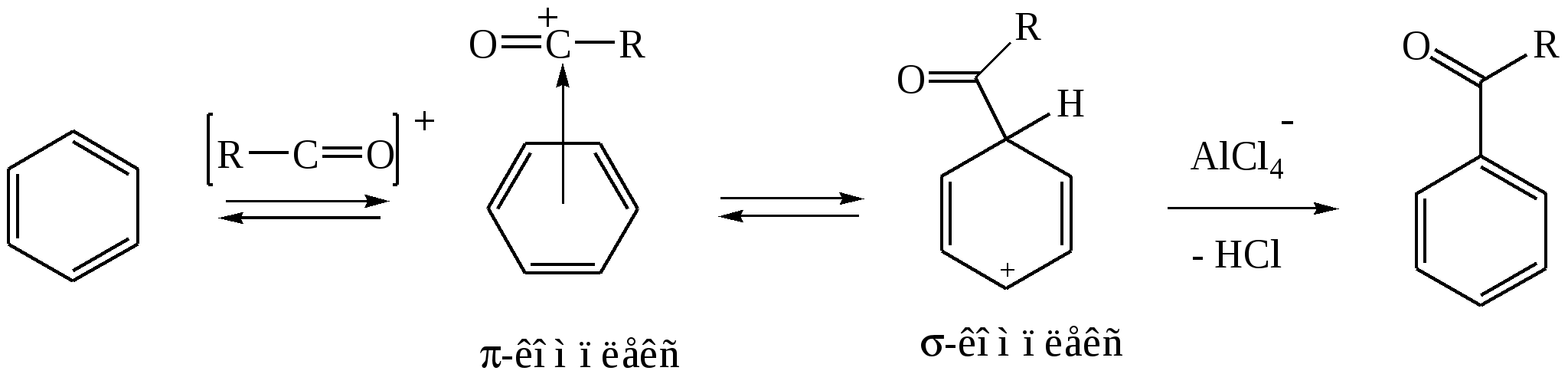 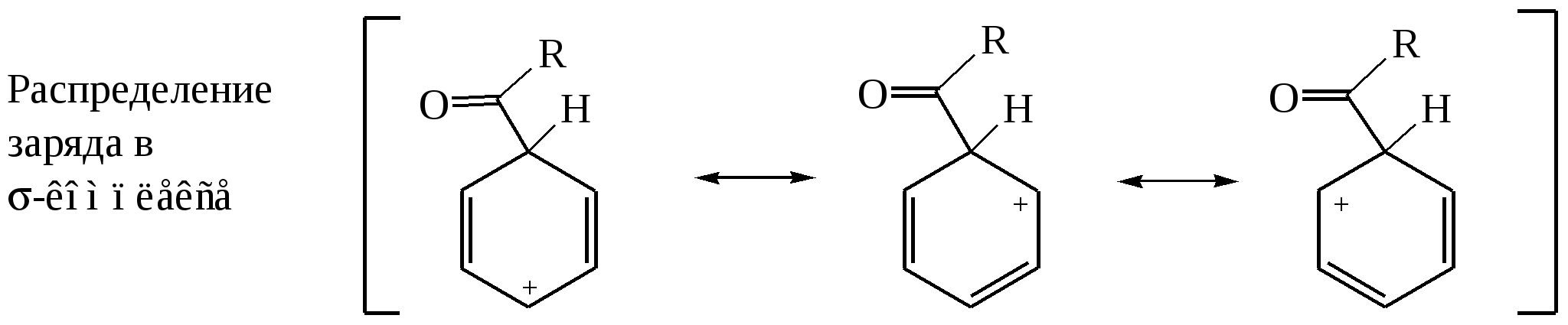
Для реакций ацилирования по Фриделю-Крафтсу наблюдаются следующие основные закономерности.
Причина – образование комплекса продукта реакции (ароматического кетона) с хлоридом алюминия, т.е. хлорид алюминия выводится из сферы реакции. После завершения реакции образовавшийся комплекс разлагают разбавленным раствором соляной кислоты: 
 В условиях реакции Фриделя-Крафтса можно ацилировать бензол и его гомологи, нафталин, антрацен, фенолы, простые эфиры фенолов, ароматические галогенпроизводные, а также реакционноспособные гетероароматические соединения (фуран, тиофен, бензофуран и т.п.). Например, при ацилировании тиофена уксусным ангидридом в присутствии трифторида бора при 10°С с выходом 70% синтезирован 2-ацетилтиофен:  Ацилий-катион (I) является объёмным, слабоэлектрофильным, и поэтому ацилирование протекает региоселективно, т. е. идет почти исключительно в пара-положение к имеющемуся заместителю. Например, при ацетилировании трет-бутилбензола орто-, мета- и пара-ацетилпроизводные образуются с выходами 0; 1,8 и 98,2% соответственно:  Однако в случае, когда пара-положение занято, образуются орто-производные. Например, при ацетилировании п-цимола ацетильная группа вступает в положение, соседнее с метильной группой:  Таким образом, предпочтительным направлением замещения является замещение в пара-положение. Ароматические соединения, содержащие электроноакцепторные группы (NО2, CF3, CN, COOR, COR, SO2OR и др.), в реакцию ацилирования по Фриделю-Крафтсу не вступают. Ацилирование по Фриделю-Крафтсу находит широкое применение в лабораторной синтетической практике. Это обусловлено следующими причинами.
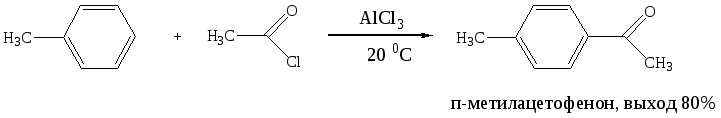
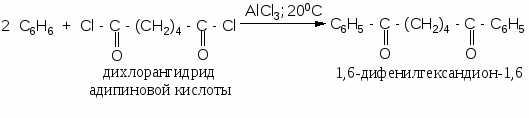
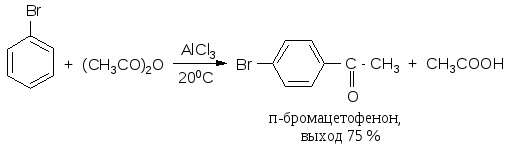
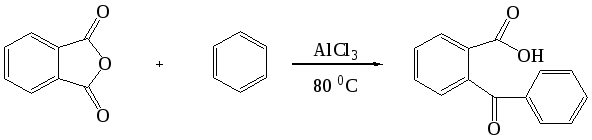 В аналогичных условиях из янтарного ангидрида (ангидрида бутадионовой кислоты) с выходом 82 % синтезирована -бензоилпропионовая кислота, а из малеинового ангидрида - -бензоилакриловая кислота (выход 85 %): 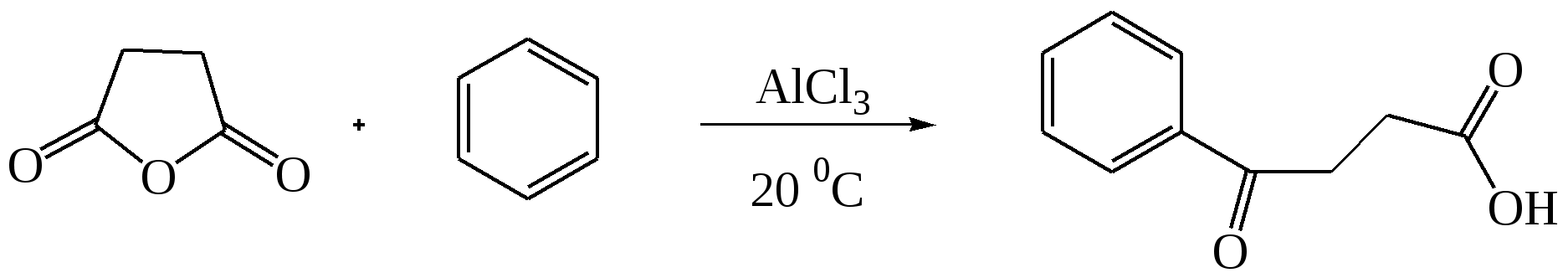  Ацилирование по Фриделю-Крафтсу часто проводят в растворе сероуглерода. Использование растворителей становится необходимым в тех случаях, когда нецелесообразно или невозможно проводить реакцию в ацилируемом соединении, взяв избыточное его количество. Если ароматическое соединение жидкое, как, например, бензол, толуол, этилбензол, п-цимол и т. д., то оно само может служить растворителем. В качестве растворителей в рассматриваемой реакции применяют тетрахлорэтилен, нитробензол, а при температурах не выше 5°С – тетрахлорметан, хлороформ, 1,2-дихлорэтан и хлорбензол. Во многих случаях растворитель оказывает сильное влияние на течение реакции Фриделя-Крафтса. Например, ацетилирование нафталина ацетилхлоридом в 1,2-дихлорэтане или сероуглероде дает главным образом 1-ацетилнафталин, в то время как в нитробензоле основным продуктом реакции является 2-ацетилнафталин:  Антрацен ацетилируется очень легко в растворе 1,2-дихлорэтана при -5°С, давая с выходом 60% 9-ацетильное производное: 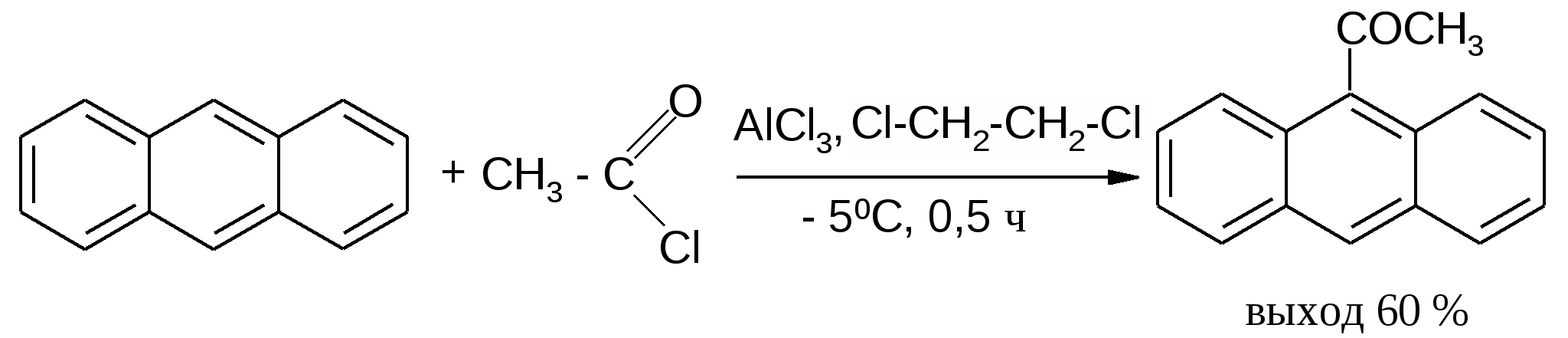 В реакции ацилирования дифенил значительно активнее бензола, поэтому в данном случае бензол используют в качестве растворителя:  Ацилирование фенолов по реакции Фриделя-Крафтса сопровождается многими осложнениями. В связи с этим для получения 4-гидроксифенилкетонов применяют специальные методы. Один из них – перегруппировка сложных эфиров фенолов в присутствии эквимолярных количеств хлорида алюминия (перегруппировка Фриса). Реакцию обычно проводят в растворе нитробензола при комнатной температуре, реже - при нагревании: 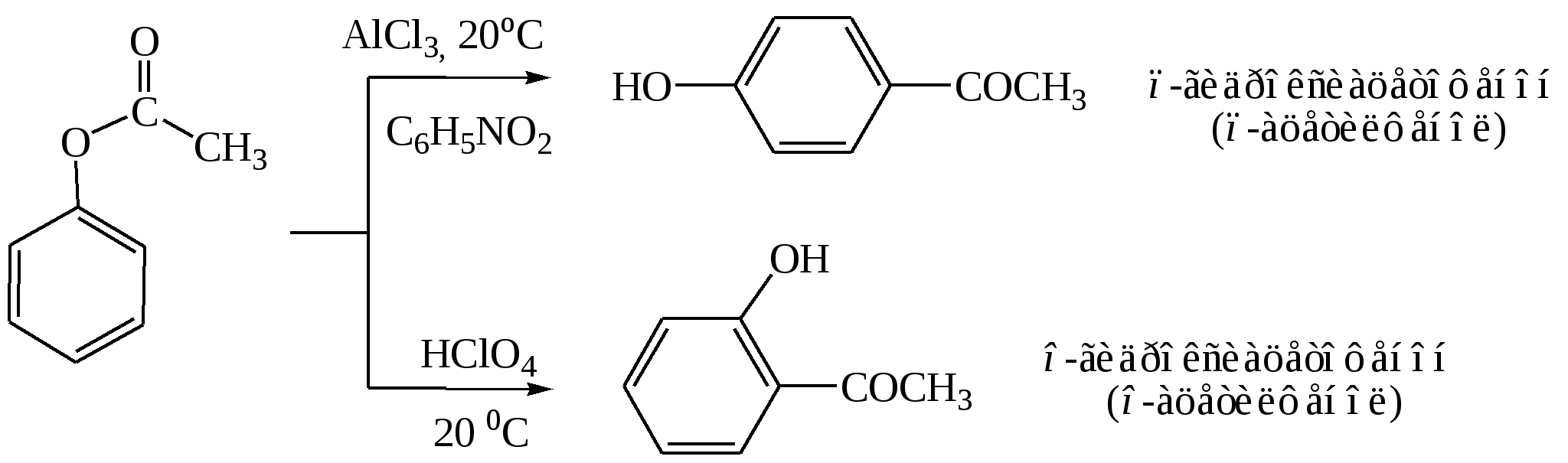 Применение в качестве катализатора 70%-ной хлорной кислоты или проведение реакции без растворителя позволяют получать орто-ацилированные продукты в качестве основных, а иногда и единственных продуктов реакции. При перегруппировке сложных эфиров пара-замещенных фенолов орто-ацилирование протекает гладко и с высокими выходами, но при более высокой температуре. По существу рассматриваемая реакция является внутримолекулярным ацилированием сложным эфиром: 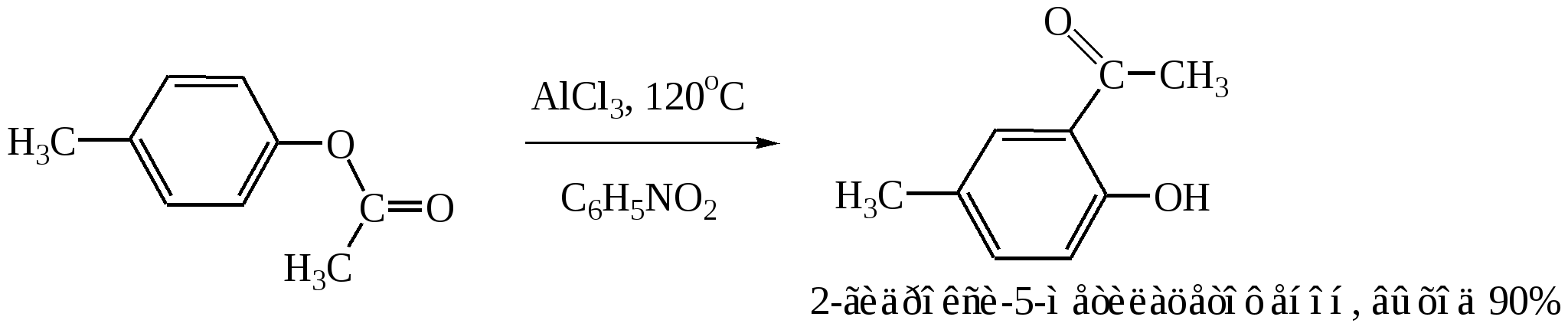 Перемещение ацильного остатка в сложных эфирах фенолов может происходить в орто- и пара-положение по отношению к гидроксильной группе. Соотношение орто- и пара-изомеров зависит от структуры применяемых эфиров фенола и, главным образом, от температуры, растворителя, вида и количества катализатора. Низкие температуры (ниже 60°С) способствуют перегруппировке в пара-положение, более высокие – в орто-положение: 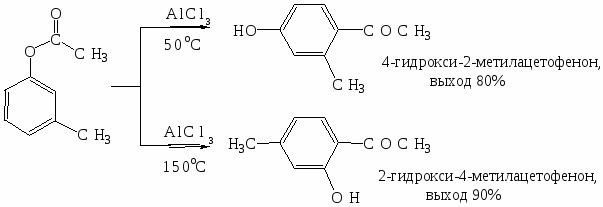 Простые эфиры фенолов ацилируются в очень мягких условиях без каких-либо осложнений: 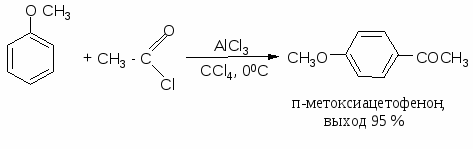 В дифенилметане, как и в дифениловом эфире, легко ацилируются оба бензольных кольца:  Кроме безводного хлорида алюминия, при ацилировании по Фриделю-Крафтсу используются и другие катализаторы – бромистый алюминий, трехфтористый бор, хлорное железо и др. Например, ацилирование активированных ароматических систем часто проводят в полифосфорной кислоте (ПФК): 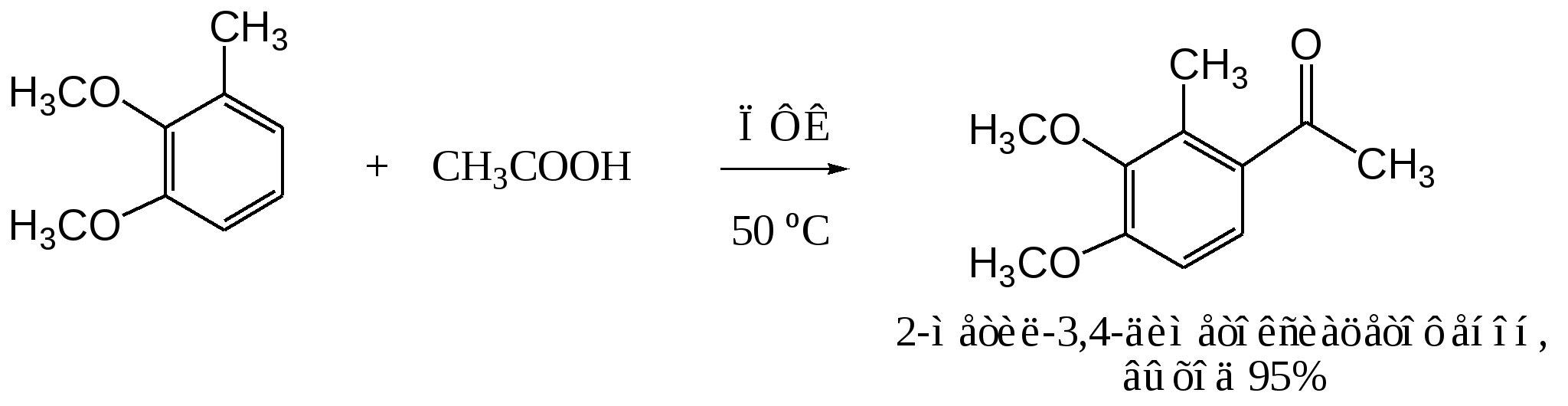 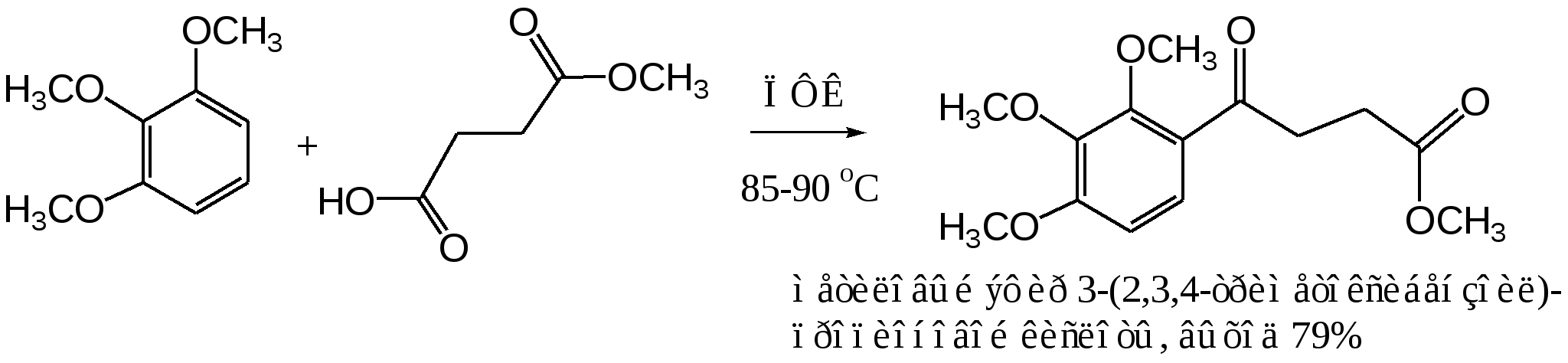 3-Ацетил-2,5-диметилфуран синтезирован с выходом 87% при ацетилировании 2,5-диметилфурана уксусным ангидридом в присутствии хлорида олова:  3.2. Синтез карбоциклических систем внутримолекулярным ацилированием по реакции Фриделя-Крафтса Если ацилирующая группа находится в боковой цепи, то становится возможным внутримолекулярное ацилирование с образованием циклических кетонов. Замыкание кольца в орто-положение происходит легко и часто с высокими выходами, если при этом может образоваться пяти- или шестичленный цикл. Обычный метод циклизации такого типа состоит в добавлении хлорангидрида кислоты к катализатору (т. е. при использовании обратного метода проведения реакций Фриделя-Крафтса). Таким путем, например, из хлорангидрида -фенилпропионовой кислоты с количественным выходом получен инданон-1. Этот же кетон может быть синтезирован с выходом 73% из самой кислоты в присутствии фтористоводородной кислоты: 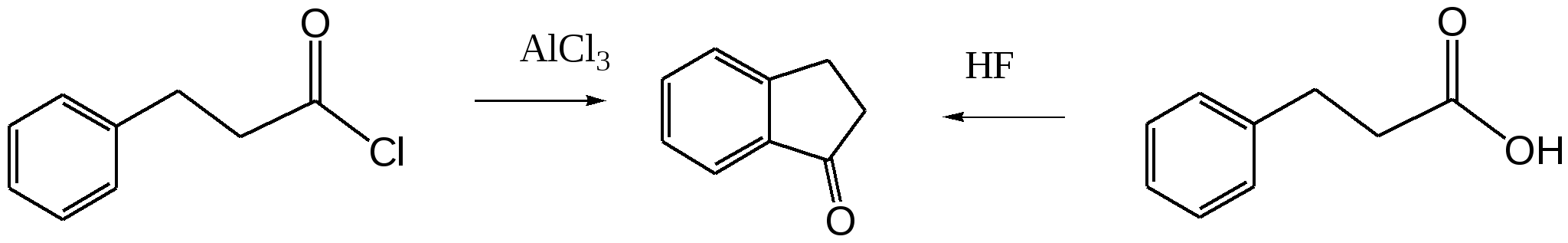 Под влиянием безводной фтористоводородной кислоты бензилбензойная кислота превращается в антрон:  В реакцию внутримолекулярного замыкания цикла вступают также и ангидриды кислот. Примером может служить получение шестичленного кетона – 1-кетотетралин-З-карбоновой кислоты из ангидрида бензилянтарной кислоты в присутствии концентрированной H2SO4:  Проводя реакцию в разбавленных растворах, можно получать циклические кетоны с ещё большими размерами кольца. Примером может служить внутримолекулярная циклизация хлорангидрида 6-фенилкапроновой кислоты, в результате которой с выходом 67% получают соответствующий восьмичленный кетон:  3.3.Ацилирование непредельных соединений Ацилирование непредельных соединений хлорангидридами карбоновых кислот с образованием ,-непредельных кетонов называется реакцией Кондакова: 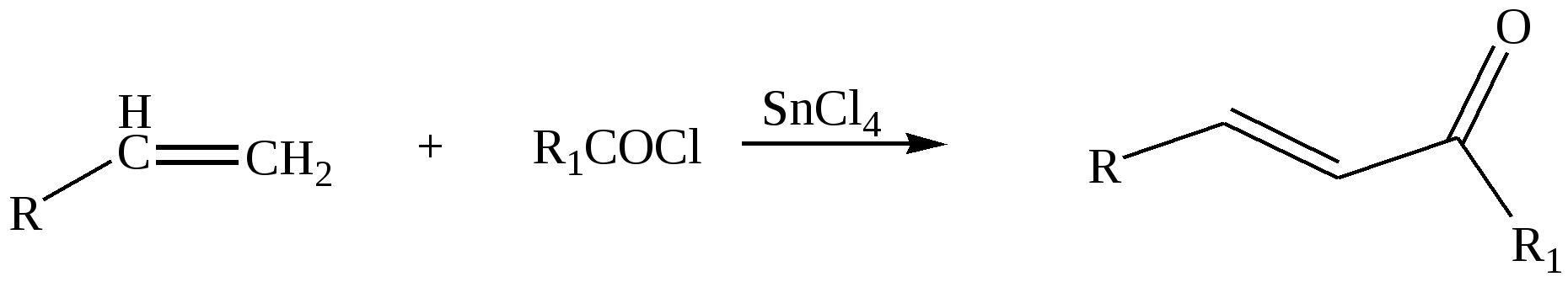 Механизм этой реакции аналогичен реакциям электрофильного присоединения к непредельным соединениям: 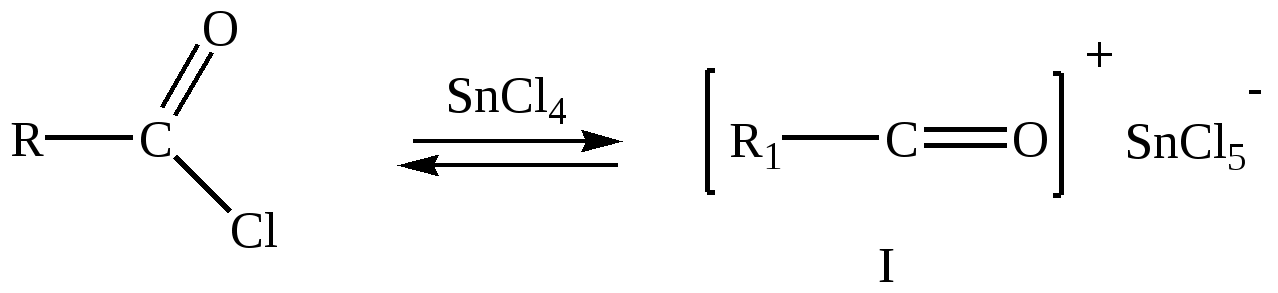 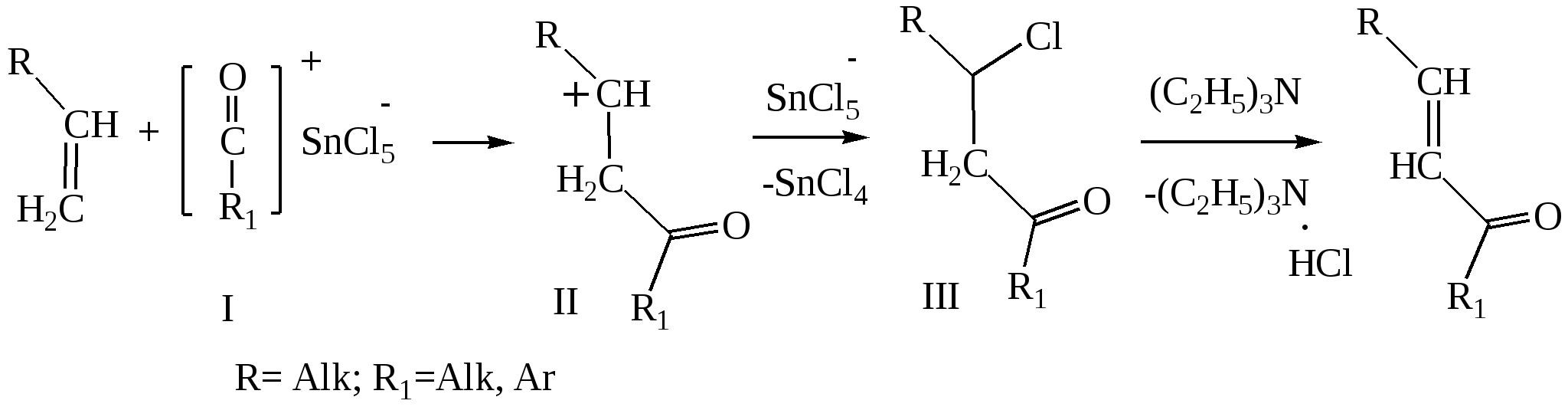
Реакция Кондакова, будучи весьма разносторонней реакцией, позволяет получать самые различные кетоны, которые трудно синтезировать другим путем. Выходы в этой реакции не очень высоки, поскольку имеется много потенциально возможных побочных реакций, затрагивающих двойную связь. Возможными продуктами являются -хлоркетоны, изомерные ненасыщенные кетоны, алкилгалогениды и полимеры. Самым лучшим катализатором служит хлорид олова (IV), однако, как было показано, если предпринимать предосторожности для того, чтобы использовать только эквивалентные количества ацилгалогенида и хлористого алюминия, эффективными катализаторами будут также хлористый цинк и хлористый алюминий. Эти меры предосторожности можно осуществить, растворяя хлористый алюминий и ацилгалогенид в метиленхлориде и декантируя этот раствор с избытка хлористого алюминия. Олефин следует добавлять последним. Выходы при такой методике составляют от 40 до 57%. Аналогичным образом протекает ацилирование ацетиленовых углеводородов с образованием -галогензамещенных винилкетонов, причем выходы бывают различными, как плохими, так и удовлетворительными: 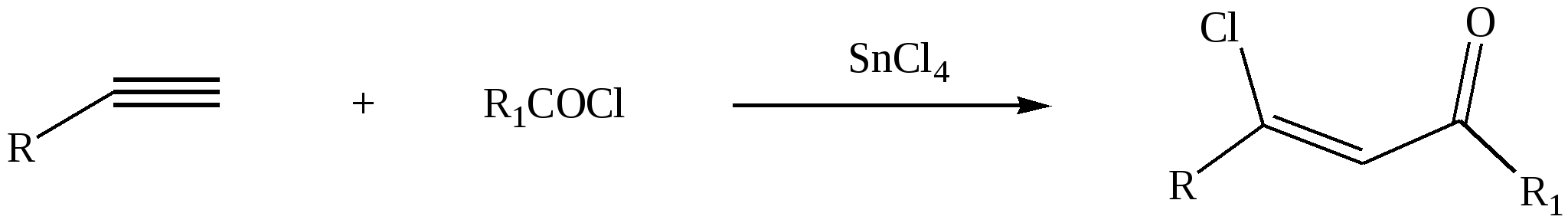 3.4. Ацилирование -дикарбонильных соединений Хлорангидриды и ангидриды карбоновых кислот в присутствии основных катализаторов могут реагировать с С-Н-кислотными соединениями. Реакция ацилирования -дикарбонильных соединений очень важна в препаративном отношении. Обычно еноляты металлов (натрия или магния) вводят в реакцию с ацилгалогенидами. Амбидентный анион -дикарбонильного соединения в определенных условиях наряду с С-ацилированием способен и к замещению у атома кислорода енольной группы (О-ацилированию). Соотношение продуктов О- и С-замещения зависит как от строения ацилирующего агента и -дикарбонильного соединения, так и от реакционной среды. Так, при ацилировании этоксимагнийпроизводных -дикарбонильных соединений образуются исключительно продукты С-ацилирования. В свою очередь ацилирование свободных -дикарбонильных соединений ацилхлоридами в пиридине приводит исключительно к образованию О-ацилированных продуктов: 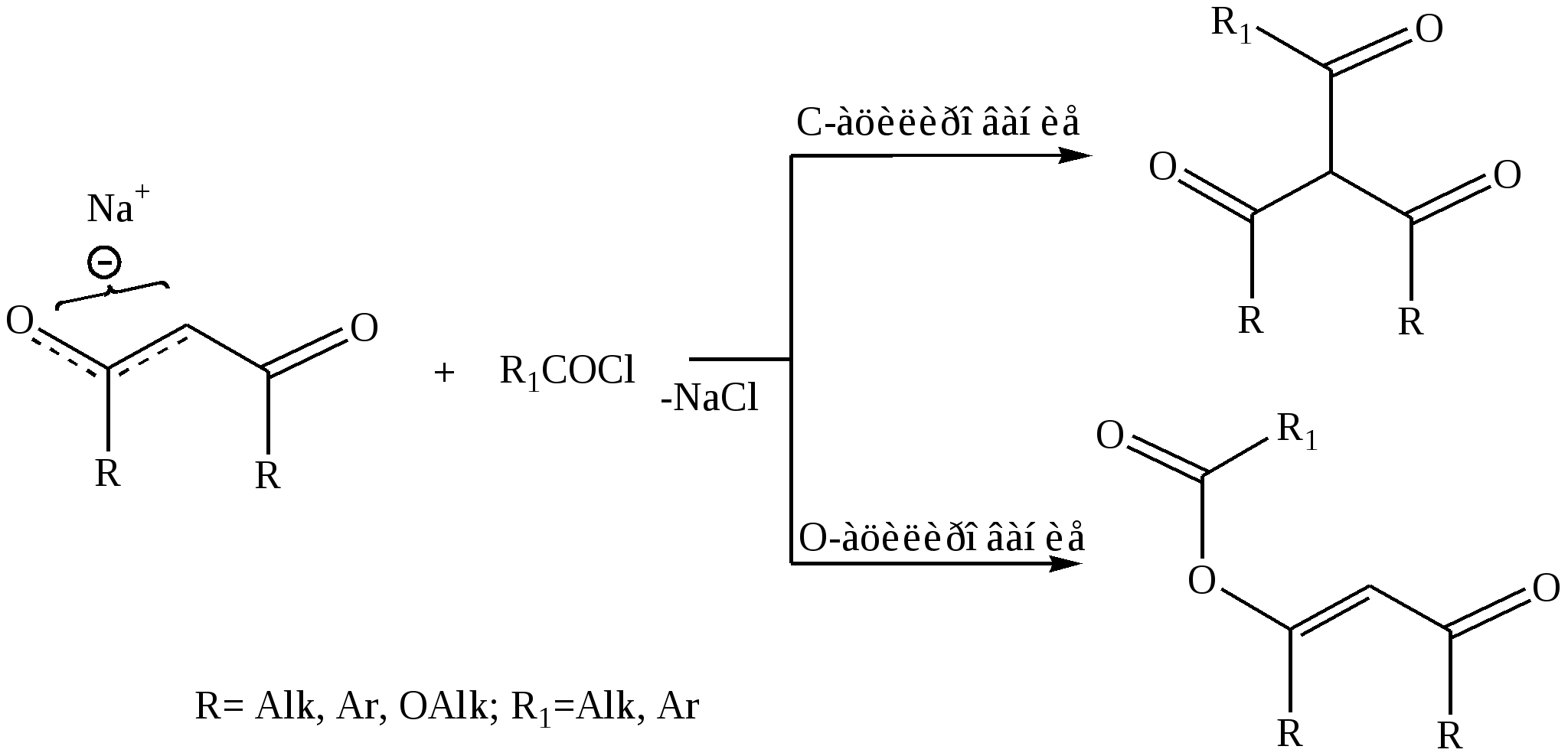 4. Экспериментальная часть Уксусно-этиловый эфир (этилацетат) Реактивы: уксусная кислота – 29 г (28 мл, 0,3 моль); этиловый спирт 95%-ный – 17,75 г (23 мл, 0,37 моль); серная кислота (d=1.84 г/мл) – 4,6 г (2,5 мл, 0,05 моль); карбонат натрия водный раствор; сульфат натрия безводный. Посуда: колба Вюрца на 100 мл; капельная воронка; холодильник Либиха; термометр; делительная воронка; приемники. В колбе Вюрца емкостью 100 мл осторожно при охлаждении смешивают 2 мл этилового спирта и 2,5 мл концентрированной серной кислоты. В горле колбы укрепляют капельную воронку, в которую помещают смесь 28 мл уксусной кислоты и 21 мл этилового спирта. Колбу соединяют с нисходящим холодильником, подставляют приемник и нагревают на воздушной бане до 1200С в течение 5 мин. В нагретую жидкость прикапывают из капельной воронки смесь с такой скоростью, с какой отгоняется образующийся этилацетат (одна капля в секунду). Процесс отгонки должен продолжаться 1,5-2 ч. После того как будет прибавлена вся смесь из капельной воронки, колбу Вюрца продолжают нагревать еще 10-15 мин. Затем нагревание прекращают, выключают и убирают нагревательный прибор. Дистиллят, находящийся в приемнике, выливают в делительную воронку и промывают раствором карбоната натрия для удаления примеси уксусной кислоты. Происходит вспенивание жидкости, вследствие выделения углекислого газа. Окончание нейтрализации проверяют с помощью универсальной индикаторной бумажки (среда должна быть щелочной). Нижний слой отделяют, а верхний эфирный слой (этилацетат) выливают в плоскодонную колбу и сушат над безводным сульфатом натрия 10-15 мин. Затем эфир отделяют от осушителя и перегоняют из колбы Вюрца с водяным холодильником на воздушной бане, собирая фракцию с температурой кипения 75-780С. Выход – 20 г (70%); nD20=1,3724. Уксусно-бутиловый эфир (бутилацетат) Реактивы: уксусная кислота – 8,1 г (7,73 мл, 0,135 моль); н-бутиловый спирт – 4,9 г (6,2 мл, 0,065 моль); серная кислота (d=1.84 г/мл) – 0,92 г (0,5 мл, 0,0094 моль); карбонат натрия. Посуда: круглодонная колба на 100 мл; колба Вюрца на 100 мл; холодильник Либиха; термометр; делительная воронка; приемник. В круглодонную колбу на 100 мл помещают 7,73 мл уксусной кислоты, 6,2 мл бутилового спирта и 0,5 мл концентрированной серной кислоты. Колбу соединяют с обратным холодильником и нагревают на воздушной бане в течение 1 ч. Затем колбу охлаждают и реакционную смесь выливают в стакан с 20 мл холодной воды. После этого серную кислоту и избыток уксусной кислоты нейтрализуют раствором карбоната натрия. Происходит вспенивание жидкости, вследствие выделения углекислого газа. Окончание нейтрализации проверяют с помощью универсальной индикаторной бумажки (среда должна быть щелочной). Бутилацетат отделяют от воды с помощью делительной воронки. Нижний слой отделяют, а верхний эфирный слой (бутилацетат) выливают в плоскодонную колбу и сушат над безводным сульфатом натрия в течение 5-10 мин. Затем бутилацетат отделяют от осушителя и перегоняют из колбы Вюрца с водяным холодильником на воздушной бане, собирая фракцию с температурой кипения 124-126 0С. Выход – 4,2 г (43%). Этиловый эфир муравьиной кислоты (этилформиат) |
