Ферменты и коферменты, заполнив таблицу
 Скачать 0.74 Mb. Скачать 0.74 Mb.
|
|
Напишите этапы синтеза данной жирной кислоты в организме. Установлено, что две наиболее распространенные мононасыщенные жирные кислоты - пальмитоолеиновая и олеиновая - синтезируются из пальмитиновой и стеариновой кислот. Двойная связь в молекулу указанных кислот вводится в микросомах клеток печени и жировой ткани при участии специфической оксигеназы и молекулярного кислорода. В этой реакции одна молекула кислорода используется в качестве акцептора двух пар электронов, одна пара из которых принадлежит субстрату (Ацил-КоА), а другая - НАДФН2: 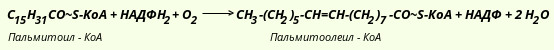
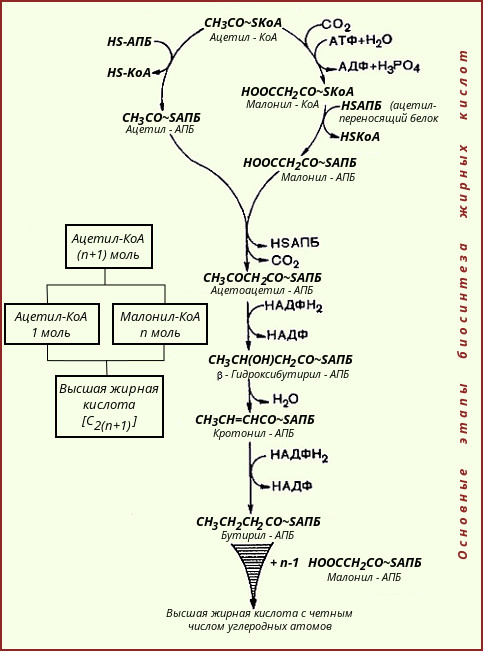 А затем см схему вопрос №6. 7.6 тема: -Кетоглутарат (последняя цифра 1,6) Ответ составьте по следующему плану:
a-кетоглутаратдегидрогеназа.
тиаминпирофосфат, липоевая кислота, КоА, НАД+, ФАД.
Восстановленная форма убихинона – убихинол – передаёт протоны и электроны на III комплекс дыхательной цепи.
На каждую пару электронов, переданных по клеточной дыхательной цепи, синтезируется три молекулы АТФ.
При аэробном распаде глюкозы: 1 этап – 8 АТФ. I комплекс: NADH-дегидрогеназа. Ингибиторы: ротенон и барбитураты (амитал, аминобарбитал, нембутал, веронал и др.)
При аэробном распаде глюкозы: 2 этап – 6 АТФ. II комплекс: FAD-зависимая сукцинатдегидрогеназа. Обратимый конкурентный ингибитор: малонат.
При аэробном распаде глюкозы: 3 этап –24 АТФ. III комплекс: QH2-дегидрогеназа. Ингибитор: Антимицин A.
Присутствие во внутренней митохондриальной мембране агентов (ионофоров), увеличивающих их проницаемость для Н+, разобщает окислительное фосфорилирование от процесса транспорта электронов, поскольку при этом нарушается генерирование электрохимического потенциала и, следовательно, синтез АТФ. ДНФ является липофильной слабой кислотой, поэтому легко проходит через мембрану (снаружи внутрь митохондрии), ослабляя естественный ток протонов, идущий в противоположном направлении. Путь транспорта электронов, не связанный с синтезом АТФ, называется свободным, нефосфорилирующим, окислением. При свободном окислении энергия не аккумулируется, а высвобождается в виде тепла. Это имеет физиологическое значение при охлаждении организма. Частичное разобщение окисления и фосфорилирования наблюдается при многих заболеваниях, так как митохондрии являются наиболее чувствительными клеточными органеллами к действию различных повреждающих факторов. Нарушение их структуры, приводящее к частичному или полному распаду внутренней митохондриальной мембраны, неизбежно будет способствовать обратному току протонов и нарушать энергопродукцию. Поэтому особое значение приобретает стабилизация митохондриальных мембран биоантиоксидантами (витаминами Е, А и аскорбатом) при любой патологии. В ряде случаев некоторые пункты фосфорилирования могут «выключатся» - такое состояние называется разобщением окислительного фосфорилирования - и в этом случае P/O снижается: для НАД-зависимых субстратов - ниже 3; для ФАД-зависимых субстратов - ниже 2-ух. И исходя из 1-го закона термодинамики в разобщенных митохондриях увеличивается теплообразование. (Это происходит за счет того, что та энергия электронов, которая должна была быть использована для синтеза АТФ в «выключенном» пункте фосфорилирования, рассеивается в виде тепла). Процесс разобщения окислительного фосфорилирования лежит в основе лихорадки, вызванной бактериями, вирусами и другими агентами. Разобщение резко усиливается при охлаждении организма. Работа митохондрий при «выключенных» всех пунктах фосфорилирования называется сопряженной, в противном, выше описанном случае, разобщенной и дыхание, при этом называется свободным. В качестве разобщителей окислительного фосфорилирования выступают слабые гидрофобные кислоты (ЖК), тиреоидные гормоны, лекарства (дикумарин, динитрофенол). ДЦ имеет механизмы шунтирования: сброс электронов и протонов по протяжению с НАД на цитохромы, или с НАД на межмембранные дегидрогеназы, на наружную мембрану и гладкую ЭПС (микросомальную цепь). Такой перенос характерен для печени. При воздействии какого-либо блокатора, возникает блок в 1-ом комплексе ДЦ, происходит накопление НАД.Н2 и становится реальной угроза гипоксии, печень может погибнуть. Чтобы этого не произошло происходит сброс НАД.Н2 с митохондрий ДЦ на микросомальную ДЦ через цитохром b5.
1. Синтез различных веществ. 2. Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу. 3. Механическое движение (мышечная работа). 8.17 Для закрепления теоретических знаний и овладения практическими навыками необходимо выполнить индивидуальное задание по теме «Гормоны» Задание 1 Больной Н. для лечения инфекционного полиартрита в течение длительного времени получал преднизолон. Почувствовав улучшение, больной самовольно прекратил прием препарата. Вскоре состояние больного резко ухудшилось. При обследовании у него установили снижение концентрации глюкозы в крови, снижение артериального давления. В моче снизилось содержание 17-кетостероидов. Почему произошло ухудшение состояния больного. Для ответа:
Схема регуляции секреции глюкокортикоидов такова. Кортиколиберин, образованный в гипофизотропной зоне гипоталамуса, поступает в гипофиз и вызывает выделение АКТГ. Последний доставляется кровью к коре надпочечника, где он стимулирует синтез и секрецию глюкокортикоидов. Введение АКТГ крысе уже через 2 мин приводит к увеличению уровня глюкокортикоидов. Секреция кортиколиберина в гипофизотропной зоне гипоталамуса находится под контролем автономной нервной системы. Кроме того, глюкокортикоиды по механизму отрицательной обратной связи подавляют его образование. Так, введение глюкокортикоидов в гипофизотропную зону вызывает снижение секреции АКТГ. Секреция АКТГ изменяется также при инъекции стероидов в аденогипофиз. Очевидно, что в гипофизотропной зоне и в гипофизе располагаются рецепторы глюкокортикоидов. Возможно, АКТГ способен и непосредственно ингибировать свою собственную выработку через так называемую короткую цепь обратной связи. При этом этот гормон влияет на функцию нейросекреторных клеток, вырабатывающих либерин.
При резкой отмене преднизолона количество собственных гормонов не успевает образоваться, чтобы обеспечить метаболизм, а глюкокортикостероиды отвечают за глюконеогенез, влияют на артериальное давление и уровень 17-кетостероидов. Задание 2 К врачу обратилась пациентка в возрасте 43 лет с жалобой на внезапно возникающие приступы, сопровождающиеся сильной слабостью, головной болью, чувством голода, нередко онемением в различных частях тела, скованностью в движениях и в то же время возбужденным состоянием. Приступы возникают натощак или через 2-3 часа после приема пищи, при выполнении физической нагрузки. После приема пищи приступ проходит. В крови увеличена концентрация С-пептида. Для какого заболевания характерны перечисленные симптомы? Для ответа:
Уровень глюкозы натощак, глюкозотолерантный тест, определение концентрации гликированного гемоглобина.
Гипогликемический синдром. Инсулинома — инсулинпродуцирующая опухоль, происходящая из бета-клеток островков Лангерганса, обуславливающая развитие гипогликемического синдрома натощак. В опухолевых клетках нарушена секреция инсулина: секреция не подавляется при снижении уровня глюкозы крови. В 85–90% случаев опухоль солитарная и доброкачественная, только в 10–15% случаев опухоли множественные, и крайне редко опухоли расположены вне поджелудочной железы (ворота селезенки, печень, стенка двенадцатиперстной кишки). Частота новых случаев опухоли — 12 на 1 млн человек в год, чаще всего опухоль диагностируется в возрасте от 25 до 55 лет. В клинике при инсулиноме характерны приступы гипогликемии, связанные с постоянным, независимым от уровня глюкозы в крови, выбросом инсулина. Частые приступы гипогликемии вызывают изменения в центральной нервной системе. У некоторых больных они напоминают эпилептический припадок, с которым госпитализируют в неврологическое отделение. Приступы гипогликемии прерываются приемом пищи, в связи с чем больные постоянно употребляют большое количество продуктов, главным образом углеводов, что способствует развитию ожирения. Диагностика инсулиномы базируется на выявлении классической и патогомоничной для нее триады Уиппла, а также типичной для гипогликемии клинической картины. «Золотым стандартом» на первом этапе диагностики гипогликемического синдрома и подтверждения эндогенного гиперинсулинизма является проба с голоданием. Проба проводится в течение 72 часов и считается положительной при развитии триады Уиппла. Начало голодания отмечают как время последнего приема пищи. Уровень глюкозы в крови на пробе оценивают исходно через 3 часа после последнего приема пищи, затем через каждые 6 часов, а при снижении уровня глюкозы в крови ниже 3,4 ммоль/л интервал между ее исследованиями сокращают до 30–60 мин. Скорость секреции инсулина при инсулиноме не угнетается снижением уровня глюкозы в крови. У находящихся в условиях голодания больных инсулиномой гипогликемия развивается в связи с тем, что количество глюкозы в крови натощак зависит от интенсивности гликогенолиза и глюконеогеноза в печени, а избыточная инсулиносекреция блокирует продукцию глюкозы. Рекомендуется вычислить инсулин/гликемический индекс. В норме он составляет не более 0,3, а при инсулиноме превышает 1,0. Концентрация С-пептида также резко повышена. Задание 3 Женщина 60 лет обратилась к врачу с жалобами на усталость, зябкость, сонливость, снижение памяти, увеличение массы тела. При обследовании выявлено умеренное ожирение, сухая, холодная кожа и одутловатое лицо. Щитовидная железа не пальпируется. Анализ крови показал: тироксин - 15 нмоль/л, ТТГ - 25 мЕ/л. Объясните причины изменения уровня этих гормонов в крови пациентки. Для ответа:
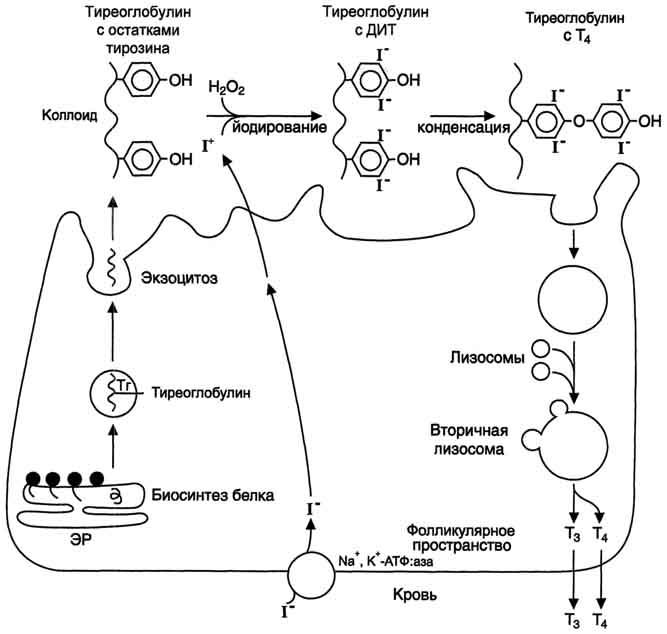 Схема синтеза йодтиронинов.Тиреоглобулин синтезируется на рибосомах, далее поступает в аппарат Гольджи, а затем во внеклеточный коллоид, где он хранится и где происходит йодирование остатков тирозина. Образование йодтиронинов происходит в несколько этапов: транспорт йода в клетки щитовидной железы; окисление йода; йодирование остатков тирозина; образование йодтиронинов; транспорт йодтиронинов в кровь. ЭР - эндоплазматический ретикулум; ДИТ - дийодтиронин; Тг - Тиреоглобулин; Т3- трийодтиронин, Т4- тироксин.
Скорость синтеза и секреции йодтиронинов регулируются гипоталамо-гипофизарной системой по механизму обратной связи. Стимулом для повышения секреции тиреолиберина и тиреотропина служит снижение концентрации йодтиронинов в крови.
Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов - результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов. Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и, вероятно, обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке. При физиологической концентрации йодтиронинов их действие проявляется в ускорении белкового синтеза, стимуляции процессов роста и клеточной дифференцировки. В этом отношении йодтиронины - синергисты гормона роста. Кроме того, Т3ускоряет транскрипцию гена гормона роста. У животных при дефиците Т3клетки гипофиза теряют способность к синтезу гормона роста. Очень высокие концентрации Т3 тормозят синтез белков и стимулируют катаболические процессы, показателем чего служит отрицательный азотистый баланс. Метаболические эффекты йодтиронинов относят в основном к энергетическому метаболизму, что проявляется в повышении поглощения клетками кислорода. Этот эффект проявляется во всех органах, кроме мозга, РЭС и гонад. В разных клетках Т3стимулирует работу Nа+,К+-АТФ-азы, на что затрачивается значительная часть энергии, утилизируемой клеткой. В печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жёлчных кислот. В печени и жировой ткани Т3повышает чувствительность клеток к действию адреналина и косвенно стимулирует липолиз в жировой ткани и мобилизацию гликогена в печени. В физиологических концентрациях Т3увеличивает в мышцах потребление глюкозы, стимулирует синтез белков и увеличение мышечной массы, повышает чувствительность мышечных клеток к действию адреналина. Йодтиронины также участвуют в формировании ответной реакции на охлаждение увеличением теплопродукции, повышая чувствительность симпатической нервной системы к норадреналину и стимулируя секрецию норадреналина. 9.6 Для закрепления теоретических знаний и овладения практическими навыками необходимо выполнить индивидуальное задание по теме «Роль Р-гликопротеина в развитии лекарственной устойчивости» Р-гликопротеин – является АТФ зависимым трансмембранным переносчиком и осуществляет транспорт различных цитотоксических веществ из клетки, т.е. их эффлюкс в просвет кишечника, снижая их всасывание. Большинство лекарственных средств (глюкокортикоиды, противоопухолевые препараты, макролиды, статины) являются субстратами Р-гликопротеина. Степень эффективности этих веществ зависит от полноценности функционирования Р-гликопротеина. Поиск селективных ингибиторов Р-гликопротеина являются основой индивидуализированной фармакотерапии. Выполните индивидуальное задание по следующему плану:
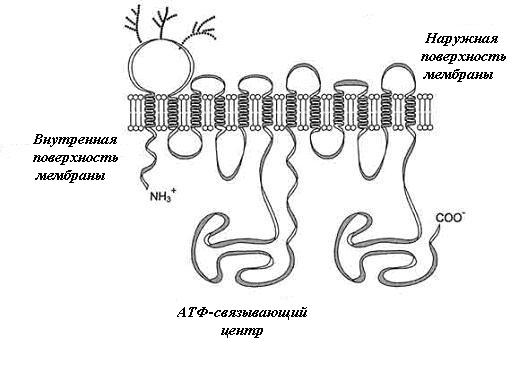 Р-гликопротеин – интегральный белок, имеющий 12 трансмембранных доменов, пронизывающих бислой цитоплазматической мембраны. N- и С-концы белка обращены в цитозоль. Участки Р-гликопротеина на наружной поверхности мембраны гликозилированы. Область между шестым и седьмым доменами имеет центры для присоединения АТФ и аутофосфорилирования
Интегральный белок (в мембране клетки)
Кодируемый полиморфным геном MDR1, может участвовать в функционировании гемато-энцефалического барьера, ограничивающего проникновение в ЦНС ряда лекарственных средств, включая антидепрессанты.
Субстратами гликопротеина-Р являются многие широко применяемые ЛС : сердечные глкикозиды, блокаторы медленных кальциевых каналов, ингибиторы ГМГ-КоА-редуктазы (статины). Рлакаторы Нггнстаминвых рецепторов, макролиды, некоторые шюстатики, противоретровирусные препараты и др. (ПРИЛОЖЕНИЕ 2). Ряд ЛС являются индукторами или ингибиторами гликопротеина-Р . Индукторы гликопротеина-Р способствуют угнетению всасывания ЛС (а также ускорению их выведения), приводя к снижению их концентрацию и ослаблению фармакологических эффектов. Напротив, ингибиторы гликопротеина-Р повышают всасывание ЛС (а также угнетают их выведение), что приводит к повышению их концентрации и повышению риска развития НЛР.
Множественная лекарственная устойчивость (МЛУ) – это невосприимчивость клеток или организма одновременно к целому ряду лекарственных препаратов разного химического строения и с разным механизмом действия. Она определяется как снижение чувствительности до такой степени, что клетки способны размножаться при воздействии на них препарата в критической или более высокой концентрации. Развитие МЛУ к используемым лекарственным препаратам является одним из проявлений фундаментального биологического свойства всех живых организмов – приспособления к изменениям условий внешней среды. Исследования последних лет показали, что молекулярные механизмы МЛУ множественны, и лекарственная устойчивость может определяться включением различных биологических систем, характеризующих разные этапы осуществления токсического действия химиопрепарата – от ограничения накопления лекарства внутри клетки до отмены программы гибели клеток, индуцируемой веществом. Нередко в клетке включается несколько защитных механизмов, однако чаще всего преобладает какой-то один механизм. Наиболее изученными механизмами, клиническая значимость которых при определенных формах новообразований установлена, являются: активация трансмембранных транспортных белков, выводящих различные вещества из клетки (в частности, Р-гликопротеина – Pgp); активация ферментов системы глутатиона, детоксифицирующей препараты; изменения генов и белков, контролирующих апоптоз и выживаемость клеток. Существует тесная взаимосвязь количественных изменений клеточной популяции и изменений их биологических свойств, одним из которых является лекарственная устойчивость. В активно размножающейся популяции всегда имеется некоторое количество лекарственно-устойчивых мутантов, которые практического значения не имеют, но по мере сокращения популяции, например под влиянием химиотерапевтических препаратов, изменяется соотношение между количеством лекарственно-чувствительных и лекарственно-устойчивых клеток. В этих условиях происходит размножение главным образом лекарственно-устойчивых клеток, их количество неуклонно возрастает. Итогом такой клональной селекции является поликлоновость опухоли и доминирование наиболее агрессивных клонов. В связи с этим целью настоящего обзора является обобщение данных по основным механизмам развития МЛУ опухолевых клеток при воздействии различных химиопрепаратов.
|
