Курс физики+вопросы. Физические основы механики элементы кинематики
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
AO O v'    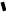  w wа   б F  Рис. 42 (а, б) кориолисова сила инерци Fk = 2m [v' w] (27.4)  основной закон динамики для неинерциальных систем отсчета: m' = F + Fи + Fц + Fk, где силы инерции задаются формулами (27.2) — (27.4). принципа эквивалентности гравитационных сил и сил инерции (принципа эквивалентности Эйнштейна): все физические явления в поле тяготения происходят совершенно так же, как и в соответствующем поле сил инерции, если напряженности обоих полей в соответствующих точках пространства совпадают, а прочие начальные условия для рассматриваемых тел одинаковы. II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ Гл. 8. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ8.1.Статистический и термодинамический методы исследования. Опытные законы идеального газа. T = 273,15 + t = const, то v = V/m=l/ З  акон Бойля - Мариотта акон Бойля - МариоттаpV = const (41.1) при Т = const, m = const Законы Гей-Люссака: 1.V=V0(1+t) р, m=const (41.2) 2.р=р0 (l+t) V, m=const (41.3) 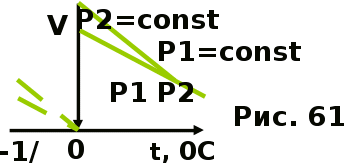 = 1/273,15 К-1  t=1/=-273,15 °С, Т=t+1/ V=V0(1+t)=[1+(T-1/)]=V0T p=p0(1+t)=[1+(T-1/)]=p0T V1/V2=T1/T2 (p,m=const) (41.4) p1/p2=T1/T2 (V,m=const) (41.5) З-н Авогадро: 22,4110-3 м3/моль NА=6,0221023 моль-1 З-н Дальтона: p = p1 + p2 + ... + pn 8.2. Уравнение Клапейрона-Менделеева ур-ние состояния f(p, V, Т) = 0,  З-ны Б.М. (41.1) и Г.- (41.5) 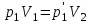 (42.1) (42.1)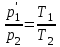 (42.2) (42.2)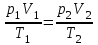 PV/T = В = const (42.3) PV = RT (42.4) ро = 1,013105 Па, Т0 = 273,15 К, Vm = 22,41103 м3/моль R = 8,31 Дж/мольК 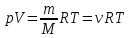 (42.5) (42.5)k = R/NA = 1,3810-23 Дж/К р = RT/Vm = kNAT/Vm= nkT где NA/Vm = n р = nkT (42.4) число Лошмидта: Nl = p0 /(kT0 ) = 2,681025 м-3 8.3.Основное уравнение мкт 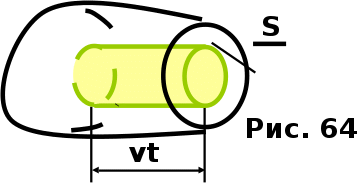 m0v (m0v) = 2 m0v, число молекул nSvt число ударов 1/6 nSvt. P = 2m0v1/6 nSvt =1/3nm0v2 St p =P/(St)=1/3nm0v2 (43.1) 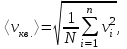 (43.2) (43.2)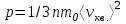 (43.3) (43.3)основное уравнение молекулярно-кинетической теории идеальных газов т.к. n=N/V, то pV = 1/3Nm0vкв.2 (43.4) 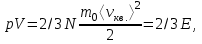 (43.5) (43.5)т.к. m=Nm0, то pV=1/3mvкв.2 Для одного моля газа m = М PVm = 1/3Mvкв.2, С другой стороны, по уравнению Клапейрона Менделеева pV = RT. Таким образом, RT = 1/3Mvкв.2, 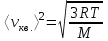 (43.6) (43.6)M=m0NА, 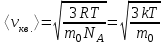 (43.7) (43.7)где k = R/NА постоянная Больцмана. при комнатной температуре средняя квадратичная скорость молекул кислорода 480 м/с, водорода 1900м/с. температуре жидкого гелия 40 и 160 м/с. используя (43.5) и (43.7), 0=E/N=m0vкв.2/2=3/2kT(43.8) 8.4.З-н Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения Т=const 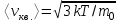  dN(v)/N =f(v)dv, 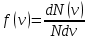 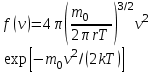 (44.1) (44.1)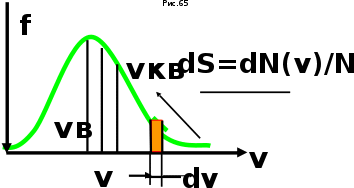 f(v) удовлетворяет условию нормировки 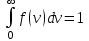 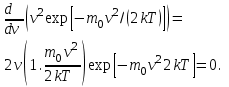  (44.2) (44.2)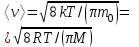 (44.3) (44.3) 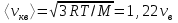 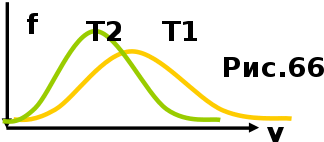 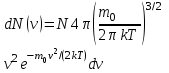 (44.4) т.к. = m0v2/2, то 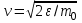 и и 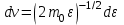 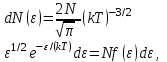 где dN() число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от до + d. функция распределения молекул по энергиям теплового движения 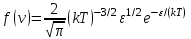 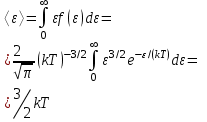 8.5.Барометрическая ф-ла. Распределение Больцмана 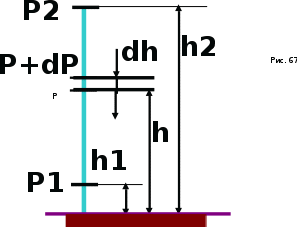 Разность давлений р и p+dp равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1м р - (p+dp) = gdh, dp = -gdh (45.1) из pV = (m/M) RT, = m/V = pM/(RT) подставив в (45-1), получим 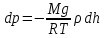 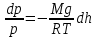 С изменением высоты от h1 до h2 ; давление изменяется от р1 до р2 (рис. 67), т. е. 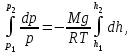 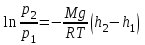 (45.2) (45.2)барометрическая формула где р — давление на высоте h. 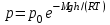 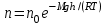 (45.3) Т.к. p = nkT, то 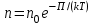 8.6.Среднее число столкновений и средняя длина свободного пробега молекул  l> = v z  z= nV, где V= d2 v z = nd2 v при учете движения других молекул z = 2nd2 v |
