Физиология. Лек 2 физиология бактерий лекция. Физиология микроорганизмов Микроорганизмам, как и всем живым существам, присущи процессы питания, дыхания, роста и размножения
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
|
Двухфазный рост бактерий. Диауксия. Рост без деления. бактерий. Двухфазный рост. У бактерий, способных использовать два различных источника углерода, наблюдают двухфазный рост (так называемая диауксия). Примером может служить рост кишечной палочки на среде с глюкозой и сорбитолом. • Для подобных микроорганизмов характерен начальный пик роста, в течение которого бактерии утилизируют только один углевод. • После исчерпания его запасов наступает стационарная фаза, в течение которой в культуре инициируются синтез ферментов и механизмы транспорта для утилизации второго углевода. • Если физиологические условия удовлетворительны, в бактериальной культуре начинается фаза вторичного экспоненциального роста, инициированная утилизацией второго углевода. Рост и размножение бактерий Рост бактерий – увеличение бактериальной клетки в размерах без увеличения числа особей в популяции. Многие факторы — детергенты, антибиотики, соли жёлчных кислот, УФ-облучение — задерживают деление клеток. В результате образуются длинные нитевидные формы, значительно превышающие по размерам исходные клетки. Размножение бактерий – процесс, обеспечивающий увеличение числа особей в популяции. Бактерии характеризуются высокой скоростью размножения. Рост всегда предшествует размножению. Бактерии размножаются поперечным бинарным делением, при котором из одной материнской клетки образуются две одинаковые дочерние. Процесс деления бактериальной клетки начинается с репликации хромосомной ДНК. В точке прикрепления хромосомы к цитоплазматической мембране (точке-репликаторе) действует белок-инициатор, который вызывает разрыв кольца хромосомы, и далее идет деспирализация ее нитей. Нити раскручиваются, и вторая нить прикрепляется к цитоплазматической мембране в точке-прорепликаторе, которая диаметрально противоположна точке-репликатору. За счет ДНК-полимераз по матрице каждой нити достраивается точная ее копия. Удвоение генетического материала – сигнал для удвоения числа органелл. В септальных мезосомах идет построение перегородки, делящей клетку пополам. Двухнитевая ДНК спирализуется, скручивается в кольцо в точке прикрепления к цитоплазматической мембране. Это является сигналом для расхождения клеток по септе. Образуются две дочерние особи. Размножение бактерий определяется временем генерации. Это период, в течение которого осуществляется деление клетки. Продолжительность генерации зависит от вида бактерий, возраста, состава питательной среды, температуры и др. Фазы размножение бактериальной клетки на жидкой питательной среде: 1) начальная стационарная фаза; то количество бактерий, которое попало в питательную среду и в ней находится; 2) лаг-фаза (фаза покоя); продолжительность – 3–4 ч, происходит адаптация бактерий к питательной среде, начинается активный рост клеток, но активного размножения еще нет; в это время увеличивается количество белка, РНК; 3) фаза логарифмического размножения; активно идут процессы размножения клеток в популяции, размножение преобладает над гибелью; 4) максимальная стационарная фаза; бактерии достигают максимальной концентрации, т. е. максимального количества жизнеспособных особей в популяции; количество погибших бактерий равно количеству образующихся; дальнейшего увеличения числа особей не происходит; 5) фаза ускоренной гибели; процессы гибели преобладают над процессом размножения, так как истощаются питательные субстраты в среде. Накапливаются токсические продукты, продукты метаболизма. Этой фазы можно избежать, если использовать метод проточного культивирования: из питательной среды постоянно удаляются продукты метаболизма и восполняются питательные вещества. 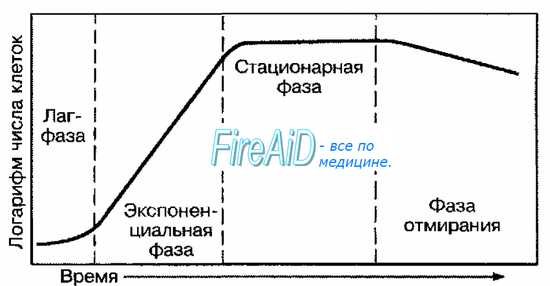 Оценка роста бактерий Количественную оценку роста обычно проводят в жидких средах, где растущие бактерии образуют гомогенную суспензию. Увеличение количества клеток устанавливают, определяя концентрацию бактерий в 1 мл, либо определяют увеличение клеточной массы в весовых единицах, отнесённых к единице объёма. Подсчёт микроорганизмов можно проводить непосредственно под микроскопом с использованием различных счётных камер (например, Петрова-Хаузера или Горяева). Кроме состава питательных сред, на которых развиваются бактерии, большое значение имеют условия культивирования и, прежде всего, температура, аэрация и концентрация водородных ионов в среде. В количественном отношении придерживаются простого правила: соотношение важнейших элементов, вводимых в воду, должно быть примерно таким же, как в бактериальной клетке (например, среднее соотношение углерод:азот:фосфор:сера:калий:кальций:магний:железо = 5:1:0,3:0,1:0,1:0,05:0,05:0,02. В граммах эти величины дают примерное содержание элементов на 1 л среды). Питательные среды Питательные среды являются основой бактериологических исследований. Они служат для выделения из исследуемого материала чистых культур микробов, для изучения их свойств. На питательных средах создаются оптимальные условия для размножения микроорганизмов. В состав сред должны входить вещества, необходимые для построения всех компонентов цитоплазмы, т.е. все источники роста живого организма. Сюда, в первую очередь, относятся источники азота, углерода, водорода и кислорода. Источник водорода и кислорода в питательных средах - вода. Источником азота служат органические соединения, которые получают из мяса, рыбы, плаценты, молока, яиц, крови. В результате гидролиза панкреатином или трипсином из этих продуктов получаются т.н. гидролизаты, содержащие большое количество аминокислот и пептонов, которые хорошо усваиваются большинством микроорганизмов. Нативный белок усваивают только некоторые микроорганизмы, имеющие экзопротеазы. Гидролизаты являются основой для приготовления сред для многих микроорганизмов. Источником углерода для патогенных микробов являются, главным образом, различные углеводы: моно- и дисахара, многоатомные спирты, органические кислоты и их соли. Потребность микроорганизмов в неорганических соединениях удовлетворяется прибавлением к питательной среде солей КН2РO4; К2НРO4 и др. Микроэлементы, выполняющие роль катализаторов химических процессов, необходимы в ничтожно малых количествах и поступают в питательную среду с пептоном, неорганическими солями и водой. Наряду с перечисленными органическими элементами, многие микроорганизмы нуждаются в факторах роста, т.е. в веществах, которые они сами не могут синтезировать. Факторы роста необходимо добавлять в питательные среды в готовом виде. К факторам роста относятся различные витамины, источником которых в питательных средах являются прибавленные к питательной среде продукты растительного и животного происхождения, содержащие в своем составе никотиновую, пантотеновую, парабензойную кислоты, витамины А, В, С и др. Питательные вещества микробами могут усваиваться только при определенной реакции среды, т.к. проницаемость оболочек микробных клеток изменяется в зависимости от рН среды. Требования, предъявляемые к питательным средам. 1. Питательные среды должны содержать необходимые для питания микробов питательные вещества. 2. Иметь реакцию рН, оптимальную для выращиваемого вида микроба. - 3. Питательные среды должны иметь достаточную влажность и вязкость, т.к. микробы питаются по законам диффузии и осмоса. 4. Обладать изотоничностью и иметь определенный окислительно-восстановительный потенциал (гН2). 5. Питательные среды должны быть стерильными, обеспечивая тем самым возможность выращивания чистых культур. Потребность в питательных веществах и физических условиях у различных видов микробов неодинакова, и этим исключается возможность создания универсальной питательной среды. По консистенции различают плотные и жидкие питательные среды. Плотные готовят на основе жидких посредством прибавления к ним клеевых веществ: агар-агара или желатина. Агар-агар (по-малайски - желе) - продукт растительного происхождения, добывается из морских водорослей. В воде агар-агар растворяется при температуре 80-86°С, затвердевает при 36-40 , и поэтому используется для уплотнения питательных сред для выращивания разных групп микроорганизмов при оптимальной для них температуре. Классификация питательных сред производится по их составу и назначению 1.По составу питательные среды делятся на простые и сложные Различают группу сред общего назначения - простых. К этой группе относят мясо-пептонный бульон (простой питательный бульон), мясо-пептонный агар {простой питательный агар), питательный желатин. Эти среды применяются для выращивания многих патогенных микробов. Среды общего назначения, или простые питательные среды, готовятся обычно из гидролизатов с добавлением пептона и хлористого натрия. Их используют также как основу для приготовления сложных сред. Также по составу выделяют белковые, безбелковые и минеральные среды. 2. По происхождению среды разделяют на искусственные и естественные (природные). Естественные питательные среды могут содержать компоненты животного (например, кровь, сыворотка, жёлчь) или растительного (например, кусочки овощей и фруктов) происхождения. 3.По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культивирования {универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные). Консервирующие питательные среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь, гипертонический раствор, глицериновый консервант с LiCl2, раствор цитрата натрия и дезоксихолата натрия. Среды обогащения для бактерий Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолевая среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+, теллурит К , антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др. Также по назначению различают среды элективные, специальные и дифференциально-диагностические. Среды элективные (селективные, избирательные, накопления, обогащения). Принцип создания элективных питательных сред основан на удовлетворении основных биохимических и энергетических потребностей того вида микроба, для культивирования которого они предназначены, или на добавление ингибиторов, подавляющих рост сопутствующей микрофлоры. Определенный состав и концентрация питательных веществ, микроэлементов, ростовых факторов при строго определённом значении pH или добавлении ингибиторов обеспечивают оптимальные условия для выращивания одного или нескольких видов микроорганизмов. При посеве на них материала, содержащего смесь различных микробов, раньше всего будет проявляться рост того вида, для которого среда будет элективной. Примером элективных сред являются желчный бульон, селенитовый бульон, среда Плоскирева – для выращивания микробов семейства кишечных, щелочная пептонная вода – для холерного вибриона. Желчный бульон. К МПБ добавляют 10-20% бычьей желчи. Желчь подавляет рост коков и воздушной флоры, но благоприятна для размножения сальмонелл. Селенитовый бульон. Состоит из фосфатного бульона с добавлением натриевой соли селенита, которая является ингибитором роста кокковой флоры, кишечной палочки, но не задерживает роста сальмонелл. Среда Плоскирева. Плотная среда, содержащая ингибиторы кишечной палочки, коков, но благоприятная для роста шигелл и сальмонелл, размножение которых не тормозится бриллиантовым зелёным и желчными солями. Пептонная вода. Содержит 1% пептона и 0,5% хлористого натрия. Среда является элективной для холерных вибрионов, т.к. они лучше других бактерий размножаются на “голодных средах”, особенно при щелочной реакции, потому что сами выделяют кислые продукты жизнедеятельности. Специальные среды. Необходимы для культивирования бактерий, не растущих на простых питательных средах. Для некоторых организмов к простым питательным средам необходимо добавлять углеводы, кровь и др. дополнительные питательные вещества. Примерами простых питательных сред являются сахарный бульон и сахарный агар для стрептококка (готовится соответственно из МПБ и МПА, к которым добавляется 0,5-2% глюкозы). Дифференциально-диагностические среды используют для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ. По своему назначению дифференциально-диагностические среды разделяют следующим образом: 1. Среды для выявления протеолитической способности микробов, содержащие в своем составе молоко, желатин, кровь и т.д. 2. Среды с углеводами и многоатомными спиртами для обнаружения различных сахаролитических ферментов. В состав дифференциально-диагностических сред, предназначенных для выявления сахаролитических свойств и окислительно-восстановительных ферментов, вводят индикаторы: нейтральную красную, кислый фуксин, бромтимоловый синий, водный голубой с розоловой кислотой (ВР). Изменяя свою окраску при различных значениях рН, индикатор указывает на наличие фермента и расщепление введённого в среду ингредиента. Примеры дифференциально-диагностических сред: Среда Эндо. Состоит из МПА с добавлением 1% лактозы и обесцвеченного сульфитом натрия основного фуксина (индикатор). Среда Эндо имеет слаборозовый цвет. Используется в диагностике кишечных инфекций для дифференциации бактерий, разлагающих лактозу с образованием кислых продуктов, от бактерий, не обладающих этой способностью. Колонии лактозопозитивных микробов (кишечная палочка) имеют красный цвет вследствие восстановления фуксина. Колонии лактозонегативных микроорганизмов - сальмонелл, шигелл и др. -бесцветны. К дифференциально-диагностическим средам относятся короткий и развёрнутый пёстрый ряд. Он состоит из сред с углеводами (среды Гисса), МПБ, молока, мясопептонной желатины. Среды Гисса готовятся на основе пептонной воды, к которой прибавляются химически чистые моно-, ди- или полисахариды (глюкоза, лактоза, крахмал и др.). Для обнаружения сдвигов рН в результате образования кислот и разложения углевода в среды прибавляют индикатор. При более глубоком расщеплении углеводов образуются газообразные продукты (СО2, СН4 и др.), которые улавливаются при помощи поплавков - маленьких пробирочек, опущенных в среду кверху дном. Среды с углеводами могут готовиться и плотными – с добавлением 0,5-1% агар-агара. Тогда газообразование улавливается по образованию пузырьков (разрывов) в столбике среды. На МПБ, входящем в пёстрый ряд, обнаруживают продукты, образующиеся при расщеплении аминокислот и пептонов (индол, сероводород). Сероводород обнаруживается путем помещения в МПБ после засева культуры полоски фильтровальной бумаги, пропитанной раствором уксуснокислого свинца. При расщеплении аминокислот, содержащих серу, выделяется сероводород, бумажка чернеет за счёт образования сернистого свинца. Для определения индола можно использовать сложный индикатор. Индол образуется при расщеплении триптофана, и его можно обнаружить при добавлении к культуре, выращенной на МПБ, этого индикатора. При наличии индола МПБ окрашивается в зеленый или синий цвет. В практических бактериологических лабораториях широко применяют микро- и экспресс-методы для ориентировочного изучения биохимических свойств микроорганизмов. Для этой цели существует множество тест-систем. Наиболее часто используют систему индикаторных бумаг (СИБ). СИБы представляют из себя диски фильтровальной бумаги, пропитанные растворами сахаров или других субстратов в сочетании с индикаторами. Такие диски опускают в пробирку с выросшей в жидкой питательной среде культурой. По изменению цвета диска с субстратом судят о работе фермента. Микро-тест системы для изучения идентификации энтеробактерий представлены одноразовыми пластиковыми контейнерами со средами, содержащими различные субстраты, с добавлением индикаторов. Посев чистой культуры микроорганизмов в такие тест-системы позволяет быстро выявить способность бактерий утилизировать цитраты, глюкозу, сахарозу, выделять аммиак, индол, разлагать мочевину, лизин, фенилаланин и т.д. Сухие среды. Питательный агар, а также основные дифференциально-диагностические среды выпускаются в настоящее время в виде сухих препаратов, содержащих все необходимые составные части. К таким порошкам нужно добавить только воду и сварить, а затем, после разливки, простерилизовать. Температура роста бактерий. Оптимальная температура роста патогенных для человека микроорганизмов совпадает в основном с температурой тела человека. В отдельных случаях температурный параметр может быть использован как простой способ селекции, например, виды Campylobacter лучше растут при температуре 42 0С, слишком высокой для роста большинства других патогенов. В зависимости от требований к температурному режиму бактерии разделяют на три группы: Мезофильные бактерии лучше всего растут в пределах 20-40 0С; к ним относят большинство патогенных для человека микроорганизмов. Термофильные бактерии лучше растут при 50-600С. Психрофильные бактерии предпочитают расти в интервале температур от 0 до 10 0С. Величина рН необходимая для роста бактерий. Установление и поддержание определённой величины рН (логарифм величины, обратной концентрации водородных ионов в молях на литр) имеет существенное значение для роста бактерий. Подавляющее большинство микроорганизмов хорошо растёт при нейтральном рН, равном 7,0. Актиномицеты и бактерии, разлагающие мочевину, предпочитают среды с более высоким рН, то есть слегка щелочные. Некоторые бактерии толерантны к кислой среде (например, лактобациллы). Кислые значения рН предпочитают грибы. |
