ИГЭС. Функции эозинофилов
 Скачать 357.91 Kb. Скачать 357.91 Kb.
|
|
В последние годы в клинической практике врачей различных специальностей все чаще встречаются заболевания и синдромы, сопровождающиеся высокой эозинофилией периферической крови. При этом особое внимание привлекают так называемые большие эозинофилии крови, при которых количество эозинофилов превышает 1500 в 1 мкл [1, 2, 3]. Длительная эозинофилия может приводить к патологическому состоянию, приобретающему черты отдельной нозологии. Авторы описывают этиологию, патогенез, клинику, диагностику и принципы лечения идиопатического гиперэозинофильного синдрома (ИГЭС) и реактивной эозинофилии. С практической точки зрения особые трудности представляют диагностика и лечение ИГЭС – тяжелого заболевания, требующего длительной терапии. 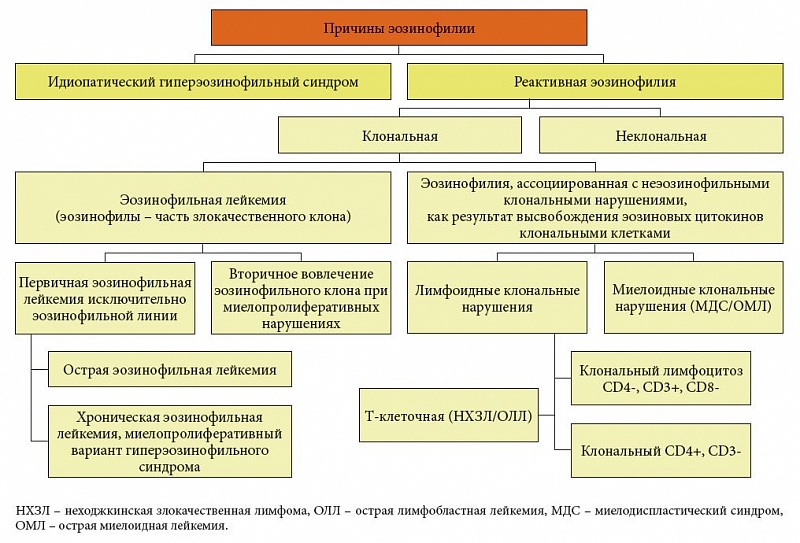 Рис. 1. Этиологическая классификация эозинофилии При эозинофилиях отмечается укорочение клеточных циклов на ранних этапах созревания эозинофилов, увеличивается митотический индекс, время генерации эозинофильных лейкоцитов сокращается в 3 раза, а время появления в кровотоке – в 2 раза. Кроме того, эозинофилы способны возвращаться в кровоток из тканей и длительно рециркулировать (Т1/2 – 44 ч) [4]. Функции эозинофилов Эозинофил как отдельный клеточный элемент впервые описал Пауль Эрлих (Paul Ehrlich) в 1879 г. Именно он применил кислый краситель эозин, названный в честь греческой богини утренней зари, для гистологической окраски крови и тканей. П. Эрлих показал, что эозинофилы составляют от 1 до 3% лейкоцитов периферической крови у здоровых индивидуумов. В течение последующих 40 лет накопилось много информации об эозинофилах: повышение числа клеток было связано с бронхиальной астмой и гельминтной инвазией. Кроме того, было установлено, что число эозинофилов в тканях животных значительно повышалось после анафилактической реакции. Это позволило предположить, что эозинофилы обеспечивают гиперчувствительность при анафилаксии. Эта гипотеза оставалась основным объяснением функции эозинофилов с начала XX века вплоть до 1980-х гг. Согласно современным представлениям, эозинофилы – это неделящиеся гранулоциты, которые, как и другие полиморфноядерные лейкоциты (ПМЯЛ), непрерывно образуются в костном мозге из единой стволовой клетки. Эозинофилопоэз и дифференцировку эозинофилов из клеток-предшественников регулируют Т-лимфоциты путем секреции колониестимулирующего фактора гранулоцитов и макрофагов (ГМ-КСФ), интерлейкина-3 (ИЛ-3) и интерлейкина-5 (ИЛ-5). Кроме того, ИЛ-5 и ГМ-КСФ активируют эозинофилы, индуцируя переход клеток из нормальной плотности в низкую (меньше 1,085). Продолжительность жизни эозинофилов составляет 10–12 дней. Покинув костный мозг, где они образуются и созревают в течение 3–4 дней, эозинофилы несколько часов циркулируют в крови (период их полужизни составляет 6–12 часов). Затем, подобно нейтрофилам, они покидают кровяное русло и уходят в периваскулярные ткани, главным образом в легкие, желудочно-кишечный тракт (ЖКТ) и кожу, где остаются в течение 10–14 дней. На каждый эозинофил периферической крови приходится примерно 200–300 эозинофилов в костном мозге и 100–200 в других тканях. По данным светооптического исследования, диаметр эозинофилов составляет 12–17 мкм; они обычно несколько крупнее, чем нейтрофилы. В отличие от зрелых полиморфноядерных лейкоцитов, ядра которых имеют около четырех долек, ядра эозинофилов, как правило, состоят из двух долек, связанных между собой нитью. Основным своеобразием их цитоплазмы является наличие двух типов специфических гранул (больших и малых), которые имеют красный или оранжевый цвет. Даже в плохо окрашенных мазках эозинофилы можно отличить от гранул нейтрофилов, так как они более многочисленны и отчетливо крупнее. Большие гранулы содержат уникальные для эозинофилов основные протеины: большой основной протеин (БОП), эозинофильный катионный протеин (ЭКП), эозинофильную пероксидазу (ЭПО), эозинофильный нейротоксин (ЭН), ранее называвшийся эозинофильным протеином Х, и гомолог БОП. Малые гранулы содержат ферменты арилсульфатазу В и кислую фосфатазу, также обнаруживаемые в азурофильных гранулах нейтрофилов. Лизофосфолипаза В (кристаллы Шарко – Лейдена) – фермент мембран эозинофилов – не играет важной роли в патогенезе болезней и не имеет диагностической ценности. Функции эозинофилов точно неизвестны. Эозинофилы обладают многими функциями других циркулирующих фагоцитов, таких как ПМЯЛ и моноциты. Хотя эозинофилы способны к фагоцитозу, они уничтожают находящиеся внутри них бактерии менее эффективно, чем нейтрофилы. Прямых доказательств того, что эозинофилы убивают паразитов in vivo, нет, но они токсичны для гельминтов in vitro, и гельминтозы часто сопровождаются эозинофилией. Эозинофилы могут модулировать реакции гиперчувствительности немедленного типа, инактивируя медиаторы, высвобождаемые тучными клетками (гистамин, лейкотриены, лизофосфолипиды и гепарин). БОП и ЭКП токсичны для некоторых паразитов и клеток млекопитающих. ЭН способен серьезно повреждать миелиновые нервные волокна. БОП и ЭКП связывают гепарин и нейтрализуют его противосвертывающую активность. ЭПО в присутствии перекиси водорода и галогенов генерирует окислительные радикалы. Длительная эозинофилия иногда приводит к повреждению тканей, механизмы которого пока не ясны. Степень повреждения связана с эозинофильной инфильтрацией тканей, продолжительностью эозинофилии и степенью активации эозинофилов. Наибольшее повреждающее действие эозинофилов обнаружено при состояниях, подобных синдрому Черджа – Стросс и идиопатическому гиперэозинофильному синдрому. Эозинофилы в нормальном мазке крови составляют от 1 до 5% лейкоцитов. В абсолютных числах за норму принято 50–250 эозинофилов в 1 мкл (50–250 × 106/л) периферической крови. Критическим уровнем, который указывает на патологический процесс, связанный с увеличением числа эозинофилов, является уровень клеток, превышающий 450 в 1 мкл. Выделяют 3 степени эозинофилии: легкую – 400–1500 клеток в 1 мкл, умеренную – 1500–5000 клеток в 1 мкл, тяжелую – больше чем 5000 клеток в 1 мкл. Многие гематологи считают эозинофилию умеренной при наличии 10–15% эозинофилов в периферической крови; выраженной, если их количество превышает 15%; а состояния, при которых количество эозинофилов больше 15–20%, предложено называть «большими эозинофилиями крови». Они обычно сочетаются с увеличением общего количества лейкоцитов. Абсолютное число эозинофилов в периферической крови у здоровых людей варьирует в пределах 0–0,45 × 109/л. Количество эозинофилов обратно пропорционально возрасту человека (у новорожденных детей их больше всего). Суточные колебания числа эозинофилов находятся в обратной зависимости от уровня кортизола в плазме, причем максимум приходится на ночные часы, а минимум – на утренние. В различных клинических ситуациях активация эозинофилов может происходить по разным, пока еще недостаточно изученным механизмам, и результаты этой активации могут носить как защитный (в большей или меньшей степени) характер, например, при гельминтозах, аллергических болезнях, так и явно патологический (при гранулематозных процессах). Изначально, в ситуациях с нормальной реактивностью, основная функция эозинофилов заключается в ограничении аллергических процессов: эозинофилы препятствуют их генерализации путем утилизации медиаторов аллергического воспаления и локализации воспалительного ответа. Однако при патологии эта мера защиты выходит за рамки биологической целесообразности и начинает приобретать черты того или иного заболевания [5]. Этиология и патогенез эозинофилии С точки зрения этиологии эозинофилии разделяют на две большие группы: идиопатический гиперэозинофильный синдром и реактивную эозинофилию (рис. 1). Реактивная эозинофилия может иметь клональные (злокачественные) и неклональные (вторичные) характеристики [6]. Причинами неклональной (реактивной) эозинофилии (10−40% от общего количества лейкоцитов) наиболее часто являются [6]:
Известные на сегодняшний день механизмы формирования эозинофилий периферической крови – антителозависимый хемотаксис, развивающийся при паразитозах (IgE- или IgG-антитела); иммунный, опосредованный через IgE (характерен для аллергии); ответ на эозинофильный хемотаксический фактор, выделяемый некоторыми опухолями; собственно опухолевая эозинофилия (лейкоз) – не позволяют создать целостного представления о патогенезе данного феномена при патологических процессах разного генеза [3, 4, 7]. Исследованиями последних лет было показано, что эозинофил является одной из наиболее агрессивных эффекторных клеток воспаления. Эозинофильные гранулы служат источником большого количества цитотоксических продуктов, повышенное содержание которых обусловливает формирование высокого микробицидного потенциала, реализуемого как в отношении инородных субстанций, так и окружающих тканей [1, 8–11]. Однако в современной литературе эозинофильный гранулоцит принято рассматривать не только в качестве активного участника развития аллергических заболеваний и противогельминтного иммунитета, но и как важный фактор поддержания тканевого и иммунологического гомеостаза. Эозинофилы обладают способностью секретировать широкий спектр биологически активных веществ, экспрессировать на своей поверхности разнообразные рецепторные структуры и адгезивные молекулы. Лейкоциты эозинофильного ряда за счет секреции иммунорегуляторных молекул (интерлейкина-6 (ИЛ-6), интерлейкина-10 (ИЛ-10), интерлейкина-2 (ИЛ-2), интерферона-гамма (ИФН-гамма)) участвуют в регуляции функций иммунокомпетентных клеток. Вместе с тем эозинофилы принимают участие в процессах фагоцитоза, клеточной репарации, презентации антигена, воспаления, реализации врожденного и приобретенного иммунитета, свертывания крови и др. [4, 9, 10, 12]. Основным источником цитокинов в организме являются Т-лимфоциты-хелперы (Th). Активация Th-1-лимфоцитов, продуцирующих ИЛ-2, ИЛ-3, ИФН-гамма и фактор некроза опухолей альфа (ФНО-альфа), приводит к запуску клеточного иммунного ответа. Формирование же иммунного ответа по гуморальному типу происходит при доминирующем влиянии Th-2-цитокинов – интерлейкина-4 (ИЛ-4), ИЛ-5, ИЛ-6, интерлейкина-9 (ИЛ-9) и др. [13–19]. Согласно современным представлениям, именно нарушение баланса продукции цитокинов Th-1/Th-2 может иметь важное патогенетическое значение в развитии многих заболеваний [20–24]. Особое влияние на процессы пролиферации, дифференцировки и активации лейкоцитов эозинофильного ряда оказывают медиаторы, вырабатываемые преимущественно Th-2-лимфоцитами [9, 25, 26]. Так, ключевым медиатором, модулирующим функциональную активность эозинофилов, является ИЛ-5 (эозинофилопоэтин), который относится к группе провоспалительных Th-2-цитокинов. ИЛ-5, первоначально названный фактором роста II В-клеток, избирательно стимулирует образование эозинофилов из их коммитированного предшественника колониеобразующей единицы эритроидного ряда (КОЕ-Э). ИЛ-5 наряду с ИЛ-3 и ГМ-КСФ активирует их дегрануляцию и высвобождение цитотоксичных протеинов, регулирует экспрессию интегриновых молекул (CD11b, СD18), приводящих к увеличению циркулирующих эозинофилов, и посредством ингибирования апоптотической гибели лейкоцитов эозинофильного ряда пролонгирует время их пребывания в кровотоке [9, 25, 27–29]. Антагонистом ИЛ-5 в регуляции процессов программированной гибели эозинофилов является интерлейкин-12 (ИЛ-12) [27, 30]. Хемокины и эотаксины, выделяемые эндотелием, эпителием, моноцитами и Т-лимфоцитами, соединяются с хемокиновым рецептором-3 эозинофилов, что приводит к миграции последних в ткани. После активации эозинофилы экспрессируют высокоаффинный Fc-рецептор к IgE, IgG и компонентам комплемента, взаимодействие которых способствует высвобождению из эозинофильных гранул токсических продуктов и провоспалительных цитокинов: пероксидазы, коллагеназы, катионного протеина, нейротоксина, лейкотриенов, компонента комплемента С4 и т.д. В дальнейшем эозинофилы подвергаются апоптозу или некрозу и фагоцитируются макрофагами. Поглощение апоптированных эозинофилов предотвращает выделение содержащихся в них тканетоксичных веществ. Это также приводит к высвобождению из макрофагов антивоспалительных цитокинов (трансформированный ростковый фактор-бета, ИЛ-10, простагландин Е2). Когда же эозинофилы подвергаются некрозу, высвобождается их тканетоксичное содержимое (катионный белок, ферменты, липиды, нейротоксины). Фагоцитоз некротизированных эозинофилов макрофагами приводит к высвобождению провоспалительных цитокинов (тромбоксан В2 и ГМ-КСФ). По этой причине при лечении эозинофилии применяют препараты, индуцирующие именно апоптоз эозинофилов (глюкокортикостероиды, циклоспорин) [6]. Несмотря на то что эозинофилы в основном демонстрируют две главные функции – модуляцию реакций гиперчувствительности немедленного типа и деструкцию паразитов (в первую очередь гельминтов), персистенция эозинофилии в периферической крови может приводить к эндотелиальному и эндокардиальному повреждению вследствие внутрисосудистой дегрануляции этих клеток. Цитолитические энзимы, содержащиеся в гранулах эозинофилов, повреждая эндотелиальные клетки всего организма, могут обусловливать развитие тромбозов или эндокардиального фиброза [31]. Наиболее часто больные с эозинофилией выявляются в практике пульмонологов и аллергологов [3, 7, 10]. Однако эозинофилия не является редкостью и при заболеваниях сердца и сосудов (системные васкулиты) [22, 32]. Весьма часто вышеназванный синдром встречается у больных с паразитарными (описторхоз, трихинеллез, шистосомоз, филяриоз и др.), грибковыми (аспергиллез) и вирусными (гепатиты А, В и С, инфекционный мононуклеоз) заболеваниями [2, 3, 23, 24, 33–35]. Кроме того, гематологи и онкологи весьма часто сталкиваются с проблемой трактовки причин возникновения синдрома эозинофилии у больных с неопластическими процессами системы крови, происходящими из клеток-предшественников как лимфо-, так и миелопоэза (острый миелолейкоз, лимфогранулематоз, острый лимфобластный лейкоз, эозинофильная лейкемия) [2, 3, 7, 36–38]. Прием лекарственных препаратов также может привести к развитию эозинофилии [1, 7, 8, 10, 39–41]. Описаны генетически детерминированные формы эозинофилии и идиопатический вариант ее возникновения [1, 22, 37]. Клиническая картина ИГЭС Идиопатический гиперэозинофильный синдром характеризуется длительным повышением числа эозинофилов периферической крови и инфильтрацией эозинофилами многих органов и тканей, что и обусловливает клиническую картину мультиорганного повреждения. ИГЭС – редкое заболевание неизвестной этиологии, впервые описанное в 1968 г. Термин «идиопатический гиперэозинофильный синдром» предложен Чесидом и соавт. в 1975 г. Эмпирически ИГЭС включает:
Идиопатический гиперэозинофильный синдром представляет собой диагноз исключения и ставится в том случае, если причину ИГЭС выяснить невозможно. Недавние исследования продемонстрировали, что так называемый ИГЭС представляет собой значительную группу гетерогенных нарушений, которые могут являться результатом пролиферации лимфоцитов или самих эозинофилов. ИГЭС встречается у мужчин чаще, чем у женщин (9:1), начинается между 20 и 50 годами. У детей этот синдром также не редкость. Мальчики болеют чаще девочек, их соотношение составляет 4:1. У детей ИГЭС может ассоциироваться с трисомией 8-й или 21-й хромосомы [6]. Клиническая картина синдрома проявляется такими неспецифическими симптомами, как общее недомогание, анорексия, потеря массы тела, периодические боли в животе, ночная потливость, кашель (как правило, непродуктивный), мышечные боли, ангионевротический отек, крапивница, повышение температуры тела. Частота поражения органов различна, гематологический синдром встречается у 100% больных, поражение сердца – у 58%, кожные проявления – у 56%, поражение нервной системы – у 54%, легочный синдром – у 49%, поражение печени – у 30%, гастроинтестинальные симптомы – у 23% [43]. Ключевую роль в постановке диагноза играет подсчет числа лейкоцитов и определение формулы крови. Так, число лейкоцитов у отдельных больных повышается до 90 000 и более, наблюдается выраженная эозинофилия, составляющая более 50% от общего количества лейкоцитов, что всегда побуждает исключать лейкоз. Высокое содержание клеток белой крови приходится на зрелые формы эозинофилов, однако у части больных появляются и клетки-предшественники эозинофилов. Исследование костного мозга демонстрирует его обогащение как зрелыми формами эозинофилов, так и их предшественниками. Хромосомных и цитогенетических изменений при ИГЭС не описано. Прогностически неблагоприятным признаком считается поражение сердца, так как это может стать причиной инвалидности, а при особенно тяжелых формах патологического процесса – непосредственной причиной смерти пациента. В клинической картине можно выделить три фазы поражения миокарда. Начальная стадия описывается как стадия острого некроза; интермиттирующая стадия, следующая за некротической, характеризуется образованием внутрисердечных тромбов, которые формируются на месте развившегося ранее некроза; наконец, третья стадия – фибротическая. Острая стадия некроза миокарда возникает в первые полтора месяца от развития гиперэозинофильного синдрома. Повреждение эндомиокарда происходит вследствие его инфильтрации лимфоцитами и эозинофилами; из гранул последних выделяется значительное число веществ, приводящих к некрозу кардиомиоцитов и формированию асептических микроабсцессов миокарда. На этой стадии заболевания клинические проявления минимальны, поэтому только произошедшая тромбоэмболия и активный поиск ее источника могут выявить признаки повреждения миокарда, наступившего вследствие эозинофильной инфильтрации эндомиокарда и развившегося некротического процесса. Начальные проявления эозинофильной инфильтрации могут подтверждаться биопсией эндомиокарда, тогда как эхокардиография и другие методы диагностики поврежденного миокарда малоспецифичны и малочувствительны. На второй стадии происходит формирование тромбов на поврежденном эндокарде. Третья стадия обусловлена воздействием белков эозинофилов на эндокард и характеризуется прогрессирующим фиброзом с вовлечением клапанов, укорочением хорд, формированием митральной и трикуспидальной недостаточности, развитием рестриктивной кардиомиопатии. Клиническими проявлениями этой стадии могут быть одышка, боль в области сердца, лево- и правожелудочковая недостаточность, шумы регургитации [43]. При проведении эхокардиографии обнаруживаются утолщение створок митрального и трикуспидального клапанов, утолщение эндокарда, внутрисердечные тромбы, наблюдается нарушение диастолической функции желудочков [44]. Описана атриовентрикулярная блокада высокой степени, проявляющаяся синкопальными состояниями у больной с локальным истончением межжелудочковой перегородки, выявленным при проведении эхокардиографии [45]. Неврологические симптомы у больных с ИГЭС могут возникнуть вследствие тромбоэмболии сосудов головного мозга, а также проявиться клиническими симптомами энцефалопатии или периферической невропатии. Церебральная тромбоэмболия возникает вследствие заноса тромба из полости сердца и проявляется в виде инсульта или же преходящих ишемических эпизодов. Терапия антикоагулянтами, как правило, не приносит желаемого эффекта, так как эмболии могут рецидивировать, несмотря на проводимую терапию. Энцефалопатия проявляется изменениями в сфере сознания, снижением памяти, возможно развитие атаксии. У некоторой части больных появляются признаки поражения моторных нейронов, о чем свидетельствует возрастающий мышечный тонус, положительный рефлекс Бабинского. Периферическая невропатия возникает почти у каждого второго больного с ИГЭС в результате токсического влияния эозинофильных белков, освобождающихся при дегрануляции эозинофилов, и проявляется в виде изменения чувствительности и атрофии мышц. Тяжесть поражения периферической нервной системы варьирует от нетяжелых невропатий до параплегии с восстановлением функций на фоне лечения преднизолоном [46]. Патологические изменения со стороны кожных покровов являются достаточно частой клинической проблемой у больных с ИГЭС. Больные обращаются по поводу ангионевротических отеков, уртикарных и эритематозных высыпаний, образования зудящих папул и узелков. В основе возникновения кожных симптомов лежит периваскулярная инфильтрация эозинофилами, в меньшей степени нейтрофилами. Биопсия выявляет периваскулярные инфильтраты, содержащие эозинофилы, нейтрофилы, мононуклеары, признаки васкулита отсутствуют. Реже наблюдаются язвы слизистых носа, рта, глотки, пищевода, желудка [47]. При биопсии обнаруживаются неспецифические изменения в виде смешанных инфильтратов без эозинофилов, иногда микротромбы. Развитие кожных симптомов, таких как ангионевротический отек, уртикарные высыпания, относится к числу признаков, которые свидетельствуют о благоприятном течении болезни. Они достаточно быстро регрессируют при назначении терапии глюкокортикостероидами. Больные с симптомами ринита при гиперэозинофильном синдроме могут иметь назальную эозинофилию, полипы при отсутствии аллергологического анамнеза, отрицательных кожных тестах, нормальном уровне IgE и отсутствии непереносимости аспирина. Изменения, наблюдаемые со стороны органов дыхания, разнообразны по своим клиническим проявлениям. Больные часто жалуются на появление непродуктивного кашля, одышку, но бронхиальная астма не является характерным признаком для больных с ИГЭС. При рентгенологическом исследовании лишь у 25% больных выявляются инфильтраты, возникающие вследствие миграции эозинофилов в паренхиму легких. Возможно развитие легочного фиброза, особенно у больных с эндокардиальным фиброзом [43]. Эозинофильный гастрит, эозинофильный энтероколит, хронический активный гепатит, эозинофильный холангит и синдром Бадда – Киари вследствие обструкции печеночных вен являются результатом эозинофильного поражения ЖКТ [43]. Диагностика эозинофилии Как упоминалось выше, постановка диагноза ИГЭС представляет значительную сложность, поскольку ИГЭС является диагнозом исключения и ставится в том случае, если причину ИГЭС выяснить невозможно. Поэтому, согласно этиологической классификации, необходимо исключить реактивные эозинофилии (клональные и неклональные). Учитывая разнообразие патологий, при которых наблюдается эозинофилия, а также тяжесть осложнений, для дифференциальной диагностики реактивных эозинофилий разработан диагностический алгоритм, который включает ряд лабораторных и клинико-инструментальных исследований. При выявлении легкой и среднетяжелой эозинофилии используются следующие лабораторные исследования: анализ кала на наличие цист, яиц и фрагментов паразитов, определение серологических маркеров паразитарных инфекций, титра изогемагглютининов, уровней IgM и IgE; исключение диффузных заболеваний соединительной ткани: обнаружение антинуклеарных антител, антител к двухцепочечной ДНК, антинейтрофильных цитоплазматических антител (АНЦА). Для диагностики поражений пищеварительного тракта определяют серологические маркеры вирусных гепатитов, молочный преципитин; с целью дифференциальной диагностики с синдромом раздраженного кишечника определяют скорость оседания эритроцитов (СОЭ), проводят эндоскопию, биопсию слизистой оболочки кишки, радиологические исследования органов брюшной полости; рентгенографию органов грудной клетки; биохимическое исследование крови для определения печеночной и почечной функций. С целью исключения возможных органных поражений в объем обследования включают эхокардиографию, электрокардиографию, определение концентрации кардиального тропонина Т в сыворотке крови. У некоторых пациентов проводится биопсия печени; исследуются функциональные легочные тесты, бронхоальвеолярный лаваж; осуществляются неврологическое обследование, включающее осмотр, электроэнцефалографию, исследование глазного дна, нервной проводимости, радиологическое исследование головного мозга. При персистирующей тяжелой эозинофилии используются методы определения клональности (иммунофенотипирование, цитогенетическое исследование костного мозга) [48]. Дифференциальная диагностика проводится с паразитарными и грибковыми заболеваниями, острой эозинофильной лейкемией, синдромом Черджа – Стросс. Лечение ИГЭС Целями лечения больных ИГЭС являются увеличение продолжительности и качества жизни, достижение ремиссии, снижение риска обострений, предотвращение необратимого повреждения жизненно важных органов, уменьшение риска развития побочных эффектов лечения. Пациента с ИГЭС госпитализируют для уточнения диагноза, оценки прогноза и подбора лечения, а также при обострении заболевания и развитии осложнений. Лечебная программа заключается в назначении глюкокортикостероидов (ГКС), винкристина, гидроксимочевины и интерферона-альфа, которые могут замедлить прогрессирование болезни [8]. Кроме того, в некоторых исследованиях продемонстрирована эффективность внутривенного введения антител к ИЛ-5 (меполизумаб (mepolizumab)), что позволяло снизить дозу системных ГКС. При сердечно-сосудистых осложнениях могут потребоваться интенсивная терапия и хирургическое вмешательство. В некоторых случаях при проведении лечения необходима консультация смежных специалистов. Так, проведение интенсивной терапии, любое изменение лечения требует консультации гематолога, появление или усугубление кожных проявлений – дерматолога, при отсутствии эффекта лечения неврологических проявлений или развитии новых нужна консультация невролога, при отсутствии динамики легочного процесса или наличии отрицательных изменений – пульмонолога, при развитии или ухудшении поражений сердца – кардиолога, при появлении или ухудшении состояния ЛОР-органов – ЛОР-врача. Продолжительность утраты пациентом трудоспособности при ИГЭС зависит от тяжести заболевания. В случае госпитализации она может составлять 30–90 дней. Дальнейшее ведение пациента и его амбулаторное наблюдение должны осуществлять специалисты, обладающие опытом лечения данного заболевания. Даже на фоне активного лечения возможно развитие угрожающих жизни состояний, требующих срочной госпитализации, при этом стационар должен быть многопрофильным, а его сотрудники – обладать соответствующим опытом. Прогноз при идиопатическом гиперэозинофильном синдроме относительно благоприятный. Проводимое лечение позволяет значительно снизить смертность пациентов. Современные клинические наблюдения демонстрируют 10-летнюю выживаемость более 70% больных. |
