Лпз4. ЛПЗ 4 (1)-1. Геохимия морей и океанов
 Скачать 30.2 Kb. Скачать 30.2 Kb.
|
|
Медико-профилактический факультет ОрГМУ, 2021-2022 учебный год Занятие № 4 ТЕМА: «Геохимия морей и океанов» Вопросы для самоподготовки. Океаны и моря, их значение для человечества. Загрязнение морей и океанов. Осадки мирового океана. Солевой состав гидросферы. Взаимосвязь жидкой и газовой оболочек земли. Защита водной среды от загрязнения. Практическая часть Определение массовой концентрации общего железа. Определение содержания кальция и магния. Определение содержания хлоридов. Определение карбонат и гидрокарбонат - ионов при их совместном присутствии. Литература дополнительная: Никитин Д.П., Новиков Ю.В., Окружающая среда и человек. М. Высшая школа, 1980. Лозановская и др. Экология и охрана биосферы при химическом загрязнении. М. Высшая школа, 1998. Андруз Дж. И др. Введение в химию окружающей среды. М. Мир, 1999. Корте Ф. и др. Экологическая химия. М Мир, 1997. Химия окружающей среды. (под ред. Дж. О.М. Бокриса. И. Химия, 1982. Лабораторная работа Практическая работа №1 Определение массовой концентрации общего железа с роданидом Метод основан на взаимодействии в сильнокислой среде железа и роданида, с образованием окрашенного в красный цвет комплексного соединения роданового железа. Интенсивность окраски пропорциональна концентрации железа. Чувствительность метода 0,05 мг/л железа. Реактивы и оборудование Колбы мерные, пипетки мерные, стеклянные палочки, персульфат аммония, роданид аммония или калия, концентрированнаясоляная кислота, вода дистиллированная. Ход работы В пробирку наливают 10 мл исследуемой воды, вносят 2 капли концентрированной соляной кислоты и несколько кристаллов персульфата аммония и 0,2 мл роданида аммония или калия. После внесения каждого реактива содержимое пробирки перемешивают. Приближенно массовую концентрацию определяют в соответствии с таблицей Таблица 3 – Шкала определения массовой концентрации железа
По интенсивности полученного окрашивания судят о количестве содержащегося железа. Приготовление раствора роданистого аммония и роданистого калия. 50 г роданида взвешивают с погрешностью не более 0,5 г и растворяют в 50 мл дистиллированной воды. Приготовление раствора соляной кислоты плотностью 1,12 г/см3. К 65мл дистиллированной воды приливают 100 мл соляной кислоты плотностью 1,19 г/см3 Практическая работа №2 Определение содержания кальция и магния В работе используется комплексометрический метод определения Са2+ и Mg2+ при их совместном присутствии в растворе. Сущность определения сводится к тому, что в начале определяют суммарное содержание молярной концентрацией эквивалента 0,05 моль/л Mg2+, титруя фильтрат раствором трилона Б в присутствии хромогена черного. Затем находят содержание ионов Са2+, титруя фильтрат раствором трилюна Б в присутствии индикатора мурексида. По разности этих двух определений находят содержание ионов Mg2+. Реактивы и оборудование Раствор трилона Б с молярной концентрацией эквивалента 0,05 моль/л, индикатор хромоген черный, раствор гидроксида натрия с молярной концентрацией 2 моль/л, аммонийный буферный раствор, индикатор мурексид, хромоген. Ход работы Пипеткой на 50 мл отбирают пробу воды и переносят ее в колбу для титрования, приливают 5 мл аммонийной буферной смеси, 25-30 мг хромогена черного и титруют раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до перехода винно-красной окраски раствора в синюю. Титрование повторяют 2-3 раза. и берут среднее значение. Содержание Са2+ и Mg2+ вместе взятых можно найти по формуле: 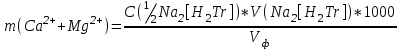 , (3) , (3)где С(½ Na2[H2Tr]) – концентрация раствора трилона Б, моль/л; V(Na2[H2Tr]) – объем рабочего раствора трилона Б, затраченного на титрование, мл; Vф - объем фильтрата, мл. Определение содержания кальция. 50 мл фильтрата переносят в колбу для титрования, приливают 2,5 мл раствора NaOH с молярной концентрацией 2 моль/л, 30-40 мг смеси мурексида с хлоридом натрия и приступают к титрованию раствором трилона Б с молярной концентрацией эквивалента 0,05 моль/л до появления сине-фиолетовой окраски, не исчезающей в течении 2-3 минут. Титрование повторяют 2-3 раза и берут среднее знамение. Содержание кальция вычисляют по формуле, как и суммарное содержание Ca2+ и Mg2+. Количество магния находят: 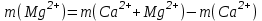 (4) (4)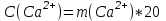 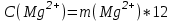 Приготовление буферного раствора. 50 г химически чистого NH4Cl растворяют в дистиллированной воде, добавляют 250мл 20% раствора гидроксида аммония и доводят объем раствора дистиллированной водой до 1 л. Индикатор хромоген черный. 0,5 г индикатора хромогена черного растирают с 50 г химически чистого хлорида натрия. Индикатор мурексид. Растирают в ступке 1 г мурексида и 100 г хлорида натрия. Практическая работа №3 Метод определения содержания хлоридов Метод основан на осаждении хлорид – иона в нейтральной или слабо щелочной среде с нитратом серебра в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности, образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево – желтую. Точность метода 1-3 мл/л хлорид –иона. Реактивы и оборудование Пробирки, конические колбы, бюретки, нитрат серебра, хромовокислый калий, вода дистиллированная. Ход работы I. Ориентировочное определение хлорид-ионов. В пробирку приливают 5 мл исследуемой воды и добавляют 3 капли 10% раствора азотнокислого серебра. Примерное содержание хлор – иона определяют по осадку или мути в соответствии с требованиями таблицы. Таблица 4 – Содержание хлорид-ионов в воде
II. Точное определение хлорид-ионов. В коническую колбу приливают 25 мл исследуемой воды, затем добавляют 2-3капли 10% раствора хромовокислого калия и титруют 0,01 н раствором нитрата серебра. Титрование ведут до перехода окраски лимонно-желтой в оранжевую. Концентрацию хлорид – ионов определяют по формуле: 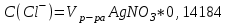 (5) (5)Практическая работа 4 Определение карбонат и гидрокарбонат-ионов при их совместном присутствии Определение карбонат- и гидро-карбонат ионов при их совместном присутствии проводят объемным методом. Оборудование и реактивы Конические колбы, мерные пипетки на 50 мл, бюретки, 1% раствор метилоранжа, раствор соляной кислоты с молярной концентрацией эквивалента 0,05-0,1 моль/л, метиловый оранжевый. Ход работы В коническую колбу помещают 50 мл 1% раствора фенолфталеина, осторожно по каплям титруют раствором соляной кислоты до обесцвечивания раствора. Отмечают объем израсходованной кислоты. Далее к тому же раствору прибавляют три капли раствора метилового оранжевого и титруют тем же раствором соляной кислоты до перехода желтой окраски жидкости в слабо-розовую. Содержание СО32- и НСО3- (в мл/л) рассчитывают по формулам: 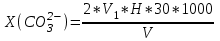 , (6) , (6)
|

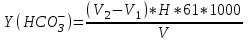 , (7)
, (7)