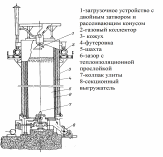
общая химическая технология. охт. Гидрокарбонат натрия Nahco3 другие названия питьевая сода, пищевая сода
 Скачать 1.93 Mb. Скачать 1.93 Mb.
|
|
Характеристика химического продукта Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи и слизистых оболочек человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется. Химическая формула 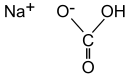
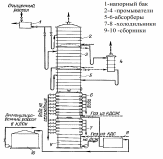
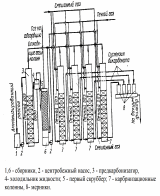
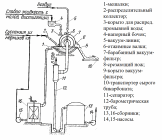
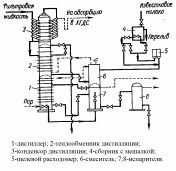
Методы получения гидрокарбоната натрия В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции: В холодной воде гидрокарбонат натрия мало растворим, и его можно отделить от остального раствора фильтрованием, а из полученного раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь: Единственный способ получения гидрокарбоната натрия высокой (пищевой) чистоты (Колмановский И.И. Производство двууглекислого натрия (бикарбоната). М.: Изд. "Химия", 1964, 166 с.; Крашенинников С.А. Технология кальцинированной соды и очищенного бикарбоната натрия. М.: Изд. "Высшая школа", 1985, 287 с.; Зайцев И.Д., Ткач Г.А., Стоев Н.Д. Производство соды. М.: Изд. "Химия", 1986, 311 с.) является карбонизация содового раствора путем пропускания диоксида углерода под давлением в насыщенный раствор карбоната натрия при температуре около 75°C по реакции: Na2CO3(р.)+CO 2(г.)+H2O(ж.) Метод карбонизации позволяет использовать небольшой объем жидкости, необходимой для получения единицы гидрокарбоната натрия, поскольку растворимость кальцинированной соды в несколько раз превышает растворимость гидрокарбоната натрия. Для производства чистого (пищевого) гидрокарбоната натрия карбонизация содового раствора осуществляется в карбонизационных колоннах по принципу противотока жидкости и газа: в верхнюю часть колонны поступает содовый раствор, в нижнюю - газ, содержащий 33-40% об. диоксида углерода. По мере поглощения диоксида углерода газ обедняется и выпускается в атмосферу с содержанием CO2 14-16%, что совершенно неприемлемо с экономической точки зрения в случае использования 13 CO2. Чистая пищевая сода, осаждающаяся при насыщении содового раствора диоксидом углерода, отделяется на фильтре, а маточная жидкость, содержащая смесь карбоната и бикарбоната натрия, а также растворенные примеси, возвращается в начало процесса для получения исходного раствора. В данной работе я хотела бы подробнее рассмотреть первый метод, т.к. с моей точки зрения этот метод является довольно интересным и практикуется на производстве достаточно долгое время. Второй метод в отличии от первого является нераспространенным и с моей точки зрения менее интересным. Аммиачнохлоридный метод получения гидрокарбоната натрия Характеристика основного и вспомогательного сырья Следует обратить внимание на то, что гидрокарбанат натрия в основном является одной из стадий производства соды Основным сырьем для производства гидрокарбоната натрия являются мел и известняк и раствор поваренной соли. Вспомогательные материалы: аммиак, вода, пар, электроэнергия. Карбонатное сырье Для получения оксида углерода (IV) и извести на заводах применяют известняк или мел, называемые карбонатным сырьем. От качества карбонатного сырья в свою очередь зависит нормальная работа завода. Применение известняка более желательно, чем применение мела. При увеличении влажности мела возрастает расход топлива, то есть с увеличением расхода воздуха снижается концентрация СО2 в печном газе. Кроме того, прочность мела ниже, чем известняка. Содержание СаСО3 в известняке в соответствии с ОСТ 21-27-76 в пересчете на сухой продукт должно быть не менее 92%. Добыча известняка ведется, как правило, открытым способом. Вдоль простирания пластов нарезают несколько горизонтов (уступов), в которых бурят небольшие цилиндрические отверстия – шпуры. В шпуры закладывают взрывчатое вещество. Взорванную породу дробят и грузят экскаваторами в вагонетки и отвозят на дробильно-сортировочную установку, находящуюся при карьерах. Куски нужных размеров отделяют и, в зависимости от расстояния до завода, транспортируют, либо по канатной дороге, либо по железной дороге. Поваренная соль Поваренная соль широко распространена в природе как в твердом виде, так и в виде растворов. В производстве гидрокарбоната натрия применяют не твердую соль, а рассол, стоимость добычи которого путем выщелачивания соли во много раз ниже стоимости добычи твердой соли. На заводах к рассолу предъявляются следующие требования: он должен быть насыщенным или близким к насыщению. Максимальная концентрация NaCl в воде при 15ºС равна 317г/л. В промышленности по производству гидрокарбоната натрия концентрацию растворов принято выражать в так называемых нормальных делениях (н.д.). Одно нормальное давление соответствует содержание 1/20 экв вещества в 1 л раствора. На практике применяют рассол, содержащий 305-310 г/л NaCl благоприятно влияет на степень его использования, что ведет к уменьшению удельного расхода рассола. Аммиак Аммиак в производстве гидрокарбоната натрия напрямую расходуется только на получение конечного продукта, чтобы избежать потери аммиака и возвратить его обратно необходимо использовать схему 1. Кроме того, для восполнения неизбежных потерь в цикл вводят аммиачную воду, содержащую до 25% NH3. Аммиачная вода, поступающая с коксохимических заводов, содержит сульфид аммония, предохраняющий стальную аппаратуру и трубопроводы от коррозии. При использовании синтетической аммиачной воды в технологический процесс производства соды вместе с аммиачной водой вводят Na2S. 3.2.Физико-химические характеристики основных стадий процесса Сложный процесс производства гидрокарбоната натрия можно разделить на несколько стадий: Предварительная очистка рассола от солей кальция и магния; Абсорбция – насыщение рассола аммиаком и частично оксидом углерода (IV) с получением аммонизированного рассола; Карбонизация – насыщение аммонизированного рассола оксидом углерода (IV) с образованием бикарбоната натрия в виде суспензии; Фильтрование – отделение суспензии бикарбоната натрия от фильтровальной жидкости; Дистилляция- регенерация аммиака и оксида углерода (IV) из фильтровальной жидкости. Кроме основных процессов, при производстве карбоната натрия протекает ряд побочных процессов, не имеющих непосредственного отношения к основному производству. Например, аммиак регенерируют из хлорида аммония путем обработки раствора известковым молоком: 2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2 В отделении дистилляции образующийся аммиак отгоняют из раствора водяным паром и направляют в отделение абсорбции. Раствор хлорида кальция является отходом производства. Для получения известкового молока необходима известь CaO , которую получают путем обжига карбонатного сырья (мела или известняка) в известково-обжигательных печах при температуре 1100-1200ºС. Образующийся при обжиге оксид углерода (IV) используют в процессе карбонизации, а известь CaO гасят избытком воды с получением известкового молока: CaO + H2O = Ca(OH)2 Таким образом, получение гидрокарбоната натрия аммиачным способом можно изобразить в виде схемы, показывающей взаимную связь между отдельными стадиями процесса:          NaCl + NH3 + CO2 + H2O = NaHCO3 + NH4Cl    CaCO3 = CaO + CO2    CaO + H2O = Ca(OH)2     2NH4Cl + Ca(OH)2 = 2NH3 + 2H2O + CaCl2   На рис.1 показана общая технологическая схема производства гидрокарбоната натрия по аммиачному способу. Водный раствор поваренной соли ,содержащей 305-310г/л, предварительно очищенный от солей кальция и магния, самотеком поступает в промыватель 1, где поглощает оксид углерода (IV) из газов, выходящих из карбонизационной колонны 7, и аммиак из газов, поступающих с вакуум-фильтров 5. После поглощения СО2 и NH3 отходящие газы удалюются в атмосферу. Из промывателя газов 1 рассол поступает в абсорбер 2 для поглощения аммиака и оксида углерода (IV), содержащихся в газах дистилляционной колонны 3. Непоглощенные газы из абсорбера 2 направляют вакуум-насосом в промыватель 1. Аммонизированный рассол, предварительно охлажденный в холодильнике 6, непрерывно поступает в карбонизационную колонну 7, заполняя ее почти доверху. Сюда же поступает газ, предварительно промытый и очищенный, из известково-обжигательных печей 10 (37-40% СО2 ) и смешанный газ (смесь газа известково обжигательных печей). В смешанном газе содержится 60-80% СО2 – при двух вводах газа в карбонизационную колонну – и около 50% СО2 при одном вводе. Газы попадают в колонну 7 при помощи компрессоров 8 и 12. В карбонизационной колонне 7 протекает основная рекция образования бикарбоната натрия. Суспензию кристаллического бикарюоната натрия в растворе хлорида аммония и непрореагировавшего хлорида натрия направляют в вакуум-фильтр 5 для выделения бикарбоната натрия. Маточную жидкость, содержащую углеаммонийные соли и хлорид аммония (фльтрат) подают из вакуум-фильтров в дистилляционную колонну 3, где осуществляется регенерация аммиака из раствора, содержащего хлорид и карбонат аммония. При нагревании раствора до 70-80ºС карбонат аммония разлагается; разложение хлорида аммония проводят в дистиллере-смесителе 4, куда он поступает из колонны 3. Сюда же подают известковое молоко, полученное гашением извести в аппарате 11. Регенерированные аммиак и оксид углерода (IV) отгоняют из раствора паром, подаваемым в нижнюючасть аппарата 4, и они поступают в абсорбер 2 на поглощение рассолом. После отгонки аммиака полученный раствор содержит в основном хлорид кальция и не вступивший в реакцию хлорид натрия. Этот раствор, называемый дистиллерной жидкостью, является отходом производства. Осадок NaHCO3 промывают на вакуум-фильтре 5. Технологическая схема получения гидрокарбоната натрия аммиачным способом 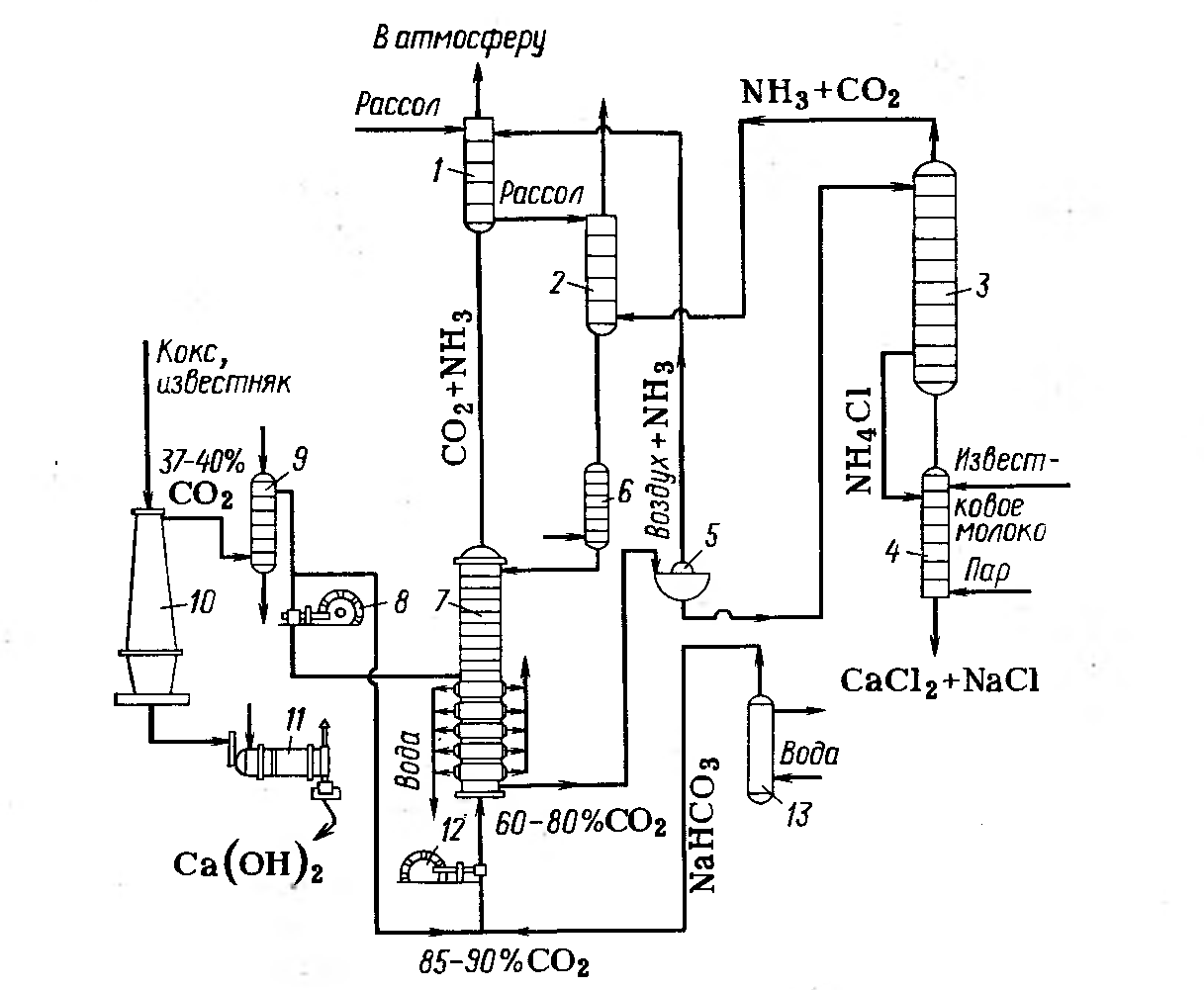 3.4.Характеристика используемых химических реакторов и описание основных процессов
3.5.Характеристика отходов, проблема их обезвреживания и полезного использования. Аммиачный способ производства гидрохлорида натрия применяется в течение многих десятилетий. Десятки миллионов тонн экологически нежелательных отходов в виде хлорида кальция (CaCl2) "складированы" в "хранилища" и никак не используются. Предлагаемый способ утилизации хлорида кальция основан на использовании щелочей, которые по окончании процесса регенерируются и возвращаются в производство. Из 1 т хлорида кальция можно получить 0,5 т оксида кальция (CaO)и 1,65 т 40%-ной соляной кислоты (HCl)или соответствующее количество сухогоHCl. Оксид кальция, полученный в результате переработки хлорида кальция, может стать основой производства силикатного кирпича, а также промежуточным продуктом производства разнообразных химических соединений на основе кальция. Его можно использовать в металлургической промышленности в качестве шлакообразующего, что позволит экономить значительные средства, затрачиваемые на разложение карбоната кальция (CaCO3), который обычно используют как шлакообразующее. Соляная кислота является основой многих производств тяжелой, химической промышленности, некоторых гидрометаллургических процессов и т.д. В традиционной технологии кальцинированной соды на 1 тонну продукта приходятся следующие отходы: хлоридные стоки(состав: 115-125 г/л СаС12, 55-58 г/л NaCl и 20-25 г/л взвеси Са(ОН)2, СаСО3 и CaSO4)- около 9,1 м3, шлам от очистки рассола, содержащий 250-300 г/л взвеси Са(ОН)2 и Mg(OH)2 - 0,l м3, шлам дистилляции, недопал при обжиге мела или известняка, отделяемый в процессе получения известковой суспензии и содержащий СаСО3, СаО и золу топлива, около 55 кг. И хотя хлорид кальция используется в других отраслях промышленности, так или иначе идет рост площадей золоотвалов. 3.6. Перспективы совершенствования процесса получения гидрокарбоната натрия. В перспективе особого внимания требуют энергетические проблемы и именно эти работы станут наиболее эффективными и значимыми для народного хозяйства. К основным энергопотребляющим стадиям и операциям производства относятся: обжиг известкового сырья с получением газообразного диоксида углерода и извести; регенерация аммиака и диоксида углерода из гидрокарбонатного маточника; карбонизация аммонизированного рассола; охлаждение воды, отводящих тепло экзотермических реакций; устройства для транспортирования твердых, жидких и газообразных продуктов и полупродуктов, а также перемешивающие устройства. Для повышения степени использования подведенного тепла и снижения удельных энергозатрат следует уменьшить количество тепловых отходов за счет совершенствования процесса или агрегата – источника этих ресурсов, а также повышения степени использования вторичных энергетических ресурсов без пересмотра процесса-источника. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||