Лекция 26. Фенолы. Гидроксильные производные аренов
 Скачать 394.6 Kb. Скачать 394.6 Kb.
|
|
Гидроксильные производные аренов Одноатомные фенолы (аренолы). Номенклатура. Изомерия. Способы получения. Физические свойства и строение. Химические свойства: кислотность, образование фенолятов, простых и сложных эфиров; нуклеофильное замещение гидроксильной группы; реакции с электрофильными реагентами (галогенирование, нитрование, нитрозирование, азосочетание, сульфирование, ацилирование и алкилирование); взаимодействие с формальдегидом, фенолформальдегидные смолы; реакции окисления и гидрирования. Двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон. Способы получения, свойства и применение. Трехатомные фенолы (арентриолы): пирогаллол, оксигидрохинон, флороглюцин. Способы получения, свойства и применение. Гидроксильные производные аренов Фенолы – это производные ароматических углеводородов, в которых одна или несколько гидроксильных групп непосредственно связаны с бензольным ядром. В зависимости от числа гидроксильных групп в ядре различают одно-, двух- и трехатомные фенолы. Для названия фенолов часто используют тривиальные названия (фенол, крезолы, пирокатехин, резорцин, гидрохинон, пирогаллол, гидроксигидрохинон, флороглюцин). Замещенные фенолы называют как производные фенола или как гидроксипроизводные соответствующего ароматического углеводорода. Одноатомные фенолы (аренолы) Ar-OH 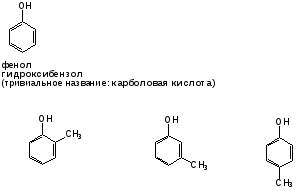 орто-крезол мета-крезол пара-крезол 2-метилфенол 3-метилфенол 4-метилфенол 2-гидрокситолуол 3-гидрокситолуол 4-гидрокситолуол В ароматическом ряду встречаются также соединения с гидроксильной группой в боковой цепи – так называемые ароматические спирты. Свойства гидроксильной группы в ароматических спиртах не отличаются от свойств спиртов алифатического ряда. 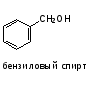 Двухатомные фенолы (арендиолы) 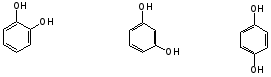 пирокатехин резорцин гидрохинон 1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол Трехатомные фенолы (арентриолы) 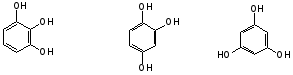 пирогаллол гидроксигидрохинон флороглюцин 1,2,3-тригидроксибензол 1,2,4-тригидроксибензол 1,3,5-тригидроксибензол Одноатомные фенолы Способы получения Природным источником фенола и его гомологов служит каменный уголь, при сухой перегонке которого образуется каменноугольная смола. При разгонке смолы получают фракцию «карболового масла» (t0 160-2300С), содержащую фенол и крезолы. 1. Сплавление солей ароматических сульфокислот со щелочами Реакция лежит в основе промышленных методов получения фенолов. Реакция состоит в нагревании бензолсульфокислоты с твердой щелочью (NaOH, KOH) при температуре 250-3000С: 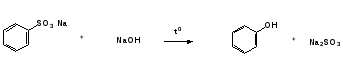 Реакция протекает по механизму нуклеофильного замещения SN2аром (присоединение-отщепление). Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к месту замещения облегчает реакцию нуклеофильного замещения. 2. Гидролиз арилгалогенидов Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию в очень жестких условиях. Так, хлорбензол гидролизуется с образовнием фенола действием концентрированной щелочи при температуре 350-4000С и высоком давлении 30 МПа, либо в присутствии катализаторов – солей меди и высокой температуре:  Реакция протекает по механизму нуклеофильного замещения (отщепление-присоединение) (ариновый или кине-механизм). Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к галогену значительно облегчает реакцию гидролиза. Так, пара-нитрохлорбензол способен замещать хлор на гидроксил обычным нагреванием с раствором щелочи при атмосферном давлении: 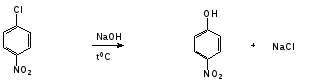 пара-нитрохлорбензол пара-нитрофенол пара-нитрохлорбензол пара-нитрофенолРеакция протекает по механизму SN2аром (присоединение-отщепление). 3. Получение фенола из кумола (кумольный способ) Синтез на основе кумола имеет промышленное значение и ценен тем, что позволяет получать одновременно два технически важных продукта (фенол и ацетон) из дешевого сырья (нефть, газы крекинга нефти). Кумол (изопропилбензол) при окислении кислородом воздуха превращается в гидропероксид, который под действием водного раствора кислоты распадается с образованием фенола и ацетона: 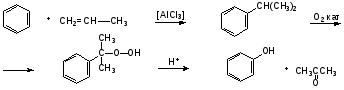 гидропероксид фенол ацетон 4. Гидроксилирование аренов Для прямого введения гидроксильной группы в бензольное кольцо используют пероксид водорода в присутствии катализаторов (солей железа (П) или меди (П): 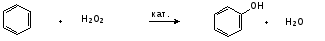 5. Окислительное декарбоксилирование карбоновых кислот Фенолы получают из ароматических кислот пропуская в реактор водяной пар и воздух при температуре 200-3000С в присутствии солей меди (П):  6. Получение из солей диазония При нагревании арендиазониевых солей в водных растворах выделяется азот с получением фенолов: 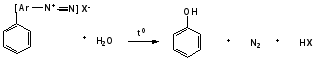 Физические свойства фенолов Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом. Фенолы малорастворимы в воде, но хорошо растворимы в органических растворителях. При хранении на воздухе темнеют вследствие процессов окисления. Являются токсичными веществами, вызывают ожоги кожи. Электронное строение фенола Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой: 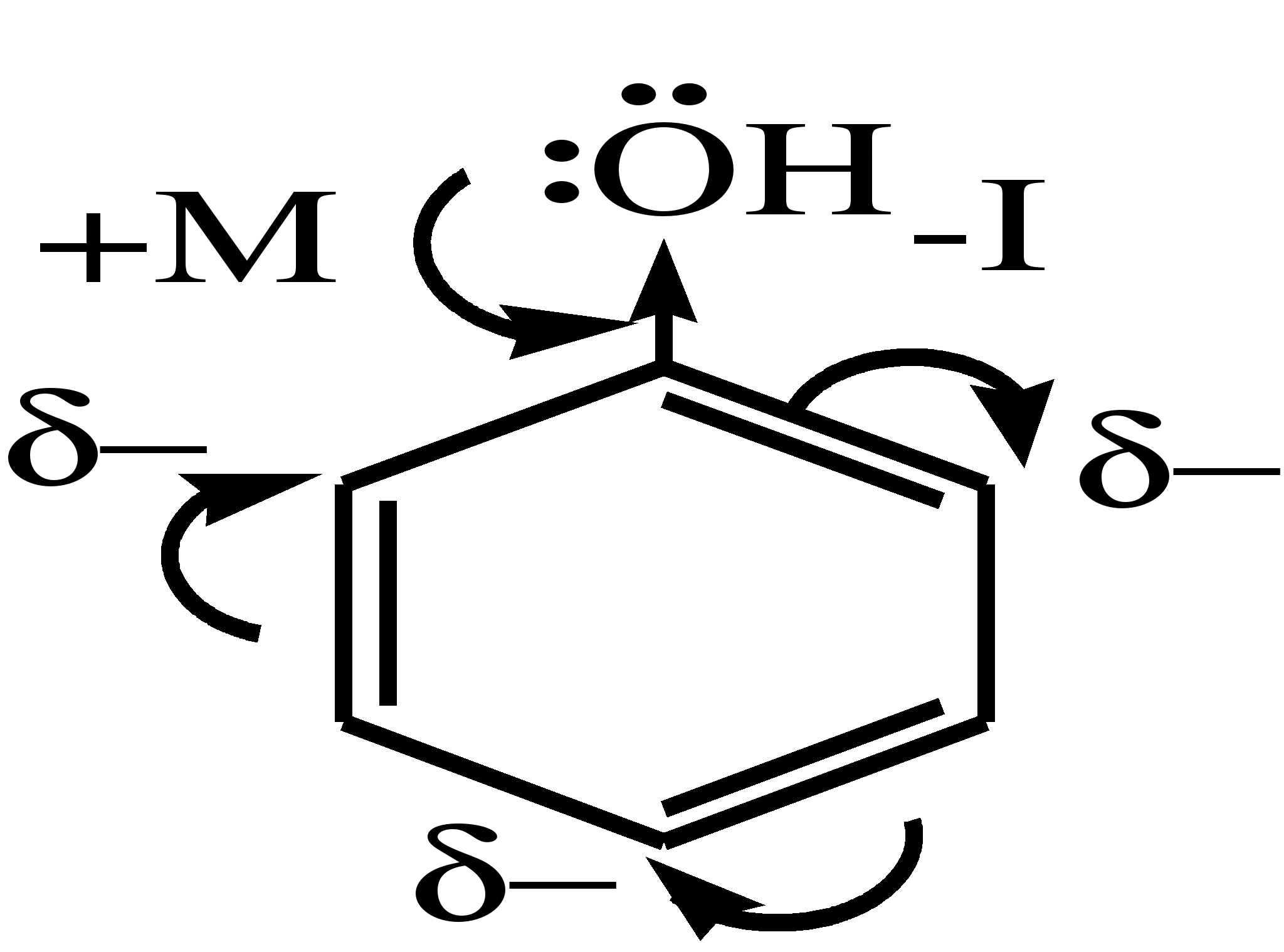 Гидроксильная группа является заместителем 1 рода, т.е. электроно-донорным заместителем. Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р,π-сопряжение с π-системой бензольного ядра, проявляя +М-эффект. С другой стороны, гидроксильная группа, вследствие большей электроотрицательности кислорода, проявляет –I-эффект. Однако +М-эффект в фенолах значительно сильнее противоположно направленного –I-эффекта (+М > -I). Результатом эффекта сопряжения является: 1) увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами; 2) вследствие сопряжения связь С-ОН у фенолов становится короче и прочнее в сравнении со спиртами, так как носит частично двойной характер. Поэтому затрудняются реакции замещения ОН-группы; 3) повышение электронной плотности на атомах углерода в орто- и пара-положениях бензольного ядра облегчает реакции электрофильного замещения атомов водорода в этих положениях. 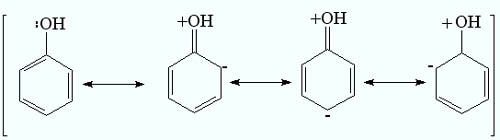 Химические свойства фенолов Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца. 1. Реакции по гидроксильной группе 1. Кислотные свойства Фенолы являются слабыми ОН-кислотами, но значительно более сильными по сравнению с алканолами. Константа кислотности рКа фенола равна 10. Более высокая кислотность фенола объясняется двумя факторами: 1) большей полярностью связи О-Н в фенолах, в результате чего атом водорода гидроксильной группы приобретает большую подвижность и может отщепляться в виде протона с образованием фенолят-иона; 2) Фенолят-ион за счет сопряжения неподеленной пары кислорода с бензольным кольцом мезомерно стабилизирован, т.е. отрицательный заряд на атоме кислорода фенолят-иона значительно делокализован:  Ни одна из этих граничных структур в отдельности не описывает реального состояния молекулы, но их использование позволяет объяснять многие реакции. Электроноакцепторные заместители увеличивают кислотные свойства фенола. Оттягивая электронную плотность из бензольного ядра на себя, они способствуют усилению р,π-сопряжения (+М-эффект), тем самым повышают поляризацию связи О-Н и увеличивают подвижность атома водорода гидроксильной группы. Например: 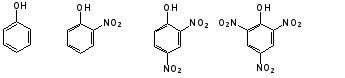 фенол 2-нитрофенол 2,4-динитрофенол пикриновая кислота фенол 2-нитрофенол 2,4-динитрофенол пикриновая кислотарКа 9,98 7,23 4,03 0,20 Электронодонорные заместители уменьшают кислотность фенолов. 2. Образование фенолятов Фенолы, так же, как и алифатические спирты, обладают кислыми свойствами, т.е. способны образовывать соли – феноляты. Однако они более сильные кислоты и поэтому могут взаимодействовать не только со щелочными металлами (натрий, литий, калий), но и со щелочами и карбонатами: 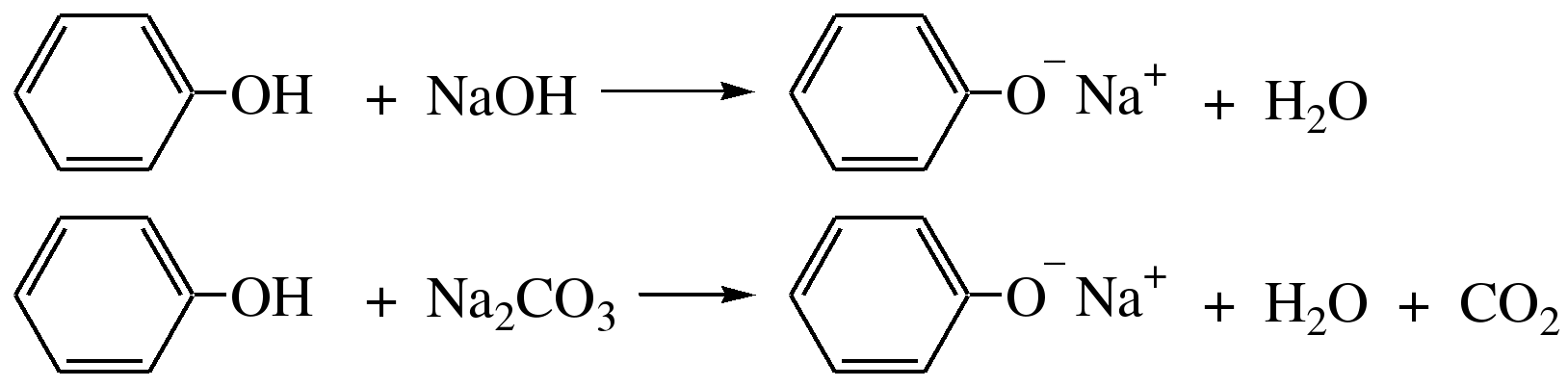 фенол фенолят натрия Фенол – очень слабая кислота (рКа=9,98), поэтому феноляты разлагаются не только сильными кислотами, но даже такой слабой кислотой, как угольная кислота (рКа=6,37): С6Н5 – ОNa + HCl → С6Н5 – ОH + NaCl С6Н5 – ОNa + CO2 + H2O → С6Н5 – ОH + NaHCO3 С растворами хлорида железа FeCl3 фенол образует комплексные соединения – феноляты железа, имеющие фиолетовую окраску (крезолы – голубая окраска). Реакция с FeCl3 – качественная реакция на фенолы. 3. Образование простых эфиров Фенолы более слабые нуклеофилы, чем спирты алифатического ряда. Это объясняется эффектом р,π-сопряжения неподеленной электронной пары кислорода с бензольным кольцом. Поэтому алкилированию подвергают не сами фенолы, а феноляты. В качестве алкилирующих агентов используют галогеналканы, алкилсульфаты и спирты. Реакция протекает по механизму нуклеофильного замещения при насыщенном углеродном атоме: SN2: 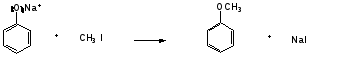 фенолят натрия метилфениловый эфир фенолят натрия метилфениловый эфиранизол 4. Образование сложных эфиров Фенолы как слабые нуклеофилы с трудом реагируют с карбоновыми кислотами. Ацилирование фенолов легко осуществляется действием галоген-ангидридов и ангидридов карбоновых кислот в присутствии щелочей: 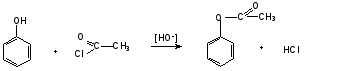  2. Нуклеофильное замещение гидроксильной группы 1. Замещение фенольного гидроксила галогеном Гидроксильная группа в фенолах с большим трудом замещается галогеном. При взаимодействии фенола с пентахлоридом фосфора PCl5 основным продуктом является трифенилфосфат и лишь в небольших количествах образуется хлорбензол: 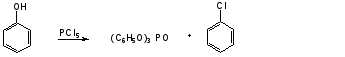 трифенилфосфат хлорбензол трифенилфосфат хлорбензолПрисутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к гидроксилу намного облегчает реакции нуклеофильного замещения группы ОН. Так, пикриновая кислота в тех же условиях легко превращается в 2,4,6-тринитрохлорбензол (пикрилхлорид): 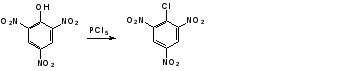 пикриновая кислота пикрилхлорид пикриновая кислота пикрилхлорид2. Взаимодействие с аммиаком При взаимодействии с аммиаком при повышенной температуре и давлении в присутствии катализатора хлорида алюминия происходит замещение ОН-группы на NH2-группу с образованием анилина: 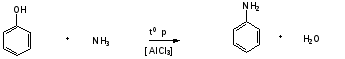 фенол анилин фенол анилин3. Восстановление фенола При восстановлении фенола алюмогидридом лития образуется бензол:  3. Реакции с участием бензольного кольца 1. Реакции электрофильного замещения в бензольном кольце Гидроксильная группа является заместителем 1 рода, поэтому реакции электрофильного замещения в бензольном ядре протекают с фенолами значительно легче, чем с бензолом, а заместители направляются в орто- и пара-положения. 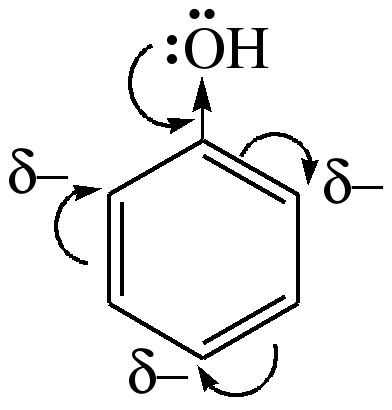 1) Реакции галогенирования Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:  2,4,6-трибромфенол Эта реакция является качественной на фенолы. Легко происходит хлорирование фенола:  2) Реакции нитрования Фенол легко нитруется разбавленной азотной кислотой при температуре 00С с образованием смеси орто- и пара-изомеров с преобладанием орто-изомера:  орто- и пара-нитрофенолы Изомерные нитрофенолы легко разделяются благодаря тому, что только орто-изомер обладает летучестью с водяным паром. Большая летучесть орто-нитрофенолов объясняется образованием внутримолекулярной водородной связи, в то время как пара-изомер образует межмолекулярные водородные связи: 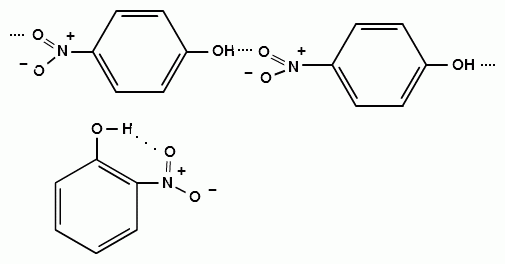 При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота): 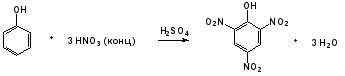 пикриновая кислота пикриновая кислота3) Реакции сульфирования Фенол легко сульфируется при комнатной температуре концентрированной серной кислотой с образованием орто-изомера, который при температурах выше 1000С перегруппировывается в пара-изомер: 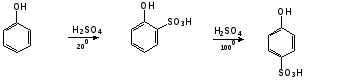 4) Реакции алкилирования Фенолы легко вступают а реакции алкилирования. В качестве алкилирующих агентов используют галогеналканы, алканолы и алкены в присутствии протонных кислот (H2SO4, H3PO4) или кислот Льюиса (AlCl3, BF3): 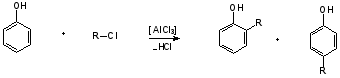 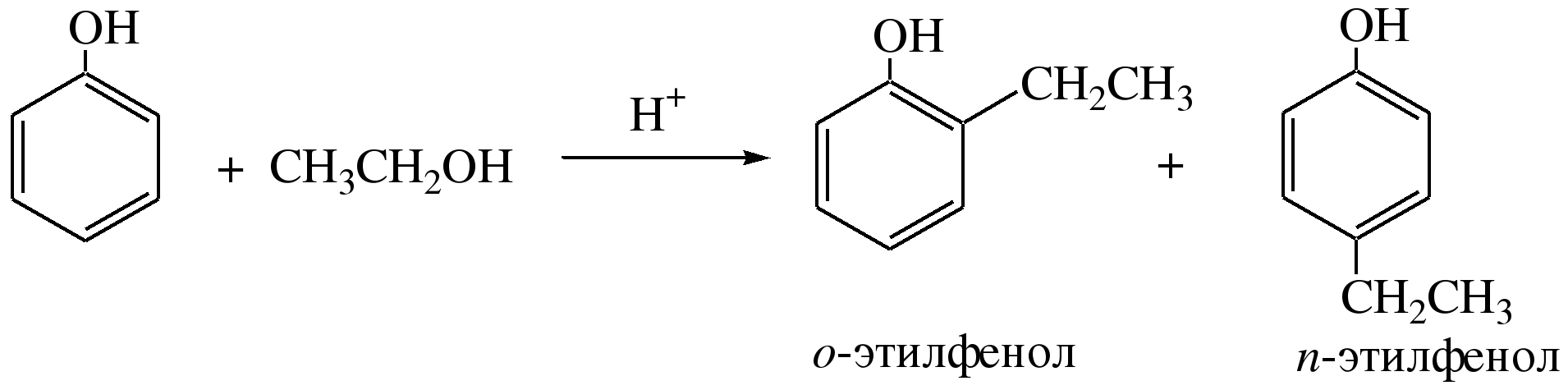 5) Реакции ацилирования Легко происходит ацилирование фенолов под действием галоген-ангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса: 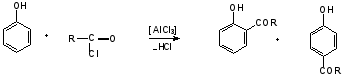 6) Реакции нитрозирования Нитрозофенолы получают прямым нитрозированием фенолов: 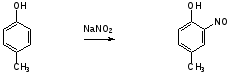 пара-крезол орто-нитрозо-пара-крезол 7) Реакции азосочетания Сочетание с фенолами ведут в слабощелочной среде, так как фенолят-ион значительно активнее, чем сам фенол: 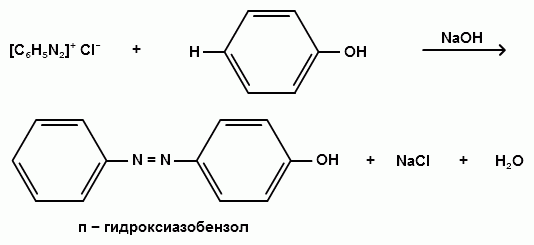 8) Реакции конденсации Фенолы являются столь активными компонентами в реакциях электрофильного замещения, что вступают во взаимодействие с весьма слабыми электрофилами – альдегидами и кетонами в присутствии кислот и оснований. Конденсация с формальдегидом Наиболее легко вступает в реакции конденсации формальдегид. Если реакцию конденсации фенола с формальдегидом проводить в мягких условиях, то удается выделить орто- и пара-гидроксиметилфенолы: 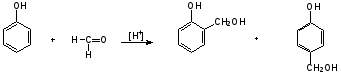 орто-гидрокси- пара-гидрокси- метилфенол метилфенол В этой реакции электрофильным реагентом является гидроксиметил-катион, который образуется при протонировании формальдегида: 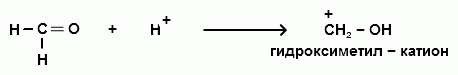 При избытке формальдегида можно получить ди- и тригидрокси-метилфенолы: 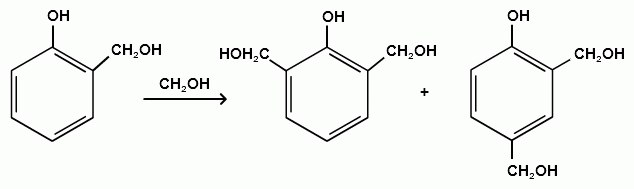 2,6-дигидроксиметилфенол 2,4-дигидроксиметилфенол 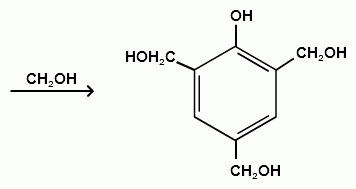 2,4,6-тригидроксиметилфенол Образовавшиеся гидроксиметилфенолы в присутствии кислот могут реагировать с фенолом с получением дигидроксидифенилметана: 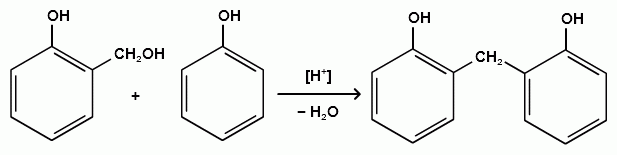 2,2-дигидроксидифенилметан В более жестких условиях фенол с формальдегидом образует высокомолекулярные продукты поликонденсации – фенол-формальдегидные смолы (фенопласты): 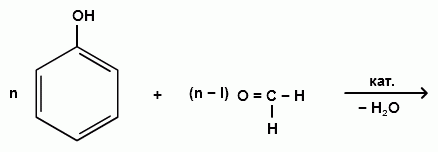 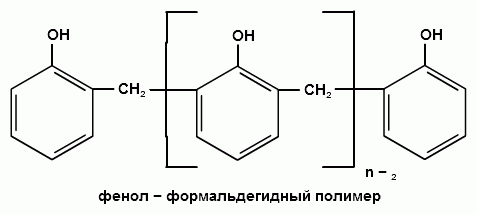 Механизм реакции 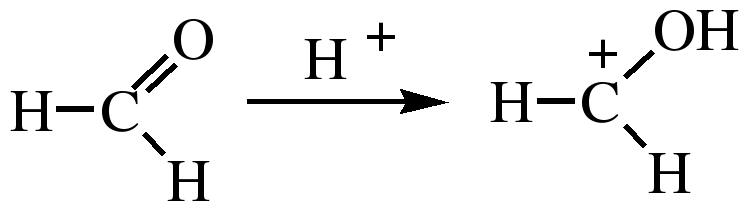 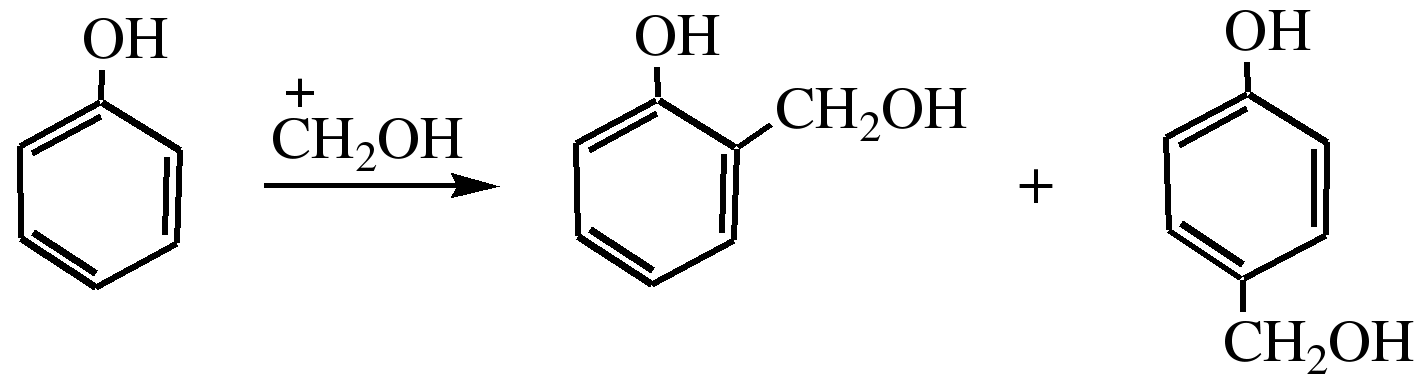 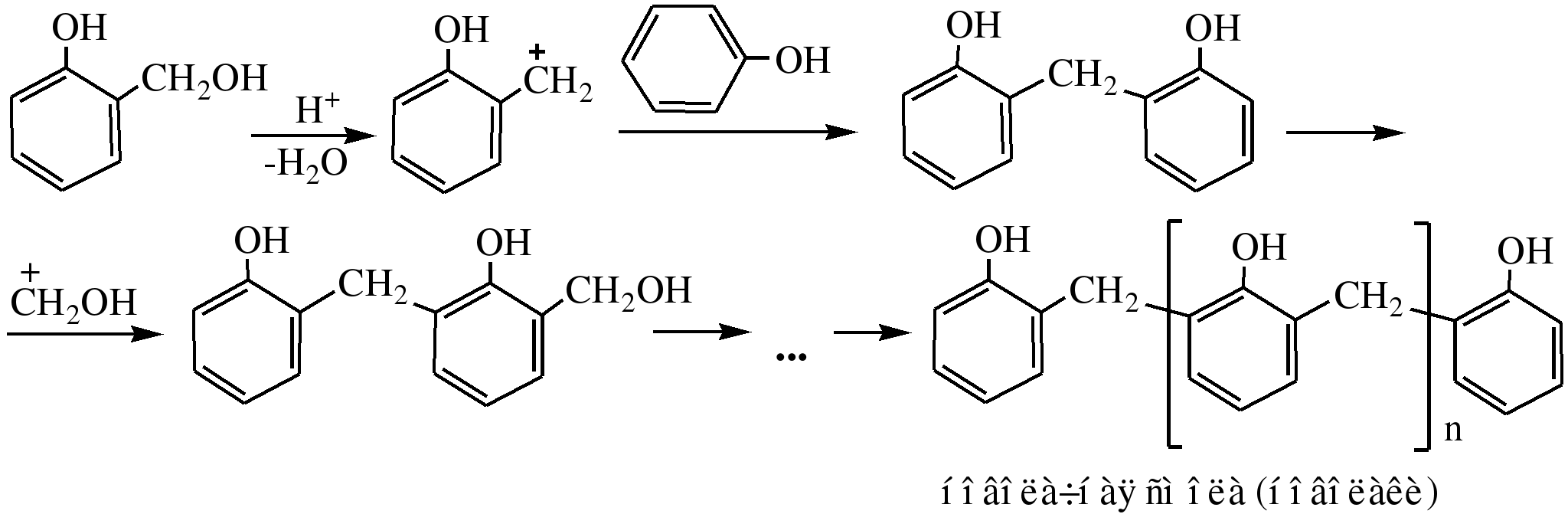 Конденсация с кетонами При конденсации фенола с ацетоном в присутствии катализатора образуется дигидроксидифенилпропан (торговое название – бисфенол А), который используют для производства эпоксидных смол: 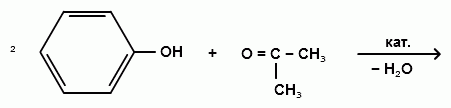 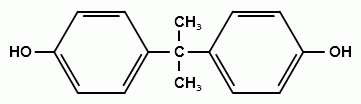 4,4-дигидроксидифенилпропан бисфенол А Конденсация с ароматическими альдегидами Конденсация фенолов с ароматическими альдегидами лежит в основе получения некоторых важных красителей трифенилметанового ряда: 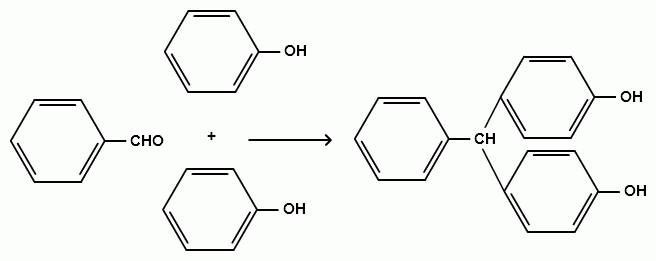 2. Окисление фенолов Повышенная электронная плотность в ядре фенола делает его чувствительным к воздействию окислителей. В зависимости от природы окислителя и условий проведения реакции образуются различные продукты окисления фенола. 1) При окислении фенола пероксидом водорода в присутствии железного катализатора получается орто-бензохинон через промежуточное образование пирокатехина: 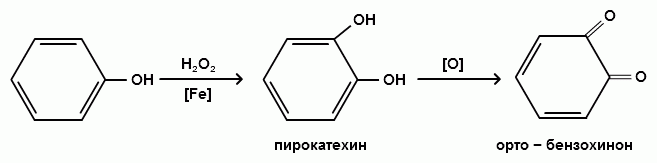 2) Сильные окислители, такие как хромовая смесь (K2Cr2O7 + H2SO4), броматы (KBrO3, H2SO4) окисляют фенол до пара-бензохинона через промежуточное образование гидрохинона: 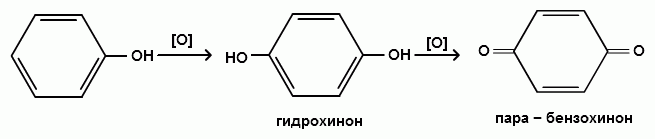 3) При более энергичном действии окислителей происходит разрушение бензольного ядра. Благодаря склонности к окислению фенолы могут окрашиваться при хранении на воздухе. 3. Гидрирование фенолов При каталитическом гидрировании фенола получается циклогексанол. В качестве промежуточного продукта образуется циклогексанон: 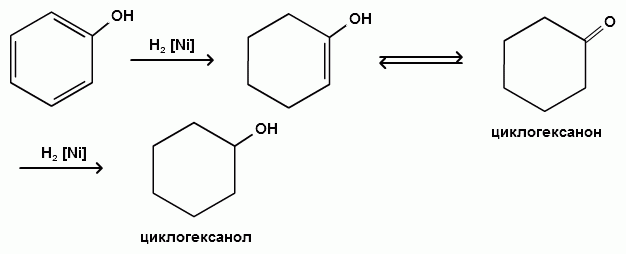 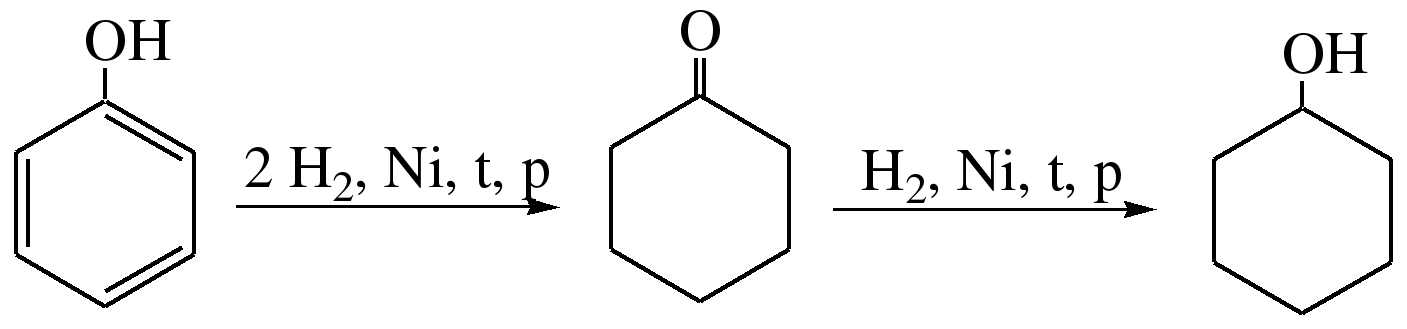 Отдельные представители Фенол – кристаллическое вещество с т. пл. 43°С, обладает характерным едким запахом, вызывает ожоги на коже. Это один из первых примененных в медицине антисептиков. Применяется в больших количествах для получения пластических масс (конденсация с формальдегидом), лекарственных препаратов (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота). Метиловый эфир фенола – анизол – применяется для получения душистых веществ и красителей. Этиловый эфир фенола – фенетол. Крезолы (метилфенолы) применяются в производстве пластических масс, красителей, дезинфицирующих средств. |
