Антибиотики. реферат. Гликопептидные антибиотики на основе гетероциклов
 Скачать 231.95 Kb. Скачать 231.95 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ Федеральное государственное автономное образовательное учреждение высшего образования «СЕВЕРО-КАВКАЗСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» ХИМИКО-ФАРМАЦЕВТИЧЕСКИЙ ФАКУЛЬТЕТ КАФЕДРА ОРГАНИЧЕСКОЙ И АНАЛИТИЧЕСКОЙ химии Доклад по курсу дисциплины «Химия гетероциклических соединений» на тему: «Гликопептидные антибиотики на основе гетероциклов» Работу выполнил: студент III курса, ХФФ, группа ХИМ-б-о-18-1 Бобров Анатолий Анатольевич Проверил: доцент кафедры органической и аналитической химии, кандидат химических наук Лобач Денис Александрович Ставрополь 2021 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ 3 Общая характеристика, биосинтез препаратов 4 Телаванцин 8 Тейкопланин 10 Ванкомицин 11 «Сшитые» антибиотики на основе азитромицина 13 «Сшитые» гликопептид-цефалоспориновые антибиотики 15 ЗАКЛЮЧЕНИЕ 16 СПИСОК ЛИТЕРАТУРЫ 17 ВВЕДЕНИЕАнтибиотики - это препараты, применяемые для лечения бактериальных инфекций. Они не действуют против вирусных и многих других инфекций. Антибиотики могут убивать микроорганизмы или останавливать их размножение, позволяя естественным защитным механизмам их устранять. Один из классов антибиотиков – гликопептидные антибиотики, включающие в себя гликозилированные циклические или полициклические нерибосомные пептидов. В последние 5-8 лет отмечается драматический рост стафилококковых и стрептококковых инфекций, вызванных полирезистентными штаммами, устойчивыми ко всем β-лактамным антибиотикам (пенициллинам, цефалоспоринам, монобактамам и карбапенемам), а также к макролидам, аминогликозидам, тетрациклинам и другим антибактериальным препаратам. Такой полирезистентностью характеризуются так называемые метициллинрезистентные (или оксациллинрезистентные) стафилококки (MRS) S.aureus, в том числе коагулазонегативные (CNS) S.epidermidis, пенициллин-резистентные стрептококки Streptococcus pneumoniae, S.viridans, полирезистентные энтерококки Enterococcus faecalis и E.faecium. В клинической практике это означает, что целый ряд известных заболеваний, вызванных такими возбудителями, не поддаются традиционным схемам лечения. Это привело к резкому росту потребности в антибиотиках, относящихся к группегликопептидов, высокоактивных в отношении названных проблемных микроорганизмов. Неэффективность антибиотиков в лечении инфекционных заболеваний является одной из важнейших проблем современного мира. По примерным подсчетам ежегодно умирает 700 тысяч человек от инфекций, вызванных антибиотикорезистентными патогенными бактериями, а к 2050 году это число может увеличиться до 10 млн человек. Новые антибиотики, в частности, на основе гетероциклических соединений, способны решить эти проблемы. Это делает тему реферата актуальной. Общая характеристика, биосинтез препаратовГликопептиды — ванкомицин и тейкопланин антибиотики узкого спектра действия, являются общепризнанными препаратами выбора для лечения инфекций, вызванных проблемными полирезистентными грамположительными кокками: стафилококками, стрептококками и энтерококками. Механизм действия гликопептидов отличен от других антибиотиков и представляет собой блокирование синтеза пептидогликана клеточной стенки грамположительных бактерий путем необратимого связывания с концевым участком аминокислотного мостика, участвующего в образовании поперечных сшивок между полисахаридными цепями D-Ala-D-Ala. Гликопептиды неактивны в отношении практически всех грамотрицательных микроорганизмов, так как крупная молекула гликопептидных антибиотиков не способна проникать через их внешнюю мембрану. Рассмотрим синтез гликопептидных антибиотиков, используя в качестве примера тейкопланин. Гептапептидный остов тейкопланина собирается нерибосомными пептидными синтетазами. Вместе они составляют семь модулей, каждый из которых содержит несколько доменов, каждый из которых отвечает за включение одной аминокислоты. Модули 1, 4 и 5 активируют L-4-Hpg как аминоацил-AMP, модули 2 и 6 активируют L-Tyr, а модули 3 и 7 активируют L-3,5-Dpg. Активированные аминокислоты ковалентно связываются с NRPS в виде тиоэфиров с помощью кофактора фосфопантетеина, который присоединен к домену белка-носителя пептидила (PCP). Связанные с ферментом аминокислоты затем соединяются амидными связями под действием домена конденсации. Гептапептид тейкопланина содержит 4 D-аминокислоты, образованные эпимеризацией активированных L-аминокислот. Каждый из модулей 2, 4 и 5 содержит домен эпимеризации (E), который катализирует это изменение. Модуль 1 не содержит домена E, и предполагается, что эпимеризация будет катализироваться доменом C. В целом, шесть из семи общих аминокислот основной цепи тейкопланина состоят из небелковых или модифицированных аминокислот. Одиннадцать ферментов координированно индуцируются для образования этих шести необходимых остатков. Тейкопланин содержит два хлорированных положения: 2 (3-Cl-Tyr) и 6 (3-Cl-β-Hty). Галогеназа Tei8 * действует, катализируя галогенирование обоих остатков тирозина. Хлорирование происходит на уровне аминоацил-PCP во время биосинтеза, до фенольного окислительного связывания, при этом тирозин или β-гидрокситирозин могут быть субстратом хлорирования. Гидроксилирование остатка тирозина модуля 6 также происходит в транс во время сборки гептапептидного остова. После образования гептапептидного остова линейный связанный с ферментом промежуточный продукт циклизуется. Исследования разрушения генов показывают, что оксигеназы цитохрома P450 являются ферментами, выполняющими реакции связывания. X-домен в конечном модуле NRPS необходим для рекрутирования ферментов оксигеназы. OxyB образует первое кольцо путем связывания остатков 4 и 6, а OxyE затем соединяет остатки 1 и 3. OxyA соединяет остатки 2 и 4 с последующим образованием связи C-C между остатками 5 и 7 посредством OxyC. Было высказано предположение, что региоселективность и селективность по атропоизомеру этих вероятных реакций одноэлектронного связывания обусловлены требованиями к укладке и ориентации частично перекрестно-связанных субстратов в активном центре фермента. Реакции сочетания показаны ниже: 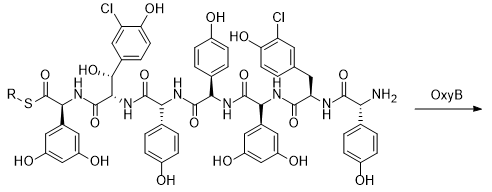 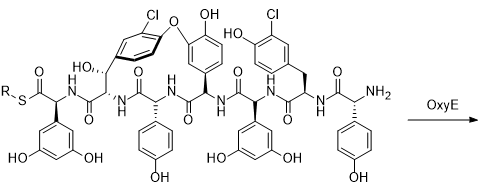 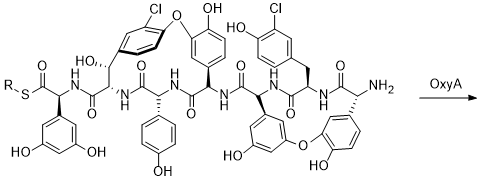 Схема 1 – биосинтез тейкопланина 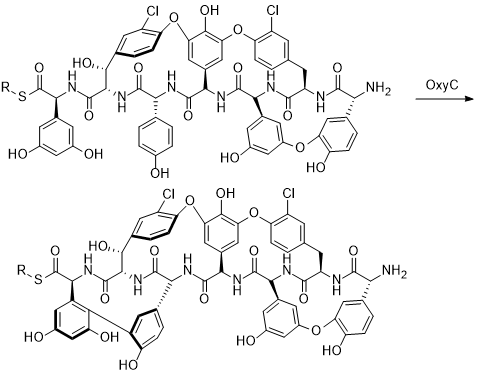 Схема 1 – биосинтез тейкопланина (продолжение) Стадии окислительного сшивания во время биосинтеза тейкопланина, катализируемого оксидазами цитохрома P450 OxyB, E, A и C. Было показано, что специфическое гликозилирование происходит после образования гептпептидного агликона. Для гликозилирования агликона тейкопланина необходимы три отдельных гликозилтрансферазы. Tei10 * катализирует добавление GlcNAc к остатку 4 с последующим деацетилированием с помощью Tei2 *. Затем к ацильной цепи (образованной действием Tei30 * и Tei13 *) добавляется Tei11 *. Затем Tei1 добавляет второй GlcNAc к β-гидроксильной группе остатка 6 с последующим маннозилированием остатка 7, катализируемым Tei3 *. ТелаванцинТелаванцин - полусинтетический антибиотик группы липогликопептидов, производное ванкомицина, имеет следующее строение: 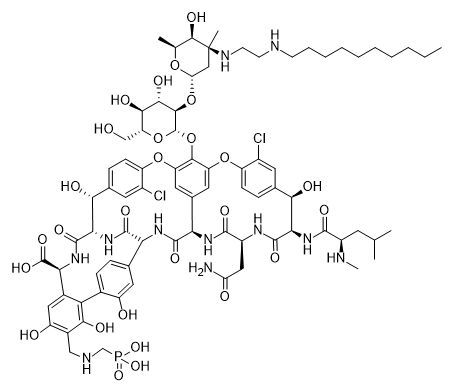 Схема 2 – гликопептиный антибиотик телаванцин Телаванцин гидрохлорид представляет собой белый или слегка окрашенный аморфный порошок с молекулярной массой 1755,6 (свободное основание). Обладает высокой липофильностью и мало растворим в воде. Фармакологическое действие – антибактериальное, бактерицидное. Телаванцин является полусинтетическим антибактериальным препаратом, обладающим зависимым от концентрации бактерицидным действием против чувствительных грамположительных бактерий. Телаванцин ингибирует биосинтез клеточной стенки путем связывания с предшественниками пептидогликана поздних стадий, включая липид II. Телаванцин также связывается с бактериальной мембраной, нарушая ее барьерную функцию. Некоторые штаммы Enterococcus spp., устойчивые к ванкомицину, характеризуются сниженной чувствительностью к телаванцину в условиях in vitro. Телаванцин активен только против грамположительных бактерий. При предполагаемых или выявленных смешанных инфекциях, вызванных грамотрицательными и/или определенными типами анаэробных бактерий, телаванцин должен применяться в сочетании с другими соответствующими антибактериальными средствами. Было показано, что телаванцин активен в отношении большинства штаммов следующих грамположительных микроорганизмов как в условиях in vitro, так и при терапии инфекций, вызванных Staphylococcus aureus (включая метициллин-резистентные штаммы), Enterococcus faecalis (только штаммы, чувствительные к ванкомицину), Streptococcus agalactiae, группа Streptococcus anginosus (включая S. Anginosus, S. Intermedius и S. Constellatus), Streptococcus pyogenes. По результатам исследований in vitro, постантибиотический эффект телаванцина длится от 1 до 6 ч. В отношении более чем 90% таких грамположительных микроорганизмов как Enterococcus faecium (только изоляты, чувствительные к ванкомицину), Staphylococcus haemolyticus, Streptococcus equisimilis, Staphylococcus epidermidis, уровни минимальной подавляющей концентрации (МПК) были ниже или эквивалентны порогу чувствительности к телаванцину родственных видов в исследованиях in vitro. Клиническая эффективность телаванцина в лечении инфекций, вызванных этими микроорганизмами, не изучалась. Некоторые штаммы Enterococcus spp., устойчивые к ванкомицину, характеризуются сниженной чувствительностью к телаванцину в условиях in vitro. Телаванцин активен только против грамположительных бактерий. При предполагаемых или выявленных смешанных инфекциях вызванных грамотрицательными и/или определенными типами анаэробных бактерий, препарат телаванцин должен применяться в сочетании с другими соответствующими антибактериальными средствами. В организме не метаболизирует, выводится в исходной форме. Основное применение – осложненные инфекции кожи и мягких тканей, нозокомиальная пневмония (включая ИВЛ-ассоциированную пневмонию). Противопоказан при повышенной чувствительность к телаванцину, острой почечной недостаточности, терминальной стадии почечной недостаточности, одновременном в/в введении нефракционированного гепарина натрия, т.к. АЧТВ продлевается от 0 до 18 ч после введения телаванцина, детский возраст до 18 лет, беременность, период грудного вскармливания. Применение телаванцина противопоказано при беременности, т.к. отсутствует клинический опыт применения у беременных. В исследованиях эмбрио- и фетотоксичности у животных отмечались дефекты развития плода и повышение частоты преждевременного прерывания беременности, что свидетельствует о потенциальном негативном влиянии на плод человека. ТейкопланинТейкопланин – это антибиотик, используемый в профилактике и лечении серьезных инфекций, вызванных грамм-положительными бактериями, включая метициллин-устойчивый Staphylococcus aureus и Enterococcus faecalis. Это полусинтетический гликопептидный антибиотик со спектром активности, аналогичным ванкомицину. Его механизм действия заключается в подавлении синтеза клеточной стенки бактерий. Тейкопланин (TARGOCID, продаваемый Sanofi Aventis Ltd) на самом деле представляет собой смесь нескольких соединений, пять основных (названных тейкопланин A 2-1- A2-5, на схеме 3 обозначены А-Е) и четыре второстепенных (названные тейкопланином R S-1по RS-4): 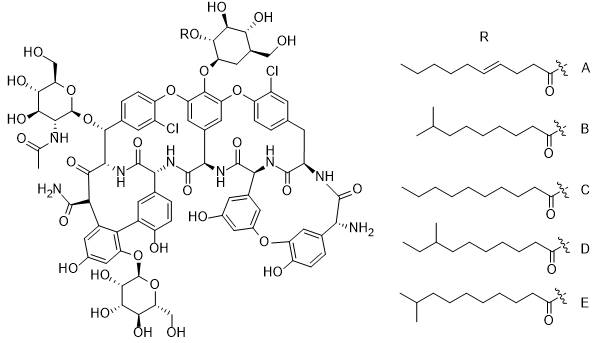 Схема 3 – тейкопланин Все тейкопланины имеют одно и то же ядро гликопептида, называемое тейкопланин A 3-1-слитую кольцевую структуру, с которой два углевода (манноза и N-ацетилглюкозамин) присоединены. Главный и второстепенный компоненты также содержат третью углеводную составляющую — β-D-глюкозамин – и отличаются только длиной и конформацией боковой цепи, присоединенной к ней. ВанкомицинВанкомицин (син. ванкоцин) — антибиотик, полученный из культуральной жидкости Streptomyces orientalis в 1965 г. Является на данный момент наименее преодолимым для суперрезистентных бактерий, "антибиотик стратегического запаса", "лекарство последней надежды", имеет формулу: 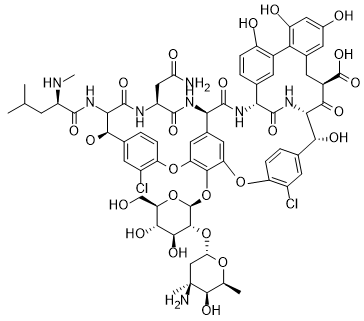 Схема 4 - ванкомицин Штаммы стафилококков, устойчивые к действию пенициллинов и других антибиотиков, остаются чувствительными к ванкомицину. Грамотрицательные бактерии, микобактерии, грибы, дрожжи, вирусы и простейшие устойчивы к антибиотику, обладает бактерицидным действием. Антибиотик действует на микроорганизмы, находящиеся в фазе размножения. Устойчивые формы микроорганизмов в процессе лечения образуются редко. Первично резистентные к препарату. микроорганизмы не обнаружены. При многократных пассажах стафилококков in vitro устойчивость их к ванкомицину повышается лишь в несколько раз. По-видимому, это связано с немедленным бактерицидным действием без лаг-периода. Перекрестной устойчивости микроорганизмов к ванкомицину и другим антибиотикам не наблюдается; с ристомицином отмечена неполная перекрестная устойчивость. Механизм антибактериального действия ванкомицина обусловлен блокирующим влиянием на образование муреина (полимера мукопептида) клеточной стенки бактерий. Синтез муреина нарушается, на стадии переноса дисахарид-(пентапептид)-фосфолипида на акцептор-незавершенный муреин, что отличает ванкомицин от пенициллина, бацитрацина и D-циклосерина, блокирующих другие звенья процесса образования клеточной стенки бактерий. Вторичным эффектом ванкомицина является нарушение функций цитоплазматической мембраны. Показан для лечения таких заболеваний, как: -эндокардит; препарат эффективен как при монотерапии, так и в комбинации с аминогликозидами для лечения эндокардита, вызываемого Streptococcus viridans или Streptococcus bovis. При эндокардите, вызванным энтерококками (например, Е.faecalis), ванкомицин эффективен только в сочетании с аминогликозидами. Имеются сведения о том, что ванкомицин эффективен при лечении эндокардита, вызванного Corynebacterium diphtheriae. Ванкомицин успешно применяется в сочетании с рифампицином, аминогликозидами или с обоими антибиотиками при раннем эндокардите, обусловленном Streptococcus epidermidis или Corynebacterium diphtheriae, после протезирования клапана. В отдельных случаях ванкомицин показан для профилактики эндокардита; -сепсис; -инфекции костей и суставов; -инфекции нижних отделов дыхательных путей; -инфекции кожи и мягких тканей. Ванкомицин может также применяться при инфекциях, вызванных грамположительными микроорганизмами при повышенной чувствительности к пенициллинам; непереносимости или неэффективности другой антибактериальной терапии (включая пенициллины или цефалоспорины); инфекциях, вызванных микроорганизмами, чувствительными к ванкомицину, но устойчивыми к другим антимикробным препаратам. Ванкомицин в виде раствора для приёма внутрь применяется для лечения псевдомембранозного колита. Побочные явления (тромбофлебиты, раздражение почек, тошнота, аллергические реакции, сопровождающиеся крапивницей, эозинофилией, лихорадкой) отмечают у 5— 10% больных. При недостаточности выделительной функции почек возможна кумуляция препарата и, как следствие, проявление его фототоксических и нефротоксических свойств. В связи с этим ванкомицин, за исключением особых случаев, не применяют при нарушении выделительной способности почек, а также после назначения других фототоксических или нефротоксических препаратов. «Сшитые» антибиотики на основе азитромицинаАзитромицин (схема 5) является полусинтетическим антибиотиком, первым представителем подкласса азалидов, несколько отличающихся по структуре от классических макролидов, основу химической структуры которых составляет макроциклическое лактонное кольцо. Получен модификацией 14-членных макролидов путем включения атома азота в лактонное кольцо между 9 и 10 атомами углерода, кольцо при этом превращается в 15-членное. Данная структурная перестройка обусловливает значительное повышение кислотоустойчивости препарата. 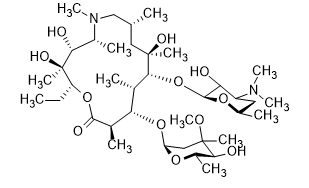 Схема 5 - азитромицин Идея получения химерных антибиотиков призвана получить антибиотики двойного действия на основе макролидного антибиотика азитромицина и гликопептидных антибиотиков, обладающие антибактериальной активностью. Объединение в одной молекуле азитромицина с другим антибактериальным агентом потенциально расширияет спектр действия полученного химерного антибиотика по сравнению со спектрами действия исходных антибиотиков. Фармакокинетические свойства такого химерного антибиотика могут превосходить фармакокинетические свойства второго антибактериального агента, использованного для его синтеза. Гликопептидные антибиотики выбраны в качестве второго антибактериального агента при синтезе химерных антибиотиков на основе азитромицина, поскольку они активны в отношении грамположительных аэробных и анаэробных микроорганизмов и являются препаратами выбора при инфекциях, вызванных широко распространенными в клиниках резистентными грамположительными бактериями. Синтез включает в реакцию ацилирования 11-O-(ω-аминоалкилкарбамоил)азитромицина гликопептидным антибиотиком (эремомицином, или ванкомицином, или агликоном тейкопланина) в присутствии конденсирующего агента. Структурная формула подобных антибиотиков представлена ниже: 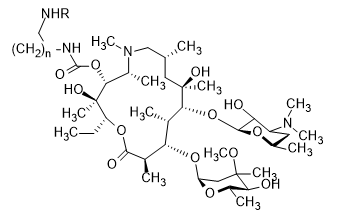 Схема 6 – гликопептидные производные азитромицина, R – ванкомиин, эремомицин или тейкопланин «Сшитые» гликопептид-цефалоспориновые антибиотикиЦефалоспорины (англ. cephalosporins) — это класс β-лактамных антибиотиков, в основе химической структуры которых лежит 7-аминоцефалоспорановая кислота (7-АЦК). Основными особенностями цефалоспоринов по сравнению с пенициллинами являются их большая резистентность по отношению к β-лактамазам — ферментам, вырабатываемым микроорганизмами. Как оказалось, первые антибиотики-цефалоспорины, имея высокую антибактериальную активность, полной устойчивостью к β-лактамазам не обладают. Сшитые соединения гликопептид-цефалоспорин полезны в качестве антибиотиков. Среди других свойств было обнаружено, что соединения обладают удивительной и неожиданной активностью против грамположительных бактерий, включая метициллинрезистентные золотистые стафилококки (MRSA) и метициллинрезистентный эпидермит стафилококков (MRSE). Соединение, о котором идет речь, имеет следующую формулу: 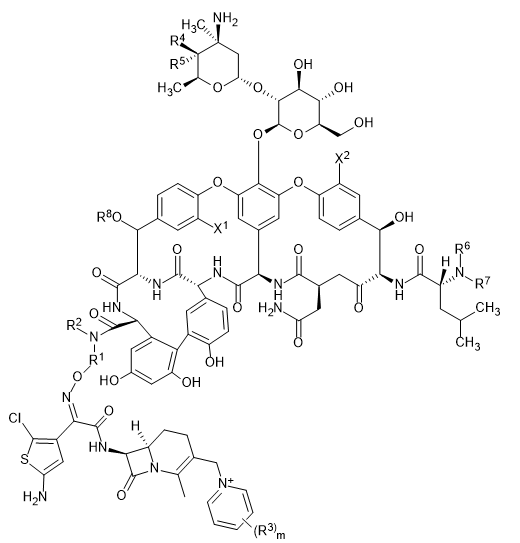 Схема 7 - гликопептид-цефалоспориновый антибиотик X1 и X2 – хлор или фодород, Ri – различные радикалы (i = 3…8) Соединения подобного строения имеют свойства одновременно гликопептидных и цефалоспориновых антибиотиков, что понижает шансы на выработку резистентности бактерий. Кроме того, увеличивается эффективность лечения. ЗАКЛЮЧЕНИЕГликопептидные антибиотики имеют большое значение, так как являются эффективными в лечении заболеваний, вызванных антибиотикорезистентными стафилококками и стрептококками. Синтез таких соединений очень сложен, поэтому такие антибиотики – полусинтетические. В работе мы рассмотрели лишь некоторые соединения. На примере тейкопланина мы рассмотрели общий принцип построения остова молекулы. Дальнейшие модификации не рассматривались ввиду сложности процесса синтеза. Хорошую эффективность показывают химерные антибиотики, сочетающие в себе свойства двух или более антибиотиков. Такие вещества эффективны в лечении заболеваний, возбудители которых резистентны к стандартным препаратам, выработать резистентность к такому препарату довольно трудно и продолжительно. СПИСОК ЛИТЕРАТУРЫКросс-сшитые гликопептид-цефалоспориновые антибиотики [Текст]: пат. WO2003031449A2 США : МПК7 А 2 С07D 501/00 Дехнич А.В. Телаванцин - новый препарат, активный против полирезистентных грамположительных возбудителей. Клинические и микробиологические аспекты в вопросах и ответах // Клиническая микробиология и антимикробная химиотерапия. – 2015. – № 2. – С. 127–145. Принцевская С.С. Гибридные антибиотики на основе азитромицина и гликопептидов - синтез и антибактериальная активность // Антибиотики и химиотерапия. – 2016. – № 12. – С. 3–8. Джордан Д. и Рейнольдс П. Ванкомицин, в кн.: Механизм действия антибиотиков, пер. с англ., под ред. Г. Ф. Гаузе, т. 1, с. 107 Клиническая фармакология: учебник / В. Г. Кукес и др.; под ред. В. Г. Кукеса, Д. А. Сычева. – 5-е изд., испр. и доп. — М.: ГЭОТАР-Медиа, 2015. — 1024 с. http://www.rusmedserv.com/antibioroom/glyc_art.htm https://www.webapteka.ru/drugbase/name71365.html |
