Отчет ЛАБА. Химические свойства кислот, оснований, солей
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №1 по дисциплине «Химия» Тема: Химические свойства кислот, оснований, солей
Санкт-Петербург 2021 2 Цель работы: Ознакомление с методами получения оксидов, оснований, кислот, солей и изучение их химических свойств. Основные теоретические положения Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом. В зависимости от второго элемента оксиды проявляют разные химические свойства.
3 Основания – это гидроксиды металлов, при диссоциации которых образуются гидроксид-ионы (ОН−) и основные остатки. Кислотность оснований определяется числом гидроксид-ионов в молекуле основания. Многокислотные основания диссоциируют ступенчато. По растворимости в воде различают: основания, растворимые в воде (NaOH, Ba(OH)2) – щелочи (гидроксиды щелочных и щелочно-земельных металлов), основания, нерастворимые в воде (Fe(OH)2, Al(OH)3). Щелочи получают, растворяя в воде оксиды щелочных и щелочно-земельных металлов. Основания реагируют с кислотными оксидами и кислотами с образованием соли и воды и не реагируют с основными оксидами и щелочами. Нерастворимые основания разлагаются при нагревании. Амфотерные гидроксиды проявляют как основные, так и кислотные свойства. Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода и анионы кислотных остатков. По наличию кислорода в своем составе кислоты делятся на бескислородные (HCl, HBr) и кислородсодержащие (H2SO4, H3PO4). Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений (ряд активностей металлов), образуют соли и выделяют водород. Водород не выделяется при взаимодействии металлов с азотной и концентрированной серной кислотами. Кислоты реагируют с основными оксидами и основаниями, образуя соль и воду. Соли – электролиты, при диссоциации которых образуются катионы основных остатков и анионы кислотных остатков. Соли делятся на средние (KCl, Na3PO4), кислые (NaH2PO4, KHSO3) и основные 4 (Cu(OH)NO3, Al(OH)2Cl). Средние соли можно рассматривать как продукты полного замещения катионов водорода в кислоте катионами металла или как продукты полного замещения гидроксогрупп основания кислотными остатками. Кислые соли – продукты неполного замещения катионов водорода многоосновных кислот катионами металла. Их образуют только многоосновные кислоты. Основные соли по составу являются продуктами неполного замещения гидроксогрупп основания кислотными остатками. Основные соли образуются только многокислотными основаниями. Кислые и основные соли превращаются в средние при действии щелочи на кислую соль, а также при действии кислоты на основную соль. 5 Протокол наблюдений Лабораторная работа No 1 «Химические свойства кислот, оснований, солей»  6 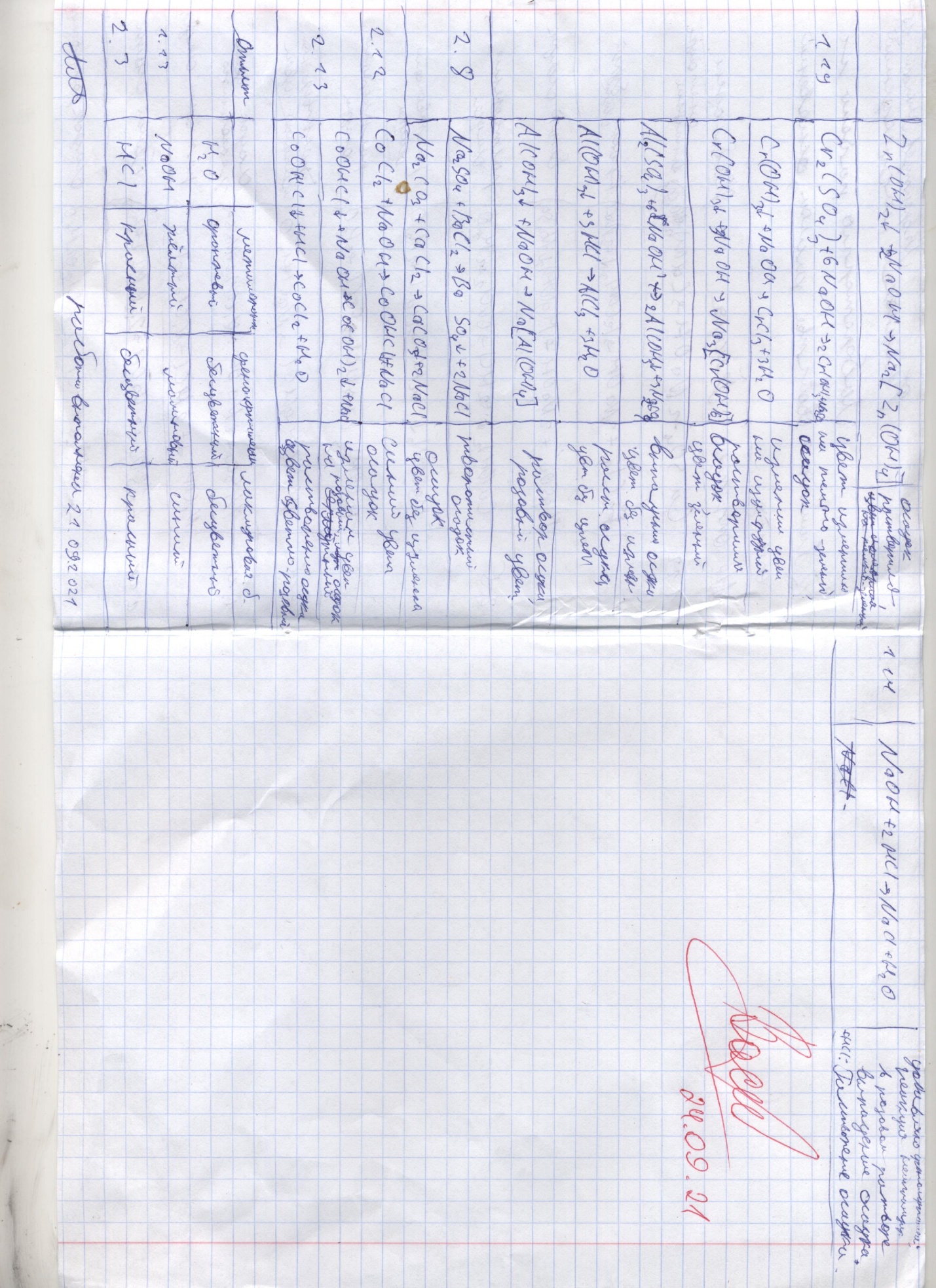 7 Обработка результатов СuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 Cu+2 + SO4–2 + 2Na+ + 2OH– → Cu(OH)2 ↓ + 2Na+ + SO4–2 Cu+2 + 2OH– → Cu(OH)2↓ СuSO4 – сульфат меди(II); NaOH – гидроксид натрия; Cu(OH)2 – гидроксид меди(II); Na2SO4 – сульфат натрия. MgSO4 + 2NaOH → Mg(OH)2↓ + Na2SO4 Mg+2 + SO4–2 + 2Na+ + 2OH– → Mg(OH)2↓ + 2Na+ + SO4–2 Mg+2 + 2OH– → Mg(OH)2↓ MgSO4 – сульфат магния; NaOH – гидроксид натрия; Mg(OH)2 – гидроксид магния; Na2SO4 – сульфат натрия. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl Fe+3 + 3Cl– + 3Na+ + 3OH– → Fe(OH)3↓ + 3Na+ + 3Cl– Fe+3 + 3OH– → Fe(OH)3↓ FeCl3 – хлорид железа(III); NaOH – гидроксид натрия; Fe(OH)3 – гидроксид железа(III); NaCl – хлорид натрия. Опыт 2.5 Cu(OH)2↓ + 2HCl → CuCl2 +2H2O Cu(OH)2↓ + 2H+ + 2Cl- → Cu+2 + 2Cl– + 2H2O Cu(OH)2↓ + 2H+ → Cu+2 + 2H2O Cu(OH)2↓ – гидроксид меди(II); HCl – соляная кислота; CuCl2 – хлорид меди(II); H2O – вода. Mg(OH)2↓ + 2HCl → MgCl2 + 2H2O Mg(OH)2↓ + 2H+ + 2Cl– → Mg+2 + 2Cl– + 2H2O Mg(OH)2↓ + 2H+ → Mg+2 + 2H2O Mg(OH)2↓ – гидроксид магния; HCl – соляная кислота; MgCl2 – хлорид магния; H2O – вода. Fe(OH)3↓ + 3HCl → FeCl3 + 3H2O Fe(OH)3↓ + 3H+ + 3Cl– → Fe+3 + 3Cl– + 3H2O 8 Fe(OH)3↓ + 3H+ → Fe+3 + 3H2O Fe(OH)3↓ – гидроксид железы(III); HCl – соляная кислота; FeCl3 – хлорид железы(III); H2O – вода. Опыт 1.14 NaOH + HCl → NaCl + H2O Na+ + OH– + H+ + Cl– → Na+ + CL– + H2O H+ + OH– → H2O NaOH – гидроксид натрия; HCl – соляная кислота; NaCl – хлорид натрия; H2O – вода. Опыт 1.16 NiSO4 + 2NaOH → Ni(OH)2↓ + Na2SO4 Ni+2 + SO4–2 + 2Na+ + 2OH– → Ni(OH)2↓ + 2Na+ + SO4–2 Ni+2 + 2OH– → Ni(OH)2↓ NiSO4 – сульфат никеля(II); NaOH -гидроксид натрия; Ni(OH)2↓– гидроксид никеля(II); Na2SO4-сульфат натрия. Ni(OH)2↓ + 2HCl → NiCl2 + 2H2O Ni(OH)2↓ + 2H+ + 2Cl– →Ni2+ + 2Cl– + 2H2O Ni(OH)2↓ + 2H+ → Ni2+ + 2H2O Ni(OH)2 – гидроксид никеля (II); HCl – соляная кислота; NiCl2 – хлорид никеля (II); H2O - вода. Опыт 1.18 ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4 Zn2+ + SO42– + 2Na+ + 2OH– → Zn(OH)2↓ + 2Na+ + SO42– Zn2+ + 2OH– → Zn(OH)2↓ ZnSO4 – сульфат цинка; NaOH – гидроксид натрия; Zn(OH)2 – гидроксид цинка; Na2SO4 – сульфат натрия. Zn(OH)2↓ + 2HCl → ZnCl2 + 2H2O Zn(OH)2↓ + 2H+ + 2Cl– → Zn2+ + 2Cl– + 2H2O Zn(OH)2↓ + 2H+ → Zn2+ + 2H2O 9 Zn(OH)2 – гидроксид цинка; HCl – соляная кислота; ZnCl2 – хлорид цинка; H2O - вода. Zn(OH)2↓ + 2NaOH → Na2[Zn(OH)4] Zn(OH)2↓ + 2Na+ + 2OH– → 2Na+ + [Zn(OH)4]2– Zn(OH)2↓ + 2OH– → [Zn(OH)4]2– Zn(OH)2 – гидроксид цинка; NaOH – гидроксид натрия; Na2[Zn(OH)4] – тетрагидроксоцинкат натрия. Опыт 1.19 Cr2(SO4)3 + 6NaOH → 2Cr(OH)3↓ + 3Na2SO4 2Cr3+ + 3SO42– + 6Na+ + 6OH– → 2Cr(OH)3↓ + 6Na+ + 3SO42– 2Cr3+ + 6OH– → 2Cr(OH)3↓ Cr3+ + 3OH– → Cr(OH)3↓ Cr2(SO4)3 – сульфат хрома (III); NaOH – гидроксид натрия; Cr(OH)3 – гидроксид хрома (III); Na2SO4 – сульфат натрия. Cr(OH)3↓ + 3HCl → CrCl3 + 3H2O Cr(OH)3↓ + 3H+ + 3Cl– → Cr3+ + 3Cl– + 3H2O Cr(OH)3↓ + 3H+ → Cr3+ + 3H2O Cr(OH)3 – гидроксид хрома (III); HCl – соляная кислота; CrCl3 – хлорид хрома (III); H2O - вода. Cr(OH)3↓ + 3NaOH → Na3[Cr(OH)6] Cr(OH)3↓ + 3Na+ + 3OH– → 3Na+ + [Cr(OH)6]3– Cr(OH)3↓ + 3OH– → [Cr(OH)6]3– Cr(OH)3 – гидроксид хрома (III); NaOH – гидроксид натрия; Na3[Cr(OH)6] – гексагидроксохромат натрия. Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4 2Al3+ + 3SO42– + 6Na+ + 6OH– → 2Al(OH)3↓ + 6Na+ + 3SO42– 2Al3+ + 6OH– → 2Al(OH)3↓ Al3+ + 3OH– → Al(OH)3↓ 10 Al2(SO4)3 – сульфат алюминия; NaOH – гидроксид натрия; Al(OH)3 – гидроксид алюминия; Na2SO4 – сульфат натрия. Al(OH)3↓ + 3HCl → AlCl3 + 3H2O 3H+ + Al(OH)3↓ + Cl– → Al3+ + 3Cl– + 3H2O 3H+ + Al(OH)3↓ → Al3+ +2Cl– + 3H2O Al(OH)3 – гидроксид алюминия; HCl – соляная кислота; AlCl3 – хлорид алюминия; H2O – вода. Al(OH)3↓ + NaOH → Na[Al(OH)4] Na+ + Al(OH)3↓ + OH–- → Na[Al(OH)4] Al(OH)3 – гидроксид алюминия; NaOH – гидроксид натрия; Na[Al(OH)4] – тетрагидроксоалюминат натрия. Опыт 2.8 Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl 2Na+ + SO4–2 + Ba+2 + 2Cl– → BaSO4↓ + 2Na+ + 2Cl– Ba+2 + SO4–2 → BaSO4↓ Na2SO4 – сульфат натрия; BaCl2 – хлорид бария; BaSO4 – сульфат бария; NaCl – хлорид натрия. Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl 2Na+ + 3CO–2 + Ca+2 + 2Cl → CaCO3↓ + 2Na+ + 2Cl– Ca+2 + 3CO-2 → CaCO3↓ Na2CO3 – карбонат натрия; CoCl2 – хлорид кобальта; CaCO3↓ – карбонат кальция; NaCl – хлорид натрия. Опыт 2.12 CoCl2 + NaOH → CoOHCl↓ + NaCl Co+2 + 2Cl– + Na+ + OH– → CoOHCl↓ + Na+ + Cl– Co+2 + OH– + Cl– → CoOHCl↓ CoOHCl – гидроксихлорид кобальта; NaOH – гидроксид натрия; CoCl2 – хлорид кобальта; NaCl – хлорид натрия. 11 Опыт 2.13 CoOHCl↓ + NaOH → Co(OH2)↓ + NaCl CoOHCl↓ + Na+ + OH– → Co(OH2)↓ + Na+ + Cl– CoOHCl↓ + OH– → Co(OH2)↓ + Cl– NaOH – гидроксид натрия; CoOHCl – гидроксихлорид кобальта; Co(OH2) – гидроксид кобальта (II); NaCl – хлорид натрия. CoOHCl↓ + HCl → CoCl2 + H2O CoOHCl↓ + H+ + Cl– → Co+2 + 2Cl– + H2O H+ + CoOHCl↓ → Co+2 + Cl– + H2O CoOHCl – гидроксихлорид кобальта; HCl – соляная кислота; CoCl2 – хлорид кобальта; H2O – вода. Для 1.13 и 2.3 результаты опытов свести в таблицу вида:
Выводы: 1)Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. 2)Щёлочи и нерастворимые основания взаимодействуют с кислотами, при этом образуются соль и вода. 3)Амфотерные гидроксиды способны реагировать как с кислотами, так и со щелочами, проявляя как основные, так и кислотные свойства. 4)При взаимодействии соли и щелочи происходит реакция обмена. 5)При взаимодействии солей друг с другом происходит реакция обмена. |
