Методы химико-токсикологического анализа. Химикотоксикологического анализа
 Скачать 210.5 Kb. Скачать 210.5 Kb.
|
|
МЕТОДЫ ХИМИКО-ТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА ВВЕДЕНИЕМетодические указания по химико-токсикологическому анализу предназначены для проведения лабораторно-практических занятий по курсу токсикологии. В методических указаниях подробно изложен порядок определения токсических веществ в объектах ветеринарного надзора. Приведены используемые в настоящее время методы качественного и количественного анализа. В конце каждой темы дано задание по фармакотерапии отравлений различными группами препаратов, что позволяет комплексно подойти к решению проблем токсикологии. Тестовое программированное задание по теме способствует закреплению знаний студентов. Знакомить студентов с методическими указаниями целесообразно после прослушивания лекций и изучения соответствующего материала по учебным пособиям. Используя методические указания, студенты выполняют практическую работу по токсикологии, а также закрепляют полученный на лекциях материал. Перед проведением лабораторных исследований студенты должны изучить теоретический материал по каждой теме занятий, используя следующую схему: 1. Общая характеристика группы. 2. Основные соединения,применяемые в сельском хозяйстве, их физико-химические свойства, токсичность. 3. Условия, способствующие отравлению животных и птиц. 4. Пути проникновения яда в организм. 5. Всасывание, распределение, биотрансформация и выделение яда. 6. Механизм токсического действия. 7. Клинико-физиологические изменения у животных. 8. Патологоанатомические изменения. 9. Диагностика отравлений. 10. Первая помощь и лечение отравлений. 11. Профилактика отравлений. 12. Вопросы реализации продуктов и кормов, содержащих токсические соединения. ТЕМА 1 ТОКСИКОЛОГИЯ ПОВАРЕННОЙ СОЛИ Работа 1. Определение натрия хлорида в содержимом желудка (метод Фольгарда) Принцип метода. Ионы хлора осаждаются избыточным количеством азотнокислого серебра. Затем избыток последнего, не вступивший в реакцию с хлоридом, оттитровывают раствором роданида аммония в присутствии железоаммонийных квасцов, взятых в качестве индикатора. По разности результатов двух титрований определяют объем раствора серебра нитрата, израсходованного на осаждение ионов хлора. Материальное оснащение: 0,1 н. раствор серебра нитрата; 0,1 н. раствор роданида аммония; насыщенный (40%-ный) раствор железо-аммонийных квасцов; азотнаякислота, разбавленная поттолам с водой; мерная колба на 100 мл; водяная баня; бумажный фильтр. Ход опыта. 10 г материала переносят в мерную колбу на 100 мл, доливают водой до метки, нагревают на водяной бане при 80 °С в течение 30 мин. После охлаждения смесь фильтруют. К 25 мл фильтрата добавляют 20-25 мл 0,1 н. раствора серебра нитрата, 1,5-2 мл раствора квасцов и 5 мл разбавленной азотной кислоты. Смесь титруют 0,1 н. раствором роданида аммония до слабо-оранжевого цвета до появления не исчезающего при энергичном взбалтывании коричнево-розового окрашивания. Рассчитывают по формуле: 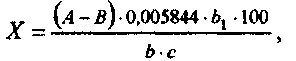 где X -содержание натрия хлорида, %; А -количество прибавленного 0,1 н. раствора серебра нитрата, мл; В - количество 0,1 н. раствора роданида амония, пошедшего на титрование, мл; b - объем водной вытяжки, взятой для анализа; Ьг- общий объем водной вытяжки, мл; с - навеска объекта,г; 0,005844 - количество натрия хлорида, г, соответствующее 1 мл 0,1 н. раствора серебра нитрата. Работа 2. Определение натрия хлорида аргентометрическим методом (метод Мора) Принцип метода основан на извлечении натрия хлорида из корма или патматериала дистиллированной водой с последующим титрова нием иона хлора раствором серебра нитрата в присутствии индикатора - калия хромата. После связывания иона хлора серебром избыток серебра нитрата реагирует с калия хроматом, образуя серебра хромат краснокирпичного цвета. Материальное оснащение: 10 г патматериала, мерная колба на 100 мл, дистиллированная вода, термометр, бумажный фильтр, коническая колба, 10%-ный раствор калия хромата, ОД н. раствор серебра нитрата. Ход опыта. Патматериал помещают в мерную колбу на 100 мл, заливают до 3/4 объема водой, хорошо встряхивают и нагревают на водяной бане до 80 °С. Через 30 мин охлаждают до комнатной температуры, периодически встряхивая, доводят водой до метки, встряхивают и фильтруют через бумажный фильтр в сухой стакан. 20 мл фильтрата переносят в коническую-колбу, приливают 1 мл 10%-ного раствора калия хромата и титруют 0,1 н. раствором серебра нитрата до появления неисчезающего кирпично-красного окрашивания. Содержание натрия хлорида вычисляют по формуле: 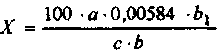 где X - содержание натрия хлорида, %; а-количество раствора серебра нитрата, пошедшего на титрование, мл; Ъ - объем вытяжки, взятой для титрования, мл; Ь\— общий объем вытяжки, мл; с - навеска объекта, г; 0,00584 - количество натрия хлорида (г) связывающегося с 1 мл 0,1 н. раствора серебра нитрата. Задание по фармакотерапии Выписать в рецептах и объяснить действие препаратов: 1. Свинье - антидот при отравлении поваренной солью. 2. Двум коровам - 10%-ный раствор кальция хлорида для внутривенной инъекции. 3. Овце - кордиамин при сердечной слабости. 4. Свинье - слабительное средство при отравлении натрия хлоридом. 5. Собаке - слизь семян льна на два приема. 6. Рассчитать потребность в 10%-ном растворе кальция хлорида для 20 коров при отравлении поваренной солью. Вопросы программированного контроля I. Указать два вида животных и один вид птиц, наиболее чувствительных к избытку натрия хлорида. 1. Крупный рогатый скот. 2. Лошади. 3. Овцы. 4. Свиньи. 5. Собаки. 6. Куры. 7. Гуси. 8. Утки. П. Отметите/основные биохимические изменения в крови при избыточном поступлении натрия хлорида в организм. 1. Увеличение количества ионов натрия в эритроцитах. 2. Увеличение количества ионов натрия в плазме. 3. Повышение содержания молочной кислоты. 4. Повышение содержания калия. 5. Понижение содержания калия. 6. Повышение содержания фосфора. 7. Понижение содержания фосфора. III. Метод изоляции натрия хлорида из биологического материала. 1. Дистилляция с водяным паром. 2. Извлечение водой. 3. Экстракция органическими растворителями. 4. Минерализация. 5. Диализ. IV. Отметить наиболее точный метод количественного определения натрия хлорида в биологическом материале. 1. Определение обратным титрованием. 2. Определение прямым титрованием. 3. Определение при помощи азотнокислой ртути. V. С помощью каких методов можно обнаружить в моче хлориды. 1. Метод Мора. 2. Метод Воточека. 3. Метод Грисса. VI. Какое количество хлоридов в содержимом желудка является токсичным для всех видов животных и птиц. 0,5%; 2) 1%; 3) 0,25%. тема 2 ТОКСИКОЛОГИЯ НИТРИТОВ И НИТРАТОВ Работа 1. Токсическое действие нитритов Материальное оснащение: лягушка, восковая пластинка, скальпель, ножницы, шприц, раствор натрия нитрита и 0,6%-ный раствор поваренной соли, фильтровальная бумага, пробирки. Ход опыта. Лягушку фиксируют на восковой или пробковой пластинке, на которой растягивают перепонку задней конечности. В лимфатический мешок вводят 1 мл 10%-ного раствора натрия нитрита. Через 5-10 мин наблюдают изменения сосудов плавательной перепонки, их количество и диаметр. Затем лягушку наркотизируют, разрушают спинной мозг, вскрывают грудную и брюшную полости, обращают внимание на окраску внутренних органов, сравнивают с окраской у контрольной лягушки. Сделав надрез верхушки сердца, набирают кровь в пробирку и разбавляют 0,6%-ным раствором натрия хлорида приблизительно в 10 раз. Несколько капель крови наносят на фильтровальную бумагу. Сравнивают цвет крови лягушки, которая получила нитрит натрия и контрольной лягушки. Кровь в пробирке подвергают спектроскопическому анализу, сравнивая со спектром нормальной крови. Сделать вывод о характере действия нитритов на кровь и просвет сосудов. Письменно объяснить механизм токсического влияния нитритов на организм. Работа 2. Определение нитритов (качественные пробы) Материальное оснащение: пробирки, диализат, 1%-ный раствор дифениламина в серной кислоте, реактив Грисса. Ход опыта В пробирку наливают 1 мл диализата. Сюда же по стенкам осторожно прибавляют 1 мл 1%-ного раствора дифениламина в серной кислоте. На границе соприкосновения двух слоев образуется голубое кольцо. Чувствительность реакции 5 мг/л. В дальнейшем анионы дифференцируют следующим образом. К 1 мл диализата добавляют чистой пипеткой реактив Грисса. Нитриты дают красное окрашивание, нитраты оставляют смесь без изменений. При оценке результатов пробы следует принимать во внимание, что реакция на нитриты с реактивом Грисса очень чувствительная, только темно-красное или красное окрашивание может вызвать подозрение на отравление нитритами и поставить задачу дальнейшего более основательного исследования присланного объекта на нитриты. ОПРЕДЕЛЕНИЕ НИТРИТОВ И НИТРАТОВ В СВЕКЛЕ Материальное оснащение: чашка Петри, срез свеклы (картофеля), концентрированная серная кислота, дифениламин, пинцет. Ход опыта. Несколько кристаллов дифениламина наносят на поверхность свежего среза свеклы (или картофеля) и смазывают их несколькими каплями концентрированной серной кислоты. Интенсивное синее окрашивание поверхности среза свеклы указывает на большое количество нитритов и нитратов. Работа 3. Количественное определение нитритов по методу Грисса Принцип метода. Метод основан на способности раствора альфа-нафтиламина и сульфаниловой кислоты в присутствии нитритов давать красное окрашивание. Материальное оснащение: 10 пробирок, стандартный раствор натрия нитрита дистиллированная вода, исследуемый фильтрат, реактив Грисса, пипетки на 1-2 и 5-10 мл. Подготовка материала. 10,0 г измельченного материала встряхивают в течение часа в 50 мл дистилированной воды, затем доливают до 100 мл и фильтруют. Если фильтрат окрашен, то его обесцвечивают взбалтывая, окисью алюминия из расчета 0,1 г на 100 мл. Отстаивают 2 ч. Затем отстоявшуюся жидкость сливают и исследуют. Для отделения белков смесь подвергают диализу общепринятым способом. Ход опыта. В 10 пробирок из бесцветного стекла наливают пипеткой стандартный раствор нитрита натрия в количествах, указанных в таблице:
Объем жидкости в каждой пробирке доводят до 10 мл дистиллированной водой. Одновремено в опытную пробирку наливают 10 мл исследуемого фильтрата, затем во все 11 пробирок прибавляют по 0,5 мл реактива Грисса. Через 15 мин сравнивают окраску исследуемого раствора со стандартной шкалой растворов натрия нитрита и находят количество нитритов в исследуемом фильтрате Вместо 10 пробирок можно брать 5 (меньшее количество разведении). Содержание натрия нитрита в исследуемом материале в мг/кг находят по формуле: 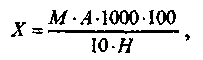 где М-содержание нитритов в 10 мл исследуемого фильтрата, мг (находят при колориметрировании по стандартной шкале в опытной пробирке); А - общее количество фильтрата, мл; Я - навеска исследуемого материала, г; 1 мл стандартного раствора содержит 0,0075 мг нитрита натрия. Работа 4. Антидотная терапия приотравлении нитритами Задание. Выписать рецепт, приготовить раствор, содержащий 0,6 г метиленового синего, 5 мл спирта этилового и 60 мл стерильного изотонического раствора натрия хлорида. Свинье на одно внутривенное введение. Обосновать применение метиленового синего при отравлении животных нитритами. Ориентировочные разовые токсические дозы нитратов и нитритов для с.-х. животных (внутрь г/кг):
Задание по фармакотерапии Выписать в рецептах и объяснить действие препаратов: 1.10 коровам - раствор метиленового синего. 2. Корове - аскорбиновую кислоту для внутривенного введения. 3. Овце - молочную кислоту. 4. Свинье - средство для устранения тканевой аноксии. 5. Быку - средство для восстановления функций желудочно-кишечного тракта. 6. Рассчитать потребность в аскорбиновой кислоте для 50 коров при отравлении их нитритами. Вопросыпрограммированного контроля I. С какой целью используют соединения азотной и азотистой кислот в сельском хозяйстве. I. Инсектициды. 2. Фунгициды. 3. Гербициды. 4. Минеральные удобрения. 5. Минеральная подкормка для животных. II. Указать растения, накапливающие при определенных условиях нитраты. 1. Свекла. 2. Брюква. 3. Кукуруза. 4. Овес. 5. Ячмень. 6. Горох. 7. Люцерна. 8. Клевер. 9. Подсолнечник. Ш. Какое количество нитритов предельно допустимо в зеленой массе? 1) 0,5%; 2) 1%; 3) 1,5%; 4) 3%. IV. Указать животных, наиболее чувствительных к нитритам. 1. Крупный рогатый скот. 2. Овцы. 3. Свиньи. V. Отметить изменения в организме животных, характерные для действия нитритов. 1. Повышение тонуса сосудов. 2. Понижение тонуса сосудов. 3. Тахикардия. 4. Брадикардия. 5. Одышка. 6. Замедление дыхания. 7. Образование карбоксигемоглобина. 8. Образование метгемоглобина. VI. Отметить, при каком количестве метгемоглобина наступает тканевая аноксия 1) 1/4 гемоглобина превращена в метгемоглобин; 2) 1/3 гемоглобина превращена в метгемоглобин. VII. Укажите метод количественного определения нитритов. Метод Грисса. 2. Проба с дифениламином. ТЕМА 3 ТОКСИКОЛОГИЯ КАРБАМИДА Работа 1. Токсическое действие аммиака Материальное оснащение: белая мышь, раствор аммиака (1 мл аммиака в 10 мл воды), колпак стеклянный, шприц на 1 мл, игла, пинцет. Ход опыта. У белой мыши сосчитать число дыханий за одну минуту и определить состояние болевой чувствительности путем нажима пинцетом на кончик хвоста. Затем ввести внутрибрюшинно 0,3 мл раствора аммиака. Описать изменения в клиническом состоянии животного. Сделать вывод о характере действия аммиака на центральную нервную систему. Работа 2. Антидотная терапия приотравлении аммиаком Материальное оснащение: две белые мыши одинаковой массы, раствор аммиака (1 мл аммиака в 10 мл воды), смесь раствора аммиака (1 мл аммиака в 5 мл воды) с раствором формальдегида (1 мл 40%-ного раствора формальдегида в 5 мл воды), два колпака стеклянных, шприц, зонд металлический, пинцет. Ход опыта. Взять двух белых мышей одинаковой массы. У каждой из них сосчитать число дыханий за одну минуту и определить состояние болевой чувствительности путем нажима пинцетом на кончик хвоста. Затем первой мыши ввести внутрь через зонд 0,3 мл раствора аммиака, второй - раствор аммиака, но с добавлением формальдегида. Протокол вести по схеме:
Сделать вывод об антидотном действии формальдегида при отравлении аммиаком. Какое соединение образуется в результате взаимодействия аммиака и формальдегида. Работа 3. Метод определения карбамида (качественная реакция) ПРОБА С КОНЦЕНТРИЮВАННОЙ АЗОТНОЙ КИСЛОТОЙ Материальное оснащение: водная вытяжка из корма, азотная кислота, часовое стекло, глазные пипетки 2 шт. Ход опыта К капле водной вытяжки из корма прибавить 1-2 капли концентрированной азотной кислоты. При наличии карбамида выкристаллизовывается его азотная соль в виде шестигранных или ромбических пластинок, лежащих преимущественно кучками или чере-пицеообразно. Сделать заключение о наличии или отсутствии карбамида в корме. Работа 4. Качественное определение карбамида в корме Материальное оснащение: корм, содержащий карбамид, пробирка с пробкой, лакмусовая бумажка красная, горелка, реактив Миллона. Ход опыта Корм, содержащий карбамид, помещают в широкую пробирку, которую неплотно закрывают пробкой с укрепленной на ней красной лакмусовой бумажкой так, чтобы она не касалась стенок пробирки. Пробирку с кормом нагревают над пламенем горелки до появления белого дыма. В присутствии карбамида красная лакмусовая бумажка синеет (образование аммиака). Объяснить принцип метода. РЕАКЦИЯ ПО АРХАНГЕЛОВУ К большой капле водного раствора карбамида прибавляют маленькую каплю реактива Миллона. Выпадает белый осадок - двойная соль ртути и карбамида и одновременно выделяются пузырьки газа. Осадок постепенно перекристализовывается, образуя кристаллы в виде шляпок грибов, которые при длительном отстаивании частично превращаются в звездчатые скопления и розетки из ромбов и параллелограммов. Чувствительность 0,5 мг. Продолжительность реакции около 30 мин. Работа 5. Экспресс-метод количественного определения карбамида в кормах и содержимом рубца Материальное оснащение: водная вытяжка из содержимого рубца, спирт этиловый подкисленный - 20 мл, 5%-ный раствор фенола -20 мл, стандартный раствор карбамида - 50 мл (содержащий 1 мг карбамида в 1 мл), кислота соляная - 10 мл, 2,5%-ный раствор кальция гипохлорита - 50 мл, штатив, пробирки - 6 шт., пипетка на 3 мл - 3 шт., пипетка на 1 мл - 3 шт. Принцип метода. Метод основан на способности водно-спиртового раствора мочевины взаимодействовать в присутствии фенола и соляной кислоты с гипохлоритом кальция. При этом появляется специфическое окрашивание. Интенсивность окраски зависит от концентрации мочевины в растворе. Метод специфичен и обладает большой чувствительностью. Подготовка материала к исследованию. Навеску корма или содержимого рубца в количестве 50 г заливают 300 мл дистиллированной воды, размешивают в течение 30 мин, фильтруют и отстаивают. Из верхнего слоя берут пипеткой 1 мл жидкости, переносят в мерную колбу на 50 мл и доводят до метки водой. Ход опыта Для анализа берут 1 мл жидкости из колбы, переносят в колориметрическую пробирку, сюда же добаляют 3 мл подкисленного спирта, 0,5 мл 2,5%-ного раствора кальция гипохлорита и 0,5 мл 5%-ного раствора фенола. Пробирку встряхивают. Указанная последовательность внесения реактивов обязательна. Таким же образом готовят пробирку с контрольной пробой. Количество карбамида определяют по колориметрической шкале, которую готовят вместе с испытуемой и контрольной пробами. Для приготовления колориметрической шкалы готовят сначала стандартный раствор карбамида, содержащий 1 мг мочевины в 1 мл, путем растворения 50 мг в 50 мл спирта. Для построения колориметрической шкалы из стандартного раствора карбамида готовят серию растворов, с содержанием карбамида в первой пробирке 20 мкг, во второй - 40 мкг, в третьей 60 мкг, в четвертой и пятой - 80 и 100 мкг соответственно. Затем, в каждую пробирку вносят до объема 3 мл спирт,подкисленный соляной кислотой, по 0,5 мл раствор кальция гипохлорита и по 0,5 мл раствор фенола. Пробирки встряхивают. Колориметрирование проводят через 20 мин после внесения последнего реактива в опытные и контрольные пробирки. Расчет ведут по формуле: 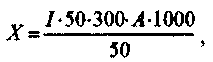 где / - количество испытуемой жидкости, взятое для исследования; 50 - количество разведенного испытуемого раствора, мл (в числителе); 300 - количество жидкости, используемой для экстрагирования карбамида из навески, мл; 1000 - пересчет на 1кг корма или содержимого рубца; А - количество карбамида в пробирке стандартной шкалы, соответствующей по цвету испытуемому раствору; 50 - навеска корма или содержимого рубца, взятых для анализа (в знаменателе). Задание по фармакотерапии Выписать в рецептах и объяснить действие препаратов: 1. Корове - 10%-ный раствор натрия глутамата. 2. Овце - средство для ослабления и снятия тетанических судорог. 3. Быку - средство, изменяющее реакцию содержимого рубца в кислую сторону и понижающее активность уреазы. 4. Корове - антидот при отравлении мочевиной. 5.10 овцам - средство для стимуляции сердечной деятельности. 6. Рассчитать потребность в молочной кислоте для 10 коров при отравлении карбамидом. Вопросы программированного контроля I. Аммонийные соединения, используемые для удобрения почвы. 1. Аммония хлорид. 2. Аммония карбонат. 3. Нашатырный спирт. 4. Аммония сульфат. 5. Аммония нитрат. 6. Карбамид. 7. Аммония бикарбонат. 8. Аммиачная вода. П. Указать аммонийное соединение, применяемое в медицине и ветеринарии в качестве отхаркивающего средства. 1. Аммония хлорид. 2. Аммония гидрокарбонат. 3. Карбамид. III. Какое количество карбамида следует добавлять в рацион молодняка крупного рогатого скота старше б месяцев (на голову в сутки)? а) при выращивании 1) 50-90 г 2) 40-50 г б) при откорме 1) 50-90 г 2) 40-50 г IV. Какие животные более чувствительны к избыточным дозам карбамида. 1. Истощенные. 2. Упитанные. 3. Голодные. 4. Накормленные. 5. В рационе которых преобладают легко переваримые углеводы. 6. В рационе которых преобладают грубые малопитательные корма. V. Отметить основные клинические признаки, характерные для острого отравления карбамидом. 1. Угнетение. 2. Испуг. 3. Расслабление мускулатуры. 4. Судороги клонико-тонического характера. 5. Сухость слизистых оболочек. 6. Саливация. 7. Атония рубца. 8. Усиление сокращений рубца. VI. Лекарственные вещества, применяемые при остром отравлении карбамидом. 1. Натрия гидрокарбонат. 2. Натрия карбонат. 3. Кислота уксусная. 4. Кислота молочная. 5. Глюкоза. 6. Формалин. 7. Натрия глутамат. ТЕМА 4 ТОКСИКОЛОГИЯ СОЕДИНЕНИЙ ЦИНКА, МЕДИ, БАРИЯ И СВИНЦА Работа 1. Обнаружение цинка Материальное оснащение: часовое стекло, минерализат с цинком, концентрированный раствор аммиака, раствор дитизона в бензоле, фильтровальная бумага, пропитанная 4%-ным раствором тиомочевины, 5%-ный раствор калия железосинеродистого. Ход опыта. 1. На часовое стекло наносят 2-3 капли минерализата, который нейтрализуют одной каплей аммиака. Нейтрализованным минерализатом смачивают фильтровальную бумагу, предварительно пропитанную 4%-ным раствором тиомочевины. Держат одну минуту над открытой склянкой с концентрированным раствором аммиака. Высушивают на воздухе. Затем спрыскивают из пульверизатора раствором дитизона в бензоле (или наносят каплю раствора дитизона). При наличии цинка на бумаге появляется розово-красное или малиновое окрашивание. Для проверки реактивов на содержание цинка параллельно проводят контрольный опыт: вместо минерализата берут дистиллированную воду и проделывают все операции основного опыта. Пятно на бумаге не должно окрашиваться в розовый или красно-малиновый цвет. 2. Несколько капель минерализата смешивают с несколькими каплями 5%-ного раствора железосинеродистого калия. Появившийся белый осадок должен раствориться после прибавления раствора едкого калия. Работа 2. Обнаружение меди Материальное оснащение: минерализат, фильтровальная бумага, пропитанная 4%-ным раствором кремнекислого натрия, концентрированный раствор аммиака, 1%-ный раствор рубеановодородной кислоты. Ход опыта. 1. Две-три капли минерализата нейтрализуют аммиаком. Каплю нейтрализованного раствора наносят на полоску фильтровальной бумаги, предварительно пропитанной 4%-ным раствором кремнекислого натрия и высушивают. Фильтровальную бумагу держат над парами аммиака, подсушивают и опрыскивают из пульверизатора раствором рубеановодородной кислоты (или наносят каплю ее раствора). При наличии меди пятно окрашивается в темно-зеленый цвет. 2. Минерализат наливают в пробирку. Сюда же опускают железный гвоздик, очищенный наждачной бумагой. Подогревают на спиртовке. При наличии меди гвоздь окрашивается в красный цвет. 3. К минерализату добавляют избыток аммиака. Появляется голубое окрашивание. Работа 3. Обнаружение бария Материальное оснащение: минерализат, 10%-ный раствор серной кислоты, раствор калия бихромата, микроскоп, барий сернокислый, концентрированная серная кислота. Ход опыта. 1. К нескольким каплям минерализата прибавляют по каплям 10%-ный раствор серной кислоты. Образовавшийся белый осадок не должен растворяться в избытке серной кислоты. 2. К нескольким каплям минерализата добавляют столько же капель раствора калия бихромата. Желтый осадок не должен растворяться в избытке аммиака. 3. К крупинке бария сернокислого на предметном стекле добавляют каплю концентрированной серной кислоты. Подогревают до появления паров. Каплю рассматривают под микроскопом. Обнаруживают кристаллы в виде крестика. Работа 4. Обнаружение свинца Материальное оснащение: минерализат, 30%-ный раствор уксусной кислоты, калия нитрат, микроскоп. Ход опыта. Каплю минерализата, полученного после обработки серной и азотной кислотами, или осадка, наносят на предметное стекло. Сюда же добавляют каплю уксусной кислоты. Высушивают на спиртовке. Затем растворяют в 30%-ной уксусной кислоте и вносят несколько кристаллов натрия нитрата. Через десять минут смотрят под микроскопом. Обнаруживают черные или коричневые кубические кристаллы. Работа 5. Экспресс-метод определения меди в патологическом материале (по В.С.Газаряну) Материальное оснащение: минерализат, 20%-ный раствор желтой кровяной соли, градуированные пробирки, центрифуга. Ход опыта. К 5 мл минерализата добавляют 0,2 мл 20%-ного свежеприготовленного раствора желтой кровяной соли. В зависимости от содержания меди пробы окрашиваются от светло-розового до темно-коричневого цвета. Для количественного определения меди готовят стандартные растворы обезвоженного меди сульфата в разведениях 1 : 1000, 1 : 2000, 1 : 4000, 1 : 8000, 1:16 000, 1 : 32 000; из каждого разведения берут 5 мл и добавляют 0,2 мл раствора желтой кровяной соли. О количестве меди в пробах можно судить после центрифугирования в градуированных пробирках и учета объема осадка (при сравнении с осадком в соответствующих эталонных пробирках). ЗАДАНИЕ ПО ФАРМАКОТЕРАПИИ Выписать в рецептах и объяснить действие препаратов: 1.10 овцам - окись магния внутрь на 2 приема. 2. Корове- 10%-ный раствор натрия тиосульфата на одну внутривенную инъекцию. 3. Рассчитать потребность в унитиоле для 100 голов крупного рогатого скота и выписать рецепт. 4. 5 телятам - тетацин-кальций при отравлении соединением свинца. Объяснить механизм действия комплексонов. 5. Собаке - 2%-ный раствор сульфата меди при отравлении цинка фосфидом. 6.100 курам - уголь активированный при отравлении. 7. Лошади - солевое слабительное. 8. Теленку - слизь льняного семени на два приема 9. Раствор калия перманганата для промывания зоба при отравлении цинка фосфидом. 10. Лошади - 40%-ный раствор глюкозы с аскорбиновой кислотой на две внутривенные инъекции. 11. Рассчитать потребности в 2%-ном растворе меди сульфата 10 собакам при отравлении цинка фосфидом. Вопросы программированного контороля по токсикологии бария I. Отметить токсикологическое значение бария хлорида и бария карбоната. 1. Для уничтожения насекомых. 2. Для борьбы с грызунами. 3. Для борьбы с грибками. П. Отметить токсикологическое значение полисульфида бария 1. Для уничтожения насекомых. 2. Для борьбы с грызунами. 3. Для борьбы с грибками. Ш. Указать животных, наиболее чувствительных к препаратам бария. 1. Всеядные. 2. Травоядные. IV. Отметить эффекты, характерные для действия ионов бария 1. Тонизируют гладкую мускулатуру. 2. Расслабляют гладкую мускулатуру. 3. Ослабляют перистальтику. 4. Усиливают перистальтику. 5. Замедляют сердечные сокращения. 6. Учащают сердечные со кращения. 7. Суживают кровеносные сосуды. 8. Расслабляют кровеносные сосуды. 9. Понижают кровяное давление. 10. Повышают кровяное давление. V. Течение отравления соединениями бария. 1. Острое. 2. Хроническое. VI. Указать антидоты, применяемые при отравлении солями бария 1. Натрия хлорид. 2. Натрия сульфат. 3, Морфин. VII. На чем основано применение сернокислых солей при отравлении растворимыми солями бария? I. Ускорение выведения яда из организма. 2. Перевод бария в труднорастворимые соединения. VIII. Метод изоляции солей бария из патологического материала. 1, Перегонка с водяным паром. 2. Извлечение водой. 3. Разрушение материала концентрированной соляной кислотой и калия хлоратом. IX, На чем основан экспресс-метод обнаружения бария, Реакция с рубеановодородной кислотой. 2. Реакция с дитизо-ном. 3. Реакция с натрием родизоновокислым. X. Указать предельно допустимые концентрации бария в воде рыбохозяйственных водоемов. 1) 0,1 мг/л; 2) 2,4 мг/л; 3) 10 мг/л, XI. Санитарная оценка мяса и субпродуктов при отравлении животных барием. 1. Наличие в мясе и субпродуктах не допускается. 2. Установлены допустимые количества. 3. Мясо выпускается для пищевых целей. ХП. Указать МДУ бария в мясе. 1) 1 мг/кг; 2)10 мг/кг; 3) 300 мг/кг. Вопросы для программированного контроля по токсикологии свинца I. Токсикологическое значение тетраэтилсвинца. 1 Производство свинцовых белил. 2. Производство аккумуляторов. 3. Использование в качестве антидетонатора. П. Токсическое действие свинца. 1. Оказывает избирательное действие. 2. Является протоплазматическим ядом. III. Что характерно для хронического отравления препаратами свинца. 1. Серая или сине-черная полоска на краях десен. 2. Крапчатость зубов. 3. Кахексия. 4. Базофильная зернистость эритроцитов. IV. Отметить, в каких органах кумулируется наибольшее количество свинца. 1. Желудок. 2. Кишечник. 3. Селезенка. 4. Трубчатая кость. 5. Плоская кость. 6. Печень. 7. Почки. V. Какие вещества следует назначать для предупреждения всасывания препаратов свинца из желудочно-кишечного тракта. 1.Унитиол. 2. Натрия сульфат. 3. Магния сульфат. 4. Белок. VI. На чем основано использование сернокислых солей при отравлении свинцом. 1.Ускорение выведения яда из организма. 2. Перевод свинца в труднорастворимые соединения. VII. Антидоты, применяемые при отравлении свинцом. I. Унитиол. 2. Натрия тиосульфат. 3. Кальция тетацин. 4. Пента-цин. 5. Пеницилламин. VTJI. Указать предельно допустимую концентрацию свинца в рыбохозяйственных водоемах. 1.0,1 мг/л. 2. 0,2 мг/л. 3. 10 мг/л. IX. Санитарная оценка мяса при отравлении свинцом. 1. Не допускается в мясе и субпродуктах. 2. Установлены МДУ. 3. Мясо выпускается для пищевых целей. Вопросы для программированного контроля по токсикологии цинка I. Отметить препараты цинка, имеющие токсикологическое значение. I. Цинка сульфат. 2. Цинка хлорид. 3. Цинка фосфид. П. Указать токсикологическое значение препаратов цинка. 1.Инсектициды. 2. Фунгициды. 3. Зооциды. Ш. К какой группе ядов относится цинка фосфид? 1. Сильнодействующие. 2. Высокотоксичные. 3. Средней токсичности. 4. Малотоксичные. IV. Чем обусловлено токсическое действие цинка фосфида? 1. Образованием фосфористого водорода. 2. Действием целой молекулы. 3. Образованием цинка хлорида. V. Укажите течение отравлений фосфидом цинка. 1. Острое. 2. Хроническое. VI. Метод изоляции цинка из патологического материала. 1. Перегонка с водяным паром. 2. Извлечение водой. 3. Разрушение патматериала пергидролем с концентрированной серной кислотой. VII. На чем основан экспресс-метод обнаружения цинка? 1. Реакция с рубеановодородной кислотой. 2. Реакция с дитизо-ном. 3. Реакция с натрием родизоновокислым. VIII. Отметьте запах содержимого желудка и зоба при отравлении цинка фосфидом. 1. Чеснока. 2. Миндаля. 3. Аммиака. IX. Указать методы лечения животных, отравленных цинка фосфидом. 1. Применяют антидотные препараты. 2. Применяют патогенетическое лечение. X. Отметить слабительные, применяемые при отравлении цинка фосфидом. 1, Жирные масла. 2. Солевые слабительные. 3. Растения, содержащие антрагликозиды. XI. Указать предельно допустимые концентрации цинка в воде рыбохозяйственных водоемов. 1.0,1 мг/л. 2. 1 мг/л. 3. 10 мг/л. ХП. Санитарная оценка мяса при отравлении животных солями цинка. 1. Наличие в мясе не допускается. 2. Установлены допустимые количества. 3. Мясо выпускают для пищевых целей. Вопросы для программированного контроля по токсикологии меди I. Какой препарат меди используют в ветеринарной практике? 1. Меди хлорокись. 2. Бордосская жидкость. 3. Меди трихлорфе-нолят. 4. Купронафт. 5. Купрозан. 6. Меди сульфат. П. Отметьте использование препаратов меди в агрономии. 1. Инсектициды. 2. Гербициды. 3. Зооциды. 4. Фунгициды. 5. Ар-борициды. Ш. Отметить вид животного, наиболее чувствительный к препаратам меди. 1. Крупный рогатый скот. 2. Овцы, 3. Лошади. 4. Свиньи. 5. Собаки. IV. Указать основные клинические признаки при остром отравлении солями меди. 1. Рвота. 2. Стоматит. 3. Слюнотечение. 4. Диарея. 5. Усиление сердечной деятельности. 6. Ослабление сердечной деятельности. 7. Мышечная слабость. V. Отметить основные клинические признаки при хроническом отравлении соединениями меди. I. Истощение. 2. Желтушность слизистых оболочек. 3. Гематурия. 4. Гемоглобинурия. 5. Анемия. 6. Лейкоцитоз. VI. Какие вещества назначают для предупреждения всасывания солей меди из желудочно-кигиечного тракта? \. Белковую воду. 2. Унитиол. 3. Раствор танина. 4. Противоядие при отравлении металлами. VII. Укажите антидоты, применяемые при отравлении животных соединениям меди. 1. Натрия нитрат. 2. Натрия тиосульфат. 3. Метиленовый синий. 4. Унитиол. 5. Дикаптол. 6. Пеницилламин. Vni. Отметить, в каком органе накапливается наибольшее количество меди. 1. Печень. 2. Почки. 3. Селезенка. IX. Указать метод изоляции меди из патологического материала. 1. Экстракция 96° этиловым спиртом. 2. Изоляция путем разрушения органических веществ. 3. Извлечение водой. X. На чем основан экспресс-метод обнаружения меди. 1. Реакция с рубеановодородной кислотой. 2. Реакция с дитизо-ном. 3. Реакция с натрием родизоновокислым. XI. Почему необходимо количественное определение меди в пат-материале? 1. Ограниченное распространение меди в природе. 2. Широкое распространение меди в природе. 3. Отсутствие меди в растениях. 4. Нахождение меди во многих растениях. 5. Широкое варьирование меди в органах животных. 6. Стабильное содержание меди в органах животных. XII. Указать ПДКмеди в воде рыбохозяйственных водоемов. 1) 0,1 мг/л; 2) 1 мг/л; 3) 10 мг/л. XIII. Санитарная оценка мяса и продуктов убоя при отравлении медью.
|
