Химия кремния. Химия элементарного кремния. Получение кремния
 Скачать 51.6 Kb. Скачать 51.6 Kb.
|
|
ХИМИЯ ЭЛЕМЕНТАРНОГО КРЕМНИЯ. ПОЛУЧЕНИЕ КРЕМНИЯ. СОДЕРЖАНИЕ ОглавлениеВведение«…Кремний вырисовывается в мироздании как элемент, обладающий исключительным значением» - В.И.Вернадский. Начиная с конца 1950-х гг., кремний становится ведущим полупроводниковым материалом благодаря успешному развитию методов зонной плавки для очистки полупроводников. По распространенности он второй элемент после кислорода. Кремний обладает чрезвычайно разнообразными химическими свойствами и находит широкое применение в современной промышленности. Он является важнейшим компонентом глины, бетона, керамики, входит в состав таких более сложных систем, как растворимые силикаты, стекло, глазурь. В современных технологиях кремний применяется в виде силиконовых полимеров и в виде твердого простого вещества в электронных приборах. Технология получения сверхчистого кремния представляет собой, возможно, лучший пример тесной связи химии и физики твердого тела. Усовершенствование технологии очистки кремния привело к созданию таких устройств, как транзисторы, печатные схемы, и к развитию интегральной электроники в целом. Тема «Кремний и его соединения. Получение кремния» актуальна в XXI веке потому, что кремний является основой современной микроэлектроники, без которой невозможно дальнейшее развитие страны. Такая ситуация будет сохраняться еще длительное время благодаря неограниченным запасам исходного сырья, коммерческой доступности, развитой технологии выращивания кремния и дальнейшей его обработки. Цели работы: Изучение химии элементарного кремния, способы его получения и применения. Для решения поставленной цели необходимо решить следующие задачи: -провести аналитический обзор литературы по теме курсовой работы; - изучить историю открытия, строение, физические и химические свойства, методы получения и современные области применения кремния, его биологическая роль. Объект исследования: кремний. Предмет исследования: строение, физические и химические свойства, получение и применение кремния, биологическое значение. ГЛАВА 1. ХИМИЯ ЭЛЕМЕНТАРНОГО КРЕМНИЯКремний по внешнему виду напоминает металл; обладает серо-голубым металлическим блеском. Это легкий элемент — его плотность 2,33 г/см3; чрезвычайно тверд (царапает стекло), однако очень хрупкий — легко дробится, не корродирует на воздухе. Кристаллический кремний имеет гранецентрированную кристаллическую решетку типа алмаза октаэдрической формы. Коричневый, так называемый аморфный кремний, представляет мелкокристаллическую форму кубической модификации. Будучи ближайшим аналогом атома углерода, кремний обладает относительно малой прочностью связи — Si-Si, которая разрывается гораздо легче, чем углеродная, особенно если имеется возможность образования наиболее характерной для кремния связи с кислородом. Большая устойчивость связи Si-О налагает свой отпечаток на всю химию кремния. Само многообразие природных силикатов обусловлено именно прочностью связи Si-O-Si, играющей в химии кремния такую же основную роль, как связь С-С в органической химии. [Некрасов Б.В. 1973] 1.1 ПОЛОЖЕНИЕ КРЕМНИЯ В ПЕРЕОДИЧЕСКОЙ СИСТЕМЕ ХИМИЧЕСКИХ ЭЛЕМЕНТОВВ Периодической таблице элементов кремний находится в IV группе, посередине ряда так называемых элементов главной подгруппы. Они, в свою очередь, разбиты на периоды (слева направо: от наиболее активных металлов к наиболее активным неметаллам). Кремний — легкий элемент, расположенный под углеродом по вертикали; затем следуют его гомологи с большей атомной массой — германий, олово, свинец. Поскольку металлический характер возрастает с увеличением атомной массы, то неметалл (углерод) находится в начале группы, а два родственных металла (олово и свинец) — в конце ее. Между ними располагаются элементы, которые не являются ни металлами, ни неметаллами, их называют металлоидами. Кремний и германий являются металлоидами. Атом кремния имеет порядковый номер— 14, атомный вес - 28,086; состоит из трех стабильных изотопов: Si28 (92,27%), Si29 (4,68%) Si30 (3,05%).[ Гринвуд Н. 2008] 1.2. ИСТОРИЯ ОТКРЫТИЯ КРЕМНИЯИстория открытия химического элемента кремния имеет несколько этапов. Многие вещества, систематизированные Менделеевым, использовались человечеством на протяжении веков. При этом элементы находились в природном виде, т .е. в соединениях, которые не подвергались химической обработке, и все их свойства не были известны людям. В процессе изучения всех особенностей вещества у него появлялись новые направления использования. Свойства кремния на сегодняшний день не изучены до конца - этот элемент при достаточно широком и разнообразном спектре применения оставляет простор для новых открытий будущим поколениям ученых. Современные технологии значительно ускорят данный процесс. В XIX веке многие знаменитые химики пытались получить кремний в чистом виде. Впервые это удалось сделать Л. Тенару и Ж. Гей-Люссаку в 1811 году, но открытие элемента принадлежит Й. Берцелиусу, который смог не только выделить вещество, но и описать его. Химик из Швеции получил кремний в 1823 году, для этого он использовал металлический калий и калиевую соль. Реакция происходила при катализаторе в виде высокой температуры. Полученное простое вещество серо-бурого цвета являло собой аморфный кремний. Кристаллический чистый элемент был получен в 1855 году Сент-Клер Девилем. Сложность выделения напрямую связана с высокой прочностью атомных связей. В обоих случаях химическая реакция направлена на процесс очищения от примесей, при этом аморфная и кристаллическая модели имеют разные свойства [ Рохов Е.Д. 1990]. 1.3.ЭЛЕКТРОННОЕ СТРОЕНИЕ КРЕМНИЯ. НАХОЖДЕНИЕ В ПРИРОДЕЯдро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента. Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт свободной 3d-орбитали, проявляя степень окисления +4 [Суворов А.В., Никольский А.Б. 1995]. Кремний после кислорода – самый распространенный элемент на Земле. Он составляет 27,6% массы земной коры. В природе находится главным образом в виде оксида кремния (IV) SiO2 и солей кремниевых кислот – силикатов. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных. Многие природные силикаты в чистом виде являются драгоценными камнями, например, аквамарин, изумруд, топаз и др. Очень чистый кристаллический SiO2 известен в виде минералов горного хрусталя и кварца. Кварц распространен в виде песка и очень твердого минерала кремня (гидратированного оксида кремния (IV)). Оксид кремния (IV), окрашенный различными примесями, образует драгоценные и полудрагоценные камни – агат, аметист, яшму. В свободном виде кремний в природе не встречается [Реми Г. 1963]. 1.4. ФИЗИЧЕСКИЕ СВОЙСТВААморфный кремний представляет собой бурый порошок с температурой плавления 1420оC. Существует и другая аллотропная модификация кремния – кристаллический кремний. Это твердое вещество темно-серого цвета со слабым металлическим блеском, обладает тепло- и электропроводностью. Кристаллический кремний получают перекристаллизацией аморфного кремния. Аморфный кремний является более реакционноспособным, чем химически довольно инертный кристаллический кремний. Кристаллический кремний – полупроводник, его электропроводность возрастает при освещении и нагревании. Это обусловлено строением кристаллов. Структура кристаллического кремния аналогична структуре алмаза. В его кристалле каждый атом окружен тетраэдрически четырьмя другими и связан с ними ковалентной связью, хотя эта связь значительно слабее, чем между атомами углерода в алмазе. В кристалле кремния даже при обычных условиях ковалентные связи частично разрушаются, поэтому в нем имеются свободные электроны, которые обуславливают небольшую электропроводность. При освещении, нагревании, а также при наличии некоторых примесей увеличивается число разрушаемых связей, а значит, увеличивается число свободных электронов и возрастает электропроводность. Кремний очень хрупок, его плотность 2,33 г/см3. Как и уголь, относится к тугоплавким веществам. Кремний состоит из трех стабильных изотопов: 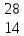 Si (92, 27%), Si (92, 27%), 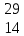 Si (4,68%) и Si (4,68%) и 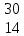 Si (3,05%)[ Спицын В.И., Мартыненко Л.И. 1991.]. Si (3,05%)[ Спицын В.И., Мартыненко Л.И. 1991.].1.5. ПРИМЕНЕНИЕ КРЕМНИЯКремний – ведущий полупроводниковый материал, легирующий компонент стали. Кремний используют в качестве полупроводника. Из него изготовляют так называемые солнечные батареи, превращающие световую энергию в электрическую (питание радиоустановок космических кораблей). Кремний используют в металлургии для получения кремнистых сталей, обладающих высокой жаростойкостью и кислотоупорностью. Оксид кремния (IV) используют для получения кремния, стекла, керамики, строительных материалов (цемента, бетона, силикатного кирпича); как наполнитель резин; монокристаллы используют в радиотехнике, оптическом приборостроении [ Аппен А. А. 1970]. Силикагель – эффективный адсорбент, носитель для катализаторов. Технический кремний находит следующие применения: сырьё для металлургических производств: компонент некоторых сплавов (бронзы, алюминиевых литейных сплавов силумины); раскислитель (при выплавке чугуна и сталей); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей уменьшает коэрцитивную силу готового ферромагнитного материала) и т. п.; сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния; сырьё для производства кремнийорганических материалов, силанов; иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях; для производства солнечных батарей; антиблок (антиадгезивная добавка) в промышленности пластмасс [Тейлор X. 1996]. 1.6. ХИМИЧЕСКИЕ СВОЙСТВАПо химическим свойствам кремний во многом схож с углеродом, что объясняется одинаковой структурой внешнего электронного слоя. При обычных условиях кремний довольно инертен, что обусловлено прочностью его кристаллической решетки. Непосредственно при комнатной температуре он взаимодействует только с фтором. При температуре 400-600оС кремний реагирует с хлором и бромом, а в кислороде измельченный кремний сгорает. С азотом и углеродом кремний реагирует при очень высоких температурах. Во всех указанных реакциях кремний играет роль восстановителя [ Угай Я.А. 2000.]. 1.6.1. ВЗАИМОДЕЙСТВИЕ КРЕМНИЯ С МЕТАЛЛАМИКремний хорошо растворим во многих расплавленных металлах, причем одних случаях (Zu, Al, Su, Pb, Au, Ag) с ними химически не взаимодействует, а в других (Mg, Ca, Си, Fe, Pt, Bi) образует соединения, например, Mg2Si, называемые силицидами. Силицид Li бурно реагирует с водой, выделяя смесь водорода, моно- и дикремневодородов. Расплавленные едкие щелочи активно взаимодействуют с силицидами, образуя силикаты. Разбавленные щелочи реагируют с силицидами медленнее, но силициды с большим содержанием кремния щелочами разлагаются довольно легко. При нагревании до 500-600°С силициды щелочных металлов (кроме силицида натрия), теряют часть металла, переходя в полисилициды — KSi6, CsSi8 с образованием сложных структурных группировок из атомов кремния [Белостоцкая И.С. 2008] Известны следующие методы получения силицидов: • сплавление Me + Si → MeSi; • спекание или горячее прессование 2МеН + Si → 2MeSi + Н2; • взаимодействие оксидов металлов с Si, SiC, SiO2, с силикатами в присутствии углерода (восстановление) 2МеО + 3Si → 2MeSi + SiO2 MeO + SiC → MeSi + CO MeO + SiO2 + 3C → MeSi + ЗСО MeO + (силикат + C) → MeSi + CO; • алюмо-или магнийтермический метод Me + AI(Mg) + SiO2 + S → MeSi+ шлак (шлак, содержащий А1, Mg,S); • осаждение из газовой фазы Me + SiCl4 + 2H2 → MeSi + 4HCI. [Карапетьянц М.Х., 2000]. 1.6.2. ГИДРИДЫ КРЕМНИЯ (СИЛАНЫ)Силан SiH4 — наиболее устойчивый первый представитель всего гомологического ряда; только при температуре красного каления он разлагается на кремний и водород. Дисилан Si2H6 разлагается при нагревании выше 300° на силан и твердый полимер; гексасилан Si6H4, являющийся наивысшим известным членом гомологического ряда, медленно разлагается уже при нормальной температуре. Основной схемой их получения является взаимодействие Mg2Si с соляной кислотой. SiH3Cl + H2 → SiH4 + НCl Важным свойством является легкость гидролиза связи Si-H в присутствии щелочных катализаторов. Гидролиз протекает весьма быстро, и этот процесс можно изобразить следующим образом: SiH4 + 2H2O→SiO2 + 4Н2 SiH4 + 2NaOH + H2O → Na2SiO3 + 4Н2 При каталитическом действии щелочи на высшие силаны происходит разрыв связи Si-Si H3Si-SiH3 + 6H2O→3SiO2 + 10Н2 Со свободными галоидами они реагируют аналогично углеводородам, последовательно обменивая на галоид один атом водорода за другим. SiH4 + НСl→Н2 + SiH3Cl [Воронков М. Г., Зелчан Г. И., Лукевиц Э. Я. 1978]. 1.6.3. ВЗАИМОДЕЙСТВИЕ КРЕМНИЯ С ГАЛОГЕНАМИВажной особенностью кремния являются его способность к реакции с галогенами. Галогенпроизводные кремния общей формулы SiГ4 могут быть получены прямым синтезом по схеме Si + 2Г2→SiГ4 При гидролизе галоидсиланов, содержащих водород, в нейтральном или кислом растворах образуются соединения с силоксановой связью 2SiH3Cl + H2O→H3Si-O-SiH3 + 2HCl Выход образующегося дисилоксана при 0°С достигает 55-60%.Аналогичном образом реагирует дихлорсилан, причем с повышением температуры реакции образуется полимер, называемый просилоксаном. nSiH2CI2 + nH2O→ (SiH2O)n + 2nHCl. При взаимодействии четырехфтористого кремния SiF4 с фтористоводородной кислотой HF образуется комплексная кремнефтористоводородная кислота 2HF + SiF4→H2[SiF6] [Некрасов Б.В. 1973]. 1.6.4. СЕРНИСТЫЕ СОЕДИНЕНИЯ КРЕМНИЯ, НИТРИД КРЕМНИЯ, КАРБИД КРЕМНИЯДвусернистый кремний (SiS2) образуется при сплавлении аморфного Si с избытком серы и после возгонки под уменьшенным давлением выделяется в виде белых игл (температура плавления 1090°С). Моносульфид кремния SiS получается из дисульфида при высокой температуре, он представляет собой вещество желтого цвета. Существует еще один способ получения односернистого кремния — взаимодействие кремния с парами CS2 при высоких температурах [Суворов А.В., Никольский А.Б. 1995]. Нитрид кремния - Si3N4 — образуется при взаимодействии кремния с азотом при температуре 1300°С, сопровождаемом значительным выделением тепла. 3Si + 2N2→Si3N4 В технике нитрид кремния получают нагреванием смеси кремнезема и угля в токе азота по реакции 3SiO2 + 6С + 2N2→Si3N4 + 6CO. Нитрид кремния — белый порошок, легко возгоняется при 1900°С. Одним из важнейших свойств нитрида кремния является его исключительно высокая химическая стойкость. До 1000°С Si3N4 устойчив к действию кислорода, водорода, водяного пара, многих расплавленных металлов. Нитрид кремния не реагирует с большинством минеральных кислот, но горячей концентрированной HF разлагается Si3N4 + 16HF→2(NH4)2SiF6 + SiF4. В расплавленных щелочах медленно растворяется Si3N4 + 12NaOH→3Na4SiO4 + 4NH3. Нитрид кремния используется в механизмах, которые должны противостоять высоким механическим силам, например, в лопатках турбины, которые похожи на большие цилиндры, где лопатки должны вращаться с высокой скоростью с прохождением воды или газов, производя энергию. Керамика из нитрида кремния используется для изготовления деталей, которые должны контактировать с расплавленными металлами. Они также служат для замены костей человека или животных В промышленных условиях углеродистый кремний(карбид кремния, карборунд) получают в электропечах при 2000— 2200°С нагреванием смеси кварца с коксом SiO2 + 3C→SiC + 2CO - 126 ккал/моль. Значительно меньше тепла требуется для получения карборунда при прямом синтезе из кремния и углерода. Карборунд химически стоек. К кислотам он полностью индиферентен, за исключением смеси концентрированных HF и HNO3. Расплавы щелочей и соды разлагают SiC с образованием силикатов SiC + Na2CO3 + O2→NaSiO3 + 2CO SiC + 2KOH + 2O2→K2SiO3 + CO2 + H2O. Карборунд легко реагирует с хлором, фтором. SiC + 2Cl2→SiCl4 + С (при 100°С) SiC+ 4Cl2→SiCl4 + ССl4 (при 1100-1200°С). Кислородом воздуха карборунд окисляется при температуре 800°С 2SiC + 3O2→2SiO2 + 2CO. При 1380°С SiC реагирует с водяным паром в нейтральной или слабоокислительной среде SiC + 4H2O→SiO2 + СO2 + 4Н2. Карборунд имеет алмазоподобную кристаллическую решетку, в которой каждый атом кремния окружен четырьмя атомами углерода, и наоборот. Ковалентные связи между атомами очень прочны. Поэтому по твердости карборунд близок к алмазу. В технике карборунд применяют для изготовления точильных камней и шлифовальных кругов. Расплавленные металлы Mg, Mn, Al, Co, Ni, Сr взаимодействуют с карбидом кремния, а такие, как Zn, Pb, Си с ним не реагируют [Некрасов Б.В. 1973]. 1.6.5. ДЕЙСТВИЕ НА КРЕМНИЙ ЩЕЛОЧЕЙ И КИСЛОТЩелочи с выделением водорода переводят его в соли кремневой кислоты: Si + 2KOH + H2O→K2SiO3 + 2H2. Кислоты на кремний при обычных условиях не действуют (за исключением смеси HF + HNO3 ). При высоких температурах газообразный фтористый водород реагирует с кремнием Si + 4HF→SiF4+2H2 [Белостоцкая И.С. 2008]. 1.6.6. СОЕДИНЕНИЯ КРЕМНИЯ С КИСЛОРОДОМДиоксид кремния SiO2 (кремнезем). Кристаллический SiO2 встречается в виде минерала кварца, который является составной частью песчаников и морского песка. Диоксид кремния представляет собой бесцветное твердое вещество, плавящееся лишь при 1713°С. Расплавленный SiO2 закипает при 2590°С. Хорошо образованные кристаллы кварца, часто с окрашивающими его примесями, представляют собой следующие минералы: горный хрусталь (белый, прозрачный), дымчатый кварц или раух-топаз (от серого до коричневого), розовый кварц, аметист (фиолетовый), цитрин (желтый) [Химический энциклопедический словарь. Под ред. Кнунянц И.Л. 1983]. Наиболее характерным и устойчивым соединением кремния является его двуокись (SiO2), образование которой из элементов идет с очень большим выделением тепла: Si + O2→SiO2 + 2O3 ккал Кроме непосредственного получения диоксида кремния из элементов кремния и кислорода, его можно получить прокаливанием геля ортокремневой кислоты H4SiO4-H2O(t)→H2SiO3-H2O(t)→SiO2 Щелочи постепенно переводят SiO2 в раствор, образуя соответствующие соли кремневой кислоты, называемые кремнекислыми или силикатами. SiO2 + 2NaOH→Na2SiO3 + H2O. Концентрированные растворы растворимых силикатов называют жидким стеклом. Обычное оконное стекло-силикат натрия и кальция-имеет состав Na2O-CaO-6SiO2. Его получают по реакции Na2CO3+CaCO3+6SiO2→Na2O*CaO*6SiO2*2CO2 Известно большое разнообразие силикатов (точнее, оксосиликатов). В строении оксосиликатов наблюдается определенная закономерность: все состоят из тетраэдров SiO4, которые через атом кислорода соединены друг с другом. Важнейшими природными силикатами являются, например, тальк (3MgO*H2O-4SiO2) и асбест (SmgO*H2O*SiO2). Как и для SiO2, для силикатов характерно стеклообразное (аморфное) состояние. При управляемой кристаллизации стекла можно получить мелкокристаллическое состояние (ситаллы). Ситаллы характеризуются повышенной прочностью [Лидин Р.А., Молочко В.А., Андреева Л.Л. 2000]. 1.7 БИОЛОГИЧЕСКАЯ РОЛЬ КРЕМНИЯБиологическая роль кремния в последние годы не подвергается сомнению. По содержанию в организме человека кремний относится к микроэлементам. Однако вдыхание мельчайших частиц пыли, содержащей диоксид кремния SiO2 (главный компонент песка) и другие соеднинения кремния, вызывают опасную болезнь – силикоз. Среднее поступление кремния с пищей и водой для жителей Европы составляет 20-50 мг/день. Биологическая роль кремния в организме человека до конца не выяснена, но считается, что он необходим для процессов минерализации костной ткани, синтеза коллагена, оказывает положительное действие на состояние кожи, волос и ногтей, способствует предупреждению атеросклероза и болезни Альцгеймера. Целый ряд работ посвящен биологическим эффектам кремния у животных и человека при поступлении с водой и пищей и обоснованию ПДК кремния в питьевой воде. Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных – животных. В больших количествах кремний концентрирует морские организмы – диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь – подсемейства Бамбуков и Рисовидных, в том числе – рис посевной. С пищей в организм человека ежедневно поступает до 1 г кремния. Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т.д. Микрочастицы SiO2, попавшие в легкие, кристаллизуются в них, а возникающие кристаллики разрушают легочную ткань и вызывают тяжелую болезнь – силикоз. Чтобы не допустить попадания в легкие опасной пыли, следует использовать для защиты органов дыхания респиратор [Коровин Н.В. 2000]. ГЛАВА 2. ПОЛУЧЕНИЕ КРЕМНИЯСпособы получения кремния чистотой > 99,0 масс % можно разделить на три основные группы: металлургический, электрохимический и химический. В первом случае кремний получают восстановлением расплава SiO2 углеродом в электродуговых печах при температурах 1500-1800оС. Процесс восстановления описывается уравнением: SiO2 + 2C→Si + 2CO. Получаемый технический кремний в соответствии с требованиями ГОСТ 2169 и ТУ 42-5-220 имеет марки: КРП, КРОО, КРО, КР1, КР3, КР2, в которых содержание кремния изменяется от 96,0 до 99,0% соответственно, а основными примесями являются Fe, Al, Ca. Выход достигает 80-85%. Сравнительно небольшое количество кремния получают электрохимическим методом, в частности электролизом в расплавах LiF, KF, SiF4 или Na2SiF6, K2SiF6. В качестве анода применяются кремнемедные сплавы, а катоды изготавливают из Si. Содержание примесей в кремнии не превышает 10-4 масс.%. К третьей группе относятся методы получения кремния, в которых технический кремний переводится в соединение (галогениды, силаны, и др.), позволяющее провести глубокую очистку, например, ректификацией, из которых затем получают высокочистый кремний [Реми Г. 1963]. Один из первых таких методов, нашедших сравнительно небольшое промышленное применение является йодидный метод, в основе которого лежит смещение равновесия реакции Si + 2I2→SiI4 вправо при изменении температур от 700 - 850оС (в низкотемпературной зоне реактора или отдельного реактора) и влево при температурах 1100 - 1200оС (в высокотемпературной зоне). В ряде технологических схем предусмотрена очистка SiI4 перед разложением. Природный оксид кремния (кварцит) SiO2 служит исходным продуктом для получения элементного кремния. Он может быть выделен восстановлением SiO2 при высокой температуре такими металлами, как Mg или Al. Реакция с Mg начинает идти уже при поджигании смеси тонкоизмельченных веществ по схеме SiO2+2Mg→2MgO +Si+89 ккал. Сейчас сотни тысяч тонн элементного кремния получают при восстановлении оксида Si углеродом в электродуговой печи при 3000°С: SiO2 + 2C→Si + 2CO. При восстановлении же SiO2 магнием получают аморфный кремний в виде бурого порошка. Перекристаллизовывая его из некоторых расплавленных металлов, например цинка, можно получить кремний в виде серых твердых, но довольно хрупких кристаллов. Кремний плавится при 1415°С и кипит при 2360°С. Имеются также публикации о получении в опытно-промышленном масштабе кремния термическим разложением трибромсилана. Однако перспектива метода на сегодня остается неясной. В настоящее время основными химико-технологическими системами (ХТС), применяемыми всеми ведущими производителями кремния в мире являются производства, использующие трихлорсилан (78-90% всего производства кремния) и моносилан (18-20%). Разработки технологий на основе моносилана начались в 70-х годах, когда повысился спрос на сверхчистый кремний для ИК-детекторов, и были реализованы после 1985 года [Суворов А.В., Никольский А.Б. 1995]. ЗаключениеПо выполненной работе можно сделать выводы: - Кремний – это один из наиболее распространенных элементов на нашей планете. Благодаря этому, он и его соединения получили широкое применение: изготовление полупроводниковых устройств, производство волокнистой оптики и устройств для глубокой очистки веществ, солнечных батарей. Кварцевый песок используют для изготовления стекольных изделий, строительных растворов, формовочной земли в металлургии. Горный хрусталь применяют при изготовлении ювелирных изделий. Кристаллы кварца используют в кварцевых резонаторах, в электронных часах. Кремнийорганические соединения используются в медицине в качестве протезов и различных наполнителей, при производстве эластичных материалов и изделий, в том числе и бытового назначения. - В промышленности для получения особо чистого кремния технический кремний переводят в летучие производные, которые легко очищаются перегонкой, ректификацией, глубоким охлаждением. Такими соединениями кремния являются тетрахлорид SiCl4, трихлорсилан SiHCl3 и моносилан SiH4. На втором этапе очищенные соединения кремния восстанавливают водородом или используют термический распад. - Путь от первого порошкообразного кремния до современного особо чистого монокристалла с ничтожной концентрацией дефектов – это революция в химии гомоатомных соединений кремния, стимулированная развитием техники. Список используемой литературы1.Гринвуд Н. Химия элементов: в 2 томах – М.: БИНОМ, 2008.c.310 2.Реми Г. Курс неорганической химии. – М., 1963. с.512,513-514 3.Рохов Е.Д. Мир кремния. – М.: Химия,1990. с.31 4.Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 2000.с.369-377 5.Химический энциклопедический словарь. Под ред. Кнунянц И.Л. – М.: Советская энциклопедия, 1983. с.283 6.Вернадский В. Биосфера. – Л., 1926. с. 13 7.Ферсман А. Химические элементы Земли и космоса. – Л., 1924. с.146 8.Вернадский В.И. Труды по геохимии. – М.: Наука, 1994.с.237 9.Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 2000. с.375,382-384 10.Спицын В.И., Мартыненко Л.И. Неорганическая химия. Часть I. – М.: МГУ, 1991. с.177,173 11.Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. – М.: Химия, 2000. с.110 12.Некрасов Б.В. Основы общей химии. – М.: Химия, 1973. с.583 13.Суворов А.В., Никольский А.Б. Общая химия. – С.-Петербург: Химия, 1995. с.385 14.Руководство к лабораторным работам по общей и неорганической химии. Под ред. проф. Ф.Я.Кульба. – Л.: Химия, 1976. с.200 15.Коровин Н.В. Общая химия. – М.: Высшая школа, 2000. с.401 16. Белостоцкая И.С. Химия кремния. 2008 c.65 17. Воронков М. Г., Зелчан Г. И., Лукевиц Э. Я. Кремний и жизнь. — Рига, 1978. 18. F.Clarke a. H.Washington. The composition of the Earth’s crust, W., 1924 (“U.S.Geol. Surv. Prof. Paper”, 127) 19. C.Payne. “Proc. Nat. Acad. Washington”, XI, p. 192, W., 1922. 20. Тейлор X. Химия цемента. — М.: Мир, 1996. 21. Аппен А. А. Химия стекла. — М.: Химия, 1970. |
