ХИМИЯ С-ВН141 металлы материал для изучения. Химия металлов
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
Тема: «Химия металлов» Технологическая карта комплекса Цели: Образовательные: сформировать представления о металлах как химических элементах и металлах как простых веществах. Познакомить учащихся со строением и общими свойствами металлов, исходя из положения их в ПСХЭ и строения атомов. Дать понятия о металлической связи и металлической кристаллической решетки, некоторые способы получения металлов. Обобщить знания учащихся о физических и химических свойствах металлов. Рассмотреть деление металлов на группы, изучить особенности свойств элементов первых трёх главных подгрупп (щелочных, щёлочноземельных и алюминий), а так же металлических d – элементов побочных подгрупп (на примере железа, марганца и хрома). Развивающие: совершенствовать умения учащихся обобщать, делать выводы, анализировать, сравнивать, устанавливать причинно-следственную зависимость между составом, строением и свойствами веществ. Воспитательные: создание условий для осознания необходимости грамотного отношения к своему здоровью и окружающей среде. Межпредметные связи. Биология. Тема: «Неорганические вещества в клетке». Химия в медицине. Тема: «Влияние тяжелых металлов на здоровье» Методы: словесный, наглядный, проблемно-поисковый, контроль знаний. Обеспечение занятия. Наглядные пособия: таблица «Периодическая таблица», «Вытеснительный ряд металлов», образцы металлов, модели кристаллических решёток Раздаточный материал: дидактические карточки, тестовые задания. Оборудование: учебник, компьютер, мультимедиапрезентации, видеоролики. Литератур основная: 1. О. Е. Саенко. Химия для колледжей: учебник .Ростов на Дону: Феникс, 2008
Литература дополнительная:
Студент должен знать: положение металлов в периодической системе, особенности строения их атомов; состав, свойства, получение и применение важнейших химических соединений металлов; общие и специфические свойства металлов главных подгрупп I — III групп; свойства представителей металлов побочных подгрупп периодической системы - железа, марганца и хрома; понятие о коррозии и способы защиты металлов от коррозии. Студент должен уметь: составлять электронные формулы атомов металлов малыx и больших периодов; определять свойства металла в зависимости от его положения в электрохимическом ряду напряжений; находить сходство и различие в свойствах металлов одной группы; объяснять явление амфотерности на примере оксидов и гидроксидов алюминия; применять понятия: кристаллические решетки металлов, электрохимический ряд напряжений металлов; выполнять химические опыты, подтверждающие свойства изученных металлов и их важнейших соединений. Распределение занятий по темам:
Содержание программы:Положение металлов в периодической системе и особенности электронного строения их атомов. Физические и химические свойства металлов. Оксиды и гидроксиды металлов. Химическая и электрохимическая коррозия металлов. Защита от коррозии. Общая характеристика металлов главных подгрупп I-III групп периодической системы химических элементов Д.И.Менделеева. Характеристика простых веществ и их соединений: натрий, кальций, алюминий. Природные соединения металлов 1-3 группы главных подгрупп и их применение. Металлы побочных подгрупп (хром, марганец, железо). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Их участие в окислительно-восстановительных реакциях. Важнейшие сплавы железа: чугун, сталь. Самостоятельная работа: Аудиторная форма работы:
Внеаудиторная форма работы:
Занятие №1 Тема: «Общие сведения о металлах» План лекции
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме0 – nе = Меn+. Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114). Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – Аt, даже те у которых на внешнем слое 4 электрона ( Je, Sn, Pb), 5 электронов ( Sb, Di), 6 электронов ( Po), так как они отличаются большим радиусом.  Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы. Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней. Закономерности в изменении свойств элементов – металлов.
У элементов – металлов побочных подгрупп свойства чуть-чуть другие. В побочных подгруппах (Cu, Ag, Au) – активность элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn, Cd, Hg. У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
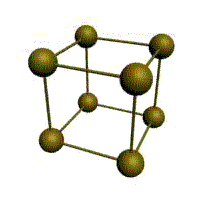
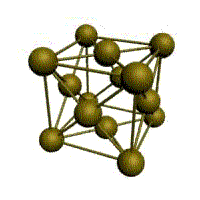
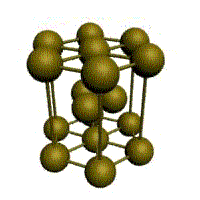
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью). Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью. Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Рис. Основные типы кристаллических решеток металлов Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки: - сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована; - валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален; - металлическая связь не обладает направляемостью и насыщенностью.
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами. а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло. б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³). в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие. г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает. д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg, теряют блеск и имеют черный или темно-серый цвет. е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью. Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность. А) Взаимодействие с неметаллами (в названиях полученных веществ окончание -иды) 2Mg0+O20—>2Mg2+O2- (оксид магния)Mg0-2e– —>Mg2+ 2 восстановитель 2O0+4e– —>2O2– 1 окислитель Fe0+S0—>Fe2+S2- (сульфид железа II) Fe0-2e– —>Fe2+ 1 восстановитель S0+2e– —>S2– 1 окислитель Б) Взаимодействие с водой Самые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород 2Na + 2HOH = 2NaOH + H20 2Li0+2H2+O2– —> 2Li+O2-H+ + H20 Li0-1e– —>Li+ 2 восстановитель 2H++2e– —>2H0 1 окислитель Li – восстановитель. Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2 В) Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий
2H+Cl– +Zn0 —>Zn2+Cl2- +H20 H++1e– —>H0 2 окислитель Zn0-2e– —>Zn2+ восстановитель Г) Взаимодействие с растворами солей. При этом соблюдаются следующие условия
Fe0+Cu2+Cl2– —>Fe2+Cl2– +Cu0 Fe0-2e– —>Fe2+ восстановитель Д) Взаимодействие со щелочами (только амфотерные) Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2 Магний и щелочноземельные металлы с щелочами не реагируют. Е) Взаимодействие с оксидами металлов (металлотермия). Некоторые активные металлы способны вытеснять другие металлы из их оксидов при поджигании смеси. 2Al0 + Fe2O3 = Al2O3 +2Fe0 |


 имические свойства металлов.
имические свойства металлов.