ХИМИЯ С-ВН141 металлы материал для изучения. Химия металлов
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
Ж) Коррозия (будет рассмотрена на другом занятии).
Существуют несколько основных способов получения — металлов. а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.). — из их оксидов углем или оксидом углерода (II) ZnО + С = Zn + СО Fе2О3 + ЗСО = 2Fе + ЗСО2 — водородом WO3 + 3H2 =W + 3H2O СоО + Н2 = Со + Н2О — алюминотермия 4Аl + ЗМnО2 = 2А12О3 + ЗМn б)Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например: CuO + H2SO4 = CuSO4 + H2O, CuSO4 + Zn = ZnSO4 + Cu. Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем): 2ZnS + ЗО2 = 2ZnО + 2SО2 ZnО + С = СО + Zn в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток. СuСl2 —> Сu2+ 2Сl- Катод (восстановление): Сu2+ - 2е- = Сu0 Анод (окисление): 2Cl- - 2е- = Сl°2 Закрепление знаний Контрольные вопросы 1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева? 2. Каковы особенности строения атомов металлов? 3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов? 4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп? 5. В каких формах могут находиться металлы в природе? 6. Как устроена кристаллическая решетка металлов? 7. Каковы физические свойства металлов? 8. Как можно получить металлы из их соединений? 9. Как ведут себя атомы металлов в химических реакциях и почему? 10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях? 11. Расскажите об электрохимическом ряде напряжений металлов. 12. Перечислите реакции, в которые могут вступать металлы. 13. Каково значение металлов в жизни человека? Задания и задачи 1. Написать уравнения реакций взаимодействия между веществами: а) Li, Na, Ca, Fe c O2, Cl2, S, N2, C: б) Na, Ca, Al c H2O; в) Zn c H2SO4; Al c HCl; г) Zn c CuSO4; Al c NaOH; Be c KOH. 2. Расставить коэффициенты, найти окислитель и восстановитель в уравнениях реакций: Cu + HNO3 (P) —> Cu (NO3)2 + NO + H2O Cu + HNO3 (K) —> Cu (NO3)2 + NO2 + H2O Na + HNO3 —> NaNO3 + N2O + H2O 3.Задача: Смесь порошков железа и меди массой 10 г обработали раствором НСl, при этом выделился газ объёмом 2,24 л. Определите массовую долю металлов в смеси. 4. Задача:К раствору содержащему 27 г CuCl2 добавили 14 г железных опилок. Найти массу меди которая выделилась в результате реакции. Решение: 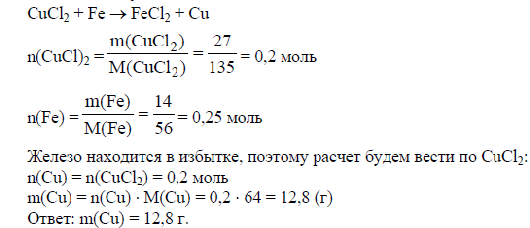 5.Задача: Какую массу сульфата цинка можно получить при взаимодействии избытка цинка с 500 мл 20% раствора серной кислоты, плотностью 1,14 г/мл? Решение:  Химический диктант Один студент работает у доски (но до момента проверки его ответы не видны), остальные обучающиеся группы выполняют работу в тетрадях. Варианты вопросов: 1. Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность); 2. Тип химической связи в металлах? (металлическая); 3. Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (электроны); 4. Какую плотность имеют легкие металлы (менее 5 г/см3); 5. Самый легкий металл? (литий); 6. Лучшие проводники электричества среди металлов? (серебро и медь); 7. Название известного сплава на основе алюминия (дюралюминий); 8. Важнейшие сплавы на основе железа? (чугун и сталь); 9.Какой неметалл входит в состав сплавов железа (углерод); 10. Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден) Тест по теме «Общая характеристика металлов. Электрохимический ряд напряжений» Выбери один или несколько правильных ответов 1. Какая из следующих групп химических элементов содержит только металлы? а) Cs, Be, B; б) K, Ca, Sr; в) H, Li, Na; г) Bi, W, Po. 2. Какое физическое свойство не является общим для всех металлов? а) электропроводность; б) теплопроводность; в) твердое агрегатное состояние при стандартных условиях; г) металлический блеск. 3. Натрий и калий можно хранить под слоем керосина, а литий – только под слоем вазелинового масла, т.к.: а) литий реагирует с керосином; б) в ряду напряжений литий находится левее натрия и калия; в) литий более активен, чем калий и натрий; г) плотность лития меньше плотности керосина. 4. При электролизе водного раствора хлорида натрия на катоде выделяется: а) натрий; б) хлор; в) водород; г) кислород. 5. Сильнее восстановительные свойства выражены у : а) Ca; б) Mg; в) Si; г) O. 6. Масса карбида кальция, в которой содержится 5,418•1024 атомов всех образующих это соединение элементов, составляет (в г): а) 19,2; б) 192; в) 57,6; г) 576. 7. Какие из перечисленных веществ реагируют с водой с образованием раствора сильного электролита, в котором лакмус приобретает синюю окраску? а) Na; б) SO3; в) KH; г) Mg. 8. Какое из соединений кальция входит в состав земной коры? а) Оксид; б) нитрид; в) карбид; г) карбонат. 9. Какой объем (л) газа (н.у.) выделится при взаимодействии 6,48 г серебра с избытком разбавленной азотной кислоты? а) 4,032; б)1,344; в) 0,448; г) 22,4. 10. Какой металл нельзя получить электролизом водного раствора его соли? а) Цинк; б) калий; в) медь; г) литий. Ключ к тесту
Это интересно! Человек использовал металлы с древних времен. 1.В начале был век медный. К концу каменного века человек открыл возможность использования металлов для изготовления орудий труда. Первым таким металлом был медь. Период распространения медных орудий называют энеолитом или халколитом, что в переводе с греческого означает «медь». Медь обрабатывалась с помощью каменных орудий методом холодной ковки. Самородки меди превращались в изделия под тяжёлыми ударами молота. В начале медного века из меди делали лишь мягкие орудия, украшения, предметы домашней утвари. Именно с открытием меди и других металлов стала зарождаться профессия кузнеца. Позже появились литья, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую. II. Далее идёт век бронзовый. Бронза - сплав меди и олова. Хронологические границы бронзового века датируются в начале 3-го тысячелетия до н. э. до начала 1-го тысячелетия до н.э. Большими преимуществами бронзы в сравнений с медью и другими известными металлами являются более низкая анализы показали, что в составе железных метеоритов на долю железа приходится 91% . Начало производства железа из его руд в Древнем Египте, потом в Индии и в других странах. Температура плавления ( 700° - 900° ) и высокие литейные качества и большая прочность. III. Далее идет железный век. Третий и последний период первобытной эпохи характеризуется распространением железной металлургии и железных орудий и знаменует собой железный век. В современном значении этот термин был введен в употребление в середине IX века датским археологом К.Ю. Томсоном и вскоре распространился в литературе наряду с терминами « каменный век» и « бронзовый век». В отличие от других металлов железо, кроме метеоритного не встречается в чистом виде. Ученые предполагают, что первое железо, попавшее в руки человека, было метеоритного происхождения, и не зря железо именуется «небесным камнем». Самый крупный метеорит нашли в Африке, он весил около шестидесяти тонн. А во льдах Гренландии нашли железный метеорит весом тридцать три тонны. В настоящее время продолжается железный век. Ведь в настоящее время железные сплавы составляют почти 90% всего количества металлов и металлических сплавов. Карточки задания для индивидуальной работы
Занятие №2 |
