ХИМИЯ С-ВН141 металлы материал для изучения. Химия металлов
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
Упражнения и задачи для закрепления и проверки знаний
Дано: m0(Mg) = 40 г, m(р-ра ZnSO4) = 596 г, Найти: Решение: ZnSO4 + Mg = MgSO4 + Zn. Изменение массы порошка в смеси: Пусть Отсюда х = 0,39 моль. Массовая доля сульфата магния в конечном растворе: Ответ.
  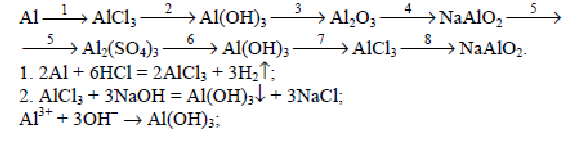 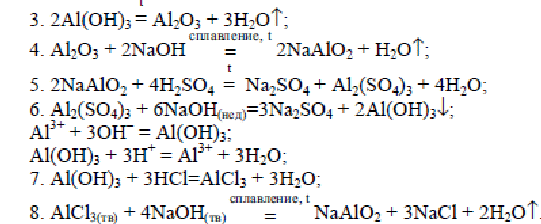
Занятие №3 Металлы побочных подгрупп (переходные металлы). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Важнейшие сплавы железа: чугун, сталь. Общий обзор металлических элементов побочных подгрупп.
Более устойчивыми являются состояния d0, d5, d10. Например, у хрома и меди происходит «провал» электрона с наружного слоя на d – подуровень.
Например, марганец образует оксиды, в которых степень окисления : +2 МnO, +4 MnO2, +6 MnO3, +7 Mn2O7. ! При этом важно запомнить правило: с увеличением степени окисления атомов металлов побочных подгрупп основные свойства их оксидов и гидроксидов уменьшаются, а кислотные усиливаются. Железо.  В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы. В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.Порядковый номер - 26, электронная формула 1s2 2s2 2p6 3d6 4s2. Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (3d6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6. Железо является вторым по распространенности металлом в природе (после алюминия). Наиболее важные природные соединения: Fe2O3x3H2O - бурый железняк;Fe2O3 - красный железняк;Fe3O4(FeO Fe2O3) - магнитный железняк;FeS2 - железный колчедан (пирит). Соединения железа входят в состав живых организмов. Железо - серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа - 7,87 г/см3, температура плавления 1539С. Получение железа В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах. Химизм доменного процесса следующий: C + O2 = CO2, CO2 + C = 2CO. 3Fe2O3 + CO = 2Fe3O4 + CO2, Fe3O4 + CO = 3FeO + CO2, FeO + CO = Fe + CO2. В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними: 2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III) 3Fe + 2O2 = Fe3O4(FeO x Fe2O3) Оксид железа (II,III) Fe + S = FeS Сульфид железа (II) При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором: 3Fe + C = Fe3C Карбид железа (цементит) 3Fe + Si = Fe3Si Силицид железа 3Fe + 2P = Fe3P2 Фосфид железа (II) Во влажном воздухе железо быстро окисляется (коррозирует): 4Fe + 3O2 + 6H2O = 4Fe(OH)3, Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой: 3Fe + 4H2O = Fe3O4 + 4H2 Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород: Fe + 2HCl = FeCl2 + H2 Fe + H2SO4 = FeSO4 + H2 При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею. При нагревании концентрированная H2SO4 окисляет железо до сульфита железа (III): 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O. Разбавленная азотная кислота окисляет железо до нитрата железа (III): Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O. Концентрированная азотная кислота пассивирует железо. Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений: Fe + CuSO4 = FeSO4 + Cu Оксид железа (II) FeO - основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II): FeO + 2HCl = FeCl2 + H2O FeO + 2H+ = Fe2+ + H2O Гидроксид железа (II) Fe(OH)2 - порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами: FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4, Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами: Fe(OH)2 + 2HCl = FeCl2 + 2H2O, Fe(OH)2 + 2H+ = Fe2+ + 2H2O. При нагревании гидроксид железа (II) разлагается: Fe(OH)2 = FeO + H2O. Соединения со степенью окисления железа +2 проявляют восстановительные свойства, так как Fe2+ легко окисляются до Fe+3: Fe+2 - 1e = Fe+3 Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску - буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Оксид железа (III) Fe2O3 - порошок бурого цвета, не растворяется в воде. Оксид железа (III) получают разложением гидроксида железа (III): 2Fe(OH)3 = Fe2O3 + 3H2O Оксид железа (III) проявляет амфотерные свойства: взаимодействует с кислотами и твердыми щелочами NaOH и KOH , а также с карбонатами натрия и калия при высокой температуре: Fe2O3 + 2NaOH = 2NaFeO2 + H2O, Fe2O3 + 2OH- = 2FeO2- + H2O, Fe2O3 + Na2CO3 = 2NaFeO2 + CO2. Феррит натрия Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами: FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl, Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3 легко образует соответствующие соли: Fe(OH)3 + 3HCl = FeCl3 + H2O 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании.: Fe(ОН)3 + КОН = К[Fe(ОН)4] Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2: Fe+3 + 1e = Fe+2. Так, например, хлорид железа (III) окисляет йодид калия до свободного йода: 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I20 Хром.  Хром находится в побочной подгруппе VI группы Периодической системы. Строение электронной оболочки хрома: Cr 3d54s1. Степени окисления от +1 до +6, но наиболее устойчивые +2, +3, +6. Хром находится в побочной подгруппе VI группы Периодической системы. Строение электронной оболочки хрома: Cr 3d54s1. Степени окисления от +1 до +6, но наиболее устойчивые +2, +3, +6.Массовая доля хрома в земной коре составляет 0,02%. Важнейшими минералами, входящими в состав хромовых руд, являются хромит, или хромистый железняк, и его разновидности, в которых железо частично заменено на магний, а хром - на алюминий. Хром - серебристо серый металл. Чистый хром достаточно пластичный, а технический самый твердый из всех металлов. Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором: t° 4Cr + 3O2 = 2Cr2O3 t° 2Cr + 3Cl2 = 2CrCl3 t° 2Cr + N2 = 2CrN t° 2Cr + 3S = Cr2S3 В азотной и концентрированной серной кислотах он пассивирует, покрываясь защитной оксидной пленкой. В хлороводородной и разбавленной серной кислотах растворяется, при этом, если кислота полностью освобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекает на воздухе - соли хрома (III): Cr + 2HCl = CrCl2 + H2 ; 2Cr + 6HCl + O2 = 2CrCl3 + 2H2O + H2  МАРГАНЕЦ  Mn, химический элемент с атомным номером 25, атомная масса 54,9. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 до +7, наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0. Mn, химический элемент с атомным номером 25, атомная масса 54,9. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 до +7, наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0. Марганец в компактном виде — твердый серебристо-белый, хрупкий металл. Химические свойства Марганец – активный металл.
При взаимодействии металлического марганца с различными неметаллами образуются соединения марганца (II): Мn + С2 = МnСl2 (хлорид марганца (II)); Mn + S = МnS (cулъфид марганца (II)); 3Мn + 2 Р = Мn3Р2 (фосфид марганца (II)); 3Mn + N2 = Мn3N2 (нитрид марганца (II)); 2Mn + N2 = Мn2Si (силицид марганца (II)).
При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью: Mn + 2H2O = MnO2 + 2H2
В электрохимическом ряду напряжений металлов марганец находится до водорода, он вытесняет водород из растворов неокисляющих кислот, при этом образуются соли марганца (II): Mn + 2HCl = MnCl2 + H2; Mn + H2SO4 = MnSO4 + H2; с разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II): 3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O. Концентрированная азотная и серная кислоты пассивируют марганец. Марганец растворяется в них лишь при нагревании, образуются соли марганца (II) и продукты восстановления кислоты: Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O; Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
Марганец – активный металл, способен вытеснять металлы из их оксидов: 5Mn + Nb2O5 = 5MnO + 2Nb. 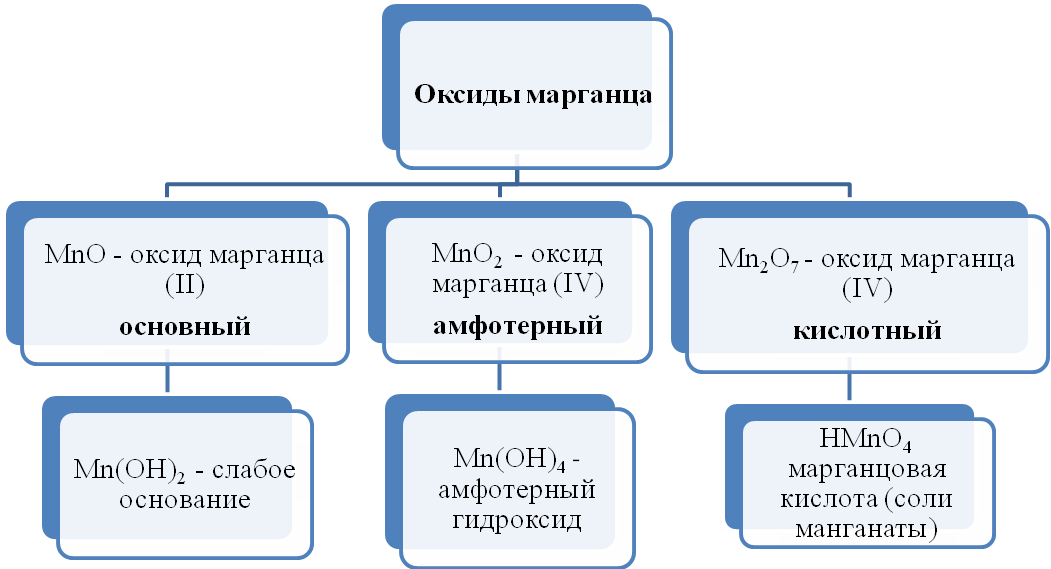 Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами: 2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O. Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4). Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще) 2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH, так и восстановителей 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl. Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата: 2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4. Применение: более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10. Понятие о сплавах. Характерной особенностью металлов является их способность образовывать друг с другом или с неметаллами сплавы. Чтобы получить сплав, смесь металлов обычно подвергают плавлению, а затем охлаждают с различной скоростью, которая определяется природой компонентов и изменением характера их взаимодействия в зависимости от температуры. Иногда сплавы получают спеканием тонких порошков металлов, не прибегая к плавлению (порошковая металлургия). Итак сплавы - это продукты химического взаимодействия металлов. Кристаллическая структура сплавов во многом подобна чистым металлам, которые, взаимодействуя друг с другом при плавлении и последующей кристаллизации, образуют: а) химические соединения, называемые интерметаллидами; б) твердые растворы; в) механическую смесь кристаллов компонентов. Современная техника использует огромное число сплавов, причем в подавляющем большинстве случаев они состоят не из двух, а из трех, четырех и большего числа металлов. Интересно, что свойства сплавов часто резко отличаются от свойств индивидуальных металлов, которыми они образованы. Так, сплав, содержащий 50% висмута, 25% свинца, 12,5% олова и 12,5% кадмия, плавится всего при 60,5 градусах Цельсия, в то время как компоненты сплава имеют соответственно температуры плавления 271, 327, 232 и 321 градус Цельсия. Твердость оловянной бронзы (90% меди и 10% олова) втрое больше, чем у чистой меди, а коэффициент линейного расширения сплавов железа и никеля в 10 раз меньше, чем у чистых компонентов. Однако некоторые примеси ухудшают качество металлов и сплавов. Известно, например, что чугун (сплав железа и углерода) не обладает той прочностью и твердостью, которые характерны для стали. Помимо углерода, на свойства стали влияют добавки серы и фосфора, увеличивающие ее хрупкость. Среди свойств сплавов наиболее важными для практического применения являются жаропрочность, коррозионная стойкость, механическая прочность и др. Для авиации большое значение имеют легкие сплавы на основе магния, титана или алюминия, для металлообрабатывающей промышленности - специальные сплавы, содержащие вольфрам, кобальт, никель. В электронной технике применяют сплавы, основным компонентом которых является медь. Сверхмощные магниты удалось получить, используя продукты взаимодействия кобальта, самария и других редкоземельных элементов, а сверхпроводящие при низких температурах сплавы - на основе интерметаллидов, образуемых ниобием с оловом и др. Задания для закрепления и проверки знаний Контрольные вопросы:
(III)?
увеличением степени его окисления?
Решение задач Задачи первого уровня сложности (оцениваются в 3 балла)
Задачи второго уровня сложности (оцениваются в 4 балла)
Задачи третьего уровня сложности (оцениваются в 5 баллов)
Напишите уравнения реакций, соответствующие цепочкам превращения:   Запишите уравнения практически осуществимых реакций. Если реакция не протекает , укажите причину. Из букв, соответствующих правильным ответам, вы составите название планеты, с которой в древности соотносили железо. а) Mg + НС1 →M б) Zn+ H3P04→ Е в) А1+H2S04(pa36) → А г)Ag + НС1 → Л д)Fe + НС1 → Р е) Pb+ H2S04(pa36) → К ж)Al + НС1 → С Составьте уравнения практически осуществимых реакций между веществами: а) А1+Hg(N03)2(p.p) →…. б) Zn + MgCl2(p.p→) в) Fe+ ZnCl2(p.p) → г)Zn+ Pb(N03)2(p.p) →…. Выберите химический элемент-металл из списка: натрий, литий, магний, калий, кальций, алюминий. Дайте его характеристику, вписав в текст пропущенные слова, цифры, знаки. ХАРАКТЕРИСТИКА ЭЛЕМЕНТА-МЕТАЛЛА НА ПРИМЕРЕ
… (порядковый номер… ) — это элемент периода,……подгруппы……группы Периодической системы.
Число протонов в атоме………равно……, число электронов —......, число нейтронов в изотопе —……, заряд ядра , электронная формул……, электронно-графическая формула внешнего слоя…………………………….. Атомы проявляют свойства.
………образует высший оксид, формула которого………. По свойствам это…………………
………образует высший гидроксид, формула которого………. По свойствам это…………. Карточки задания по теме «Металлы»
Ответы во всех вариантах под номерами 1, 4, 5, 7.
Тест по теме «Металлы» Вариант 1
А) 1s2 2s2 2p6 3s2 3p6 4s2 Б) 1s2 2s2 2p6 3s1 В) 1s2 2s2 2p6 3s2 3p6 3d5 4s1 Г) 1s2 2s1 2. Определите в каких парах обе реакции практически осуществимы: А) Cu + Zn2+ → ; Fe3+ + K→ Б) Mg + Cu2+ → ; Cr + H+ → В) Ca2+ + Zn → ; Al3+ + Na → Г) Ca + H+ → ; Pb2+ + Cu → 3. В какой из групп все металлы растворяются в кислотах: А) Al, Fe, Cu Б) Ag, K, Ba В) Ca, Zn, Fe Г) Au, Mg, Na 4. В 4 пробирки налиты растворы солей. В каждой из них – кусочек цинка. В какой из пробирок будет идти реакция с раствором: А) CaCl2 Б) CuSO4 В) Mg(NO3)2 Г) FeCl3 Вариант 2
А) 1s2 2s2 2p6 3s1 Б) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 В) 1s2 2s2 2p6 3s2 3p6 4s1 Г) 1s2 2s1 2. Проанализируйте, в каких группах все три металла могут вытеснять медь из раствора хлорида меди. Выберите правильный ответ: А) Al, Zn, Na Б) Fe, Hg, Sr В) Zn, Fe, Ca Г) Ag, Pb, Zn 3. Какие реакции практически осуществимы: А) Cu + HCl → Б) Cu + AgCl → В) Ca + H2O → Г) Zn + Pb(NO3)2 → 4. Какое из свойств наиболее характерно для всех металлов: А) твердость Б) восстановительная активность В) взаимодействие с водой Г) сильные окислительные свойства Тест по теме «Металлы» Вариант 3
А) 1s2 2s2 2p6 3s2 3p6 3d5 4s1 Б) 1s2 2s2 2p6 3s2 3p6 4s2 В) 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Г) 1s2 2s2 2p6 3s2 3p6 4s1 2. Укажите, в каких случаях железо и его соединения являются окислителями: А) Fe0 → Fe2+ Б) Fe3+ → Fe2+ В) Fe2+ → Fe0 Г) Fe2+ → Fe3+ 3. Определите, какие группы реакций показывают процессы, при которых медную пластинку можно превратить в черный порошок, а затем в голубой раствор: А) Cu + H2O → ; CuCl2 + NaOH → Б) Cu + O2 → ; CuO + HCl → В) Cu + Cl2 → ; Cu + HgCl2 → Г) Cu + O2 → ; CuO + H2O → 4. Чем объяснить, что металлы хорошо проводят электрический ток: А) электропроводность металлов обусловлена свободным перемещением валентных электронов в кристаллической решетке Б) не все металлы проводят электрический ток В) металлы хорошо проводят электрический ток благодаря наличию s- электронов Г) электропроводность металлов обусловлена низкой энергией отрыва валентных электронов Вариант 4
А) 1s2 2s2 2p6 3s2 Б) 1s2 2s2 2p6 3s2 3p6 3d1 4s1 В) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 Г) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d2 5s2 2. Определите в каких группах обе реакции практически осуществимы: А) Cu + Hg2+ → ; H+ + K→ Б) Mg + Pb2+ → ; Al + H+ → В) Ca2+ + Zn → ; Fe2+ + Cu → Г) Na + Cu2+ → ; Na+ + Fe → 3. В какой из групп все металлы растворяются в кислотах: А) Mg, Al, Cu Б) Au, K, Fe В) Zn, Ca, Cr Г) Ag, Sn, Pb 4. В какой группе ПСХЭ находятся самые активные металлы: А) седьмой группе, побочной подгруппе Б) первой группе, главной подгруппе В) второй группе, побочной подгруппе Г) пятой группе, главной подгруппе Тест Вариант 1 |