Хранение энергии. Обзор. Хранение энергии 28.06.22. Хранение энергии в контексте энергетического перехода обзор технологий Аннотация
 Скачать 4.08 Mb. Скачать 4.08 Mb.
|
2.2.2. Электрохимические технологии накопления энергииЭта классификация хранения объединяет различные типы вторичных или перезаряжаемых батарей. Каждая ячейка батареи состоит из трех основных элементов: отрицательного электрода, положительного электрода и электролита. Два электрода соединены материалами, имеющими разные электрохимические потенциалы, которые спонтанно вызывают окислительно-восстановительную реакцию, генерирующую внешний электрический ток, когда цепь замыкается для цикла разряда. Поскольку эти электрохимические реакции обратимы, вторичные батареи можно заряжать, прикладывая к электродам внешнее напряжение [40]. Электричество входит и выходит из батарей из-за этих химических реакций, что дает им быстрое, почти мгновенное время отклика, которое обычно менее секунды, вплоть до миллисекунд [18]. При оценке срока службы батарей следует учитывать три важных фактора: глубину разряда (DOD), скорость разрядки и зарядки, а также рабочую температуру окружающей среды. DOD показывает, сколько энергии, сохраненной в устройстве, было использовано, например, 0% DOD означает, что батарея полностью заряжена, а 100% DOD означает, что батарея разряжена. Как правило, высокая цикличность DOD приводит к сокращению срока службы. Обычный метод обозначения скоростей разряда и заряда называется «C- rate» и выражается как I = M x 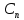 , где I — ток разрядки (или зарядки) в амперах (А); C - числовое значение номинальной емкости аккумулятора в ампер-часах (Ач); n — время в часах, для которого указана номинальная емкость, а M — число, кратное или дробное по отношению к C. Например, скорость разряда 0,2C или C/5 для батареи с номинальной емкостью 5 А·ч составляет 1 A. , где I — ток разрядки (или зарядки) в амперах (А); C - числовое значение номинальной емкости аккумулятора в ампер-часах (Ач); n — время в часах, для которого указана номинальная емкость, а M — число, кратное или дробное по отношению к C. Например, скорость разряда 0,2C или C/5 для батареи с номинальной емкостью 5 А·ч составляет 1 A. Обычно срок службы батареи будет уменьшаться всякий раз, когда она разряжается (или заряжается) со скоростью, превышающей номинальную скорость (более высокий ток разрядки/зарядки). Наконец, производители обычно сообщают о сроке службы батареи при рабочих температурах окружающей среды около 20–25 °C, и, как правило, при повышении рабочей температуры окружающей среды срок службы батареи сокращается [96–99]. Существует несколько основных типов конструкции батарей, например, призматические с решетчатыми или трубчатыми пластинами и цилиндрические со спиральными или дисковыми пластинами. Также существует множество подходящих материалов, применяемых в различных технологиях аккумуляторных батарей, характеристики которых основаны на их химических свойствах [100]. 2.2.2.1. Обычные батареи 2.2.2.1.1. Свинцово-кислотные батареи Свинцово-кислотные аккумуляторы используются уже более 150 лет, это развитая технология, широко применяемая в автомобильной промышленности и во многих устройствах хранения, например, UPS (Uninterrupted Power Supply) (ИБП (источник бесперебойного питания)) для телекоммуникационных систем и изолированных фотоэлектрических систем. [44]. Электроды из металлического свинца и оксида свинца в растворе серной кислоты составляют свинцово-кислотную батарею. В цикле разряда и свинец, и оксид свинца превращаются в сульфат свинца, и концентрация серной кислоты в электролите уменьшается, в то время как при заряде металлический свинец осаждается на отрицательном электроде, а оксид свинца на положительном электроде, увеличивая концентрацию серной кислоты в электролите [40]. Свинцово-кислотные аккумуляторы обладают такими положительными характеристиками, как низкая стоимость и умеренный КПД (70–80%), при этом некоторые усовершенствованные конструкции достигают более высокого КПД (80–90%) [40,44]. Однако у них есть недостатки, такие как низкий срок службы (400–1000 циклов при 80% глубине разряда), который можно резко сократить при более глубокой глубине разряда, низкая удельная энергия (30–50 Вт·ч/кг), потребность в регулярном техническом обслуживании, также есть опасность экологических проблем из-за токсичности свинца [40,43,44,99]. Также необходим контроль температуры хранения. Наравне с традиционными свинцово-кислотными батареями были разработаны некоторые технологические вариации для снижения требований к техническому обслуживанию и увеличения срока службы (1500+ циклов при 80% DOD), например, VRLA (свинцово-кислотные батареи с клапанным регулированием), которые имеют две категории, указывающие на разные способы удерживания электролита: гель и абсорбированный стекломат (AGM). В гелевые аккумуляторы добавляют загуститель, превращающий жидкость в гель. В ячейках AGM для удержания жидкости используется стеклянная матрица. [41,74,99,101,102]. 2.2.2.1.2. Никель-кадмиевые (Ni-Cd) и никель-металлогидридные (NiMH) батареи Никель-кадмиевые батареи — еще одна развитая технология, широко используемая в бытовой технике [42]. Гидроксид никеля в качестве положительного электрода и гидроксид кадмия в качестве отрицательного электрода в щелочном электролите составляют Ni-Cd аккумулятор [40]. При зарядке гидроксид никеля превращается в оксигидроксид никеля на отрицательном электроде, а на положительном электроде гидроксид кадмия превращается в металлический кадмий, причем обе реакции меняются на противоположные во время цикла разряда. Ni-Cd аккумуляторы имеют более длительный срок службы (1000–1500 циклов при глубине разряда 80%) и более высокую удельную энергию (55–75 Вт·ч/кг), чем свинцово-кислотные аккумуляторы. Однако они также имеют недостатки. Они токсичны, это проблема связана с использованием кадмия, также у них проявляется эффект памяти – явление, когда батарея начинает терять свою емкость из-за циклов зарядки, выполненных до полной разрядки батареи [40,41,44,99]. Никель-металлогидридные батареи представляют собой разновидность никель-кадмиевых аккумуляторов, которые разрабатывались с целью улучшения их характеристик и при этом были бы более безопасными для окружающей среды, поскольку из электродов удаляется кадмий [43]. Металлический сплав, связанный водородом, составляет металлогидридный электрод, и реакции процесса зарядки и разрядки в основном одинаковы, схематическая структура обоих электродов и электролита показана на рис. 6. Еще одним преимуществом Ni-MH аккумуляторов является повышенная плотность энергии (более 80 Вт·ч/кг). Однако они имеют два недостатка с точки зрения долговечности - сокращенный жизненный цикл (800–1200 циклов при 80% глубине разряда) и более высокую скорость саморазряда (0,4–1,2%/день) по сравнению с Ni-Cd, особенно потому, что растворенный водород вступает в реакцию с положительным электродом [74,99,100].  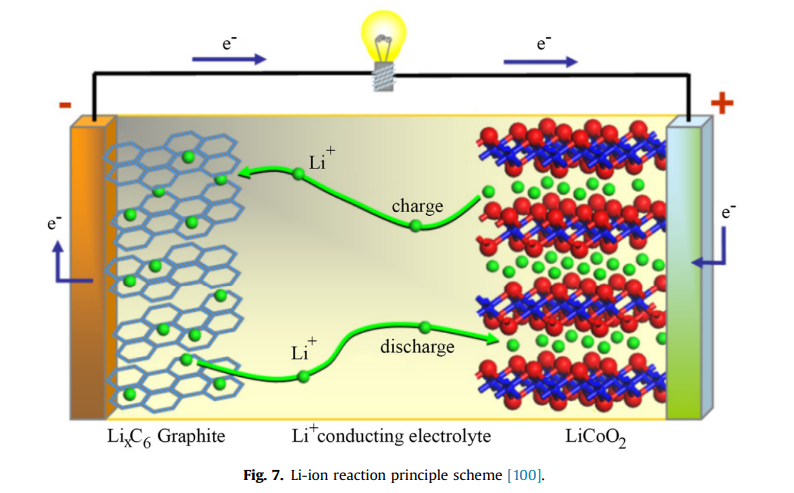 2.2.2.1.3. Литий-ионный аккумулятор (Li-ion). Создание литий-ионных аккумуляторов является важным шагом в развитии аккумуляторов; они имеют лучшее сочетание удельной энергии и срока службы. Исследовательские проекты начались в 1960–70 годы и привели к выпуску на рынок фирмой Sony первых литий-ионных аккумуляторов в 1991 году [40]. Двадцать лет спустя, производство таких аккумуляторов достигает 2 миллиардов штук в год [74]. Литий-ионные аккумуляторы работают по несколько другому принципу, называемому принципом интеркаляции, при котором обратимое внедрение атома-гостя в твердую структуру хозяина, не вызывая серьезного нарушения этой структуры. В литий-ионных батареях ионы лития переносятся между двумя электродами от одного деинтеркалированного электрода к другому, который реинтеркалируется, как в схеме, представленной на рис. 7. Существует несколько возможных материалов для положительного электрода. Их можно разделить на три категории: халькогениды металлов, переходные оксиды металлов и полианионные соединения. Эти материалы также могут классифицировать в зависимости от их кристаллической структуры; например, слоистые, шпинель и оливин [104]. Исследования по использованию халькогенидов металлов в качестве положительного электрода восходят к 1970-м годам в Стэнфордском университете, где использовался тантал дисульфид (TaS2). Эти исследования продолжались в фирме Exxon, в результате чего появились аккумуляторы с дисульфидом лития-титана (LTS), LiTiS2 в качестве основной структуры. Сначала использовался чистый литий в качестве отрицательного электрода, но рост дендритов металлического лития во время циклирования сокращал срок службы батареи и, потенциально приводя к опасности взрыва, поднимал вопросы безопасности. Для повышения безопасности электрод из чистого лития был заменен на литий-алюминиевый электрод [105,106]. В 1980-х годах исследования материалов положительных электродов были сосредоточены на оксидах переходных металлов, имеющих такую же слоистую кристаллическую структуру, как LTS. Первым слоистым оксидом переходного металла для положительного электрода был использован оксид лития-кобальта (LCO), LiCoO2, который обладает хорошей удельной емкостью, низким саморазрядом и хорошим сроком службы. Некоторыми недостатками LCO являются повышенные затраты и проблемы токсичности кобальта, также проблемы безопасности при высокой температуре. И срок службы сокращается при высоких скоростях разряда или во время глубокой перезарядки. Другим исследованным материалом положительного электрода был оксид лития-никеля (LNO), LiNiO2, который имеет аналогичную структуру и рабочие характеристики по сравнению с LCO, но этот материал не был получен в чистом виде в качестве положительного электрода в связи с его нестабильностью. Однако эти исследования имели важное значение для разработки менее дорогих положительных электродов [104,106,107]. Исследовательские усилия были сосредоточены на разработке положительных электродных материалов с хорошими характеристиками, как LCO, но менее дорогими, что привело к созданию других положительные электроды из оксидов переходного металла. Путем частичной замены кобальта на менее дорогие материалы, такие как никель и марганец, был разработан материал положительнго электрода литий-никель-марганец-кобальт (NMC), LiNi1-х-yMnxCoyO2. Еще один результат частичной замены никеля с кобальтом, для снижения затрат, связан с добавлением небольшого количества алюминия для улучшения термической стабильности. При этом получен литий никель-кобальт-алюминиевый (NCA) электрод, LiNi0,8Co0,15Al0,05O2. По сравнению с LCO, NMC имеет аналогичную или несколько более высокую удельную емкость, будучи также более безопасным и менее дорогим, в то время как NCA имеет более высокую удельную мощность, но аналогичная безопасность и стоимость [104,107]. Следуя другой стратегии, сосредоточенной на кристаллической структуре, были исследованы другие материалы положительного электрода. Первым следует упомянуть оксид лития-марганца, LiMn2O4 (LMO), который имеет кристаллическую структуру шпинели. По сравнению с LCO, LMO имеет преимущества от использования марганца, так как снижает себестоимость и безопаснее в более широком температурном диапазоне, но сталкивается с трудностями в числе возможных перезарядок, в основном за счет необратимых реакций с электролитом. Другим замечательным материалом положительного электрода с другой кристаллической структурой является фосфат лития-железа, LiFePO4 (LFP), который является наиболее используемым материалом из категории полианионых соединений. Наличие крупных полианионов (XO4-3, X=P, Si, As, Mo, W) в кристаллической структуре повышают окислительно-восстановительный потенциал и стабилизирует структуру решетки. LFP, имеющий структуру оливина, обладает хорошей термической стабильностью и высокой мощностью, в т.ч. препятствуя заметной производительности при перезарядке, несмотря на его более низкую удельную емкость по сравнению с LCO [104,107]. В дополнение к этому диапазону возможных материалов для положительного электродов, есть также некоторые возможные материалы для отрицательного электрода. Как упоминалось ранее, рассматривался чистый литий, но соображения безопасности сфокусировали внимание на исследованиях материалов на основе углерода. В 1980-х годах в первой литий-ионной аккумуляторной батарее Sony для изготовления отрицательного электрода использованы материалы на основе нефтяного кокса. В 1990-х отрицательные электроды изготавливались из мезокарбон-углеродных микрогранулы (MCMB) с использованием графитовых сфер. Дальнейшие исследования дали широкий спектр материалов на основе углерода для отрицательного электрода из природного или синтетического графита. Индексом «С» в дальнейшем будут обозначаться отрицательные электроды на основе углерода. Эти материалы доступны по низкой цене и обладают хорошими передаточными характеристиками, высокая электропроводностью и относительно низким изменением объема в процессе интеркаляции/деинтеркаляции (10%) [104,107]. Другой замечательный материал отрицательного электрода основан на титанате лития (LTO), Li4Ti5O12 (также пишется как Li4/3Ti5/3O4) из-за его структура шпинели). Основное преимущество LTO заключается в том, что этот материал имеет почти «нулевую деформацию» в структуре решетки в процессце интеркаляции/деинтеркаляции (0,2%), что значительно ниже по сравнению с изменением объема углеродсодержащих материалов. Кроме того, LTO имеет высокий потенциал (1,55 В по сравнению с Li/Li+), что уменьшает реакции с электролитом и позволяет избежать литиевых дендритных форм- даже при высоких скоростях заряда/разряда. Эти характеристики LTO позволяют работать при более высоких скоростях заряда/разряда и делают батареи намного более стабильными, имеющими высокий срок службы. Однако высокий электродный потенциал LTO также является недостатком, потому что это уменьшает диапазон напряжения батареи, что приводит к снижению удельной энергии и плотности энергии, особенно по сравнению с электродными материалами на основе углерода, которые имеют низкий потенциал (примерно 0,1 В по сравнению с 1,55 В для Li/Li+). Еще одним недостатком LTO является повышенная стоимость из-за использования титана [104,107,108]. Также исследуются другие материалы отрицательного электрода на основе кремния (Si) и олова (Sn). Литий-металлический сплав, такой как LixSiy и LixSny находятся в стадии исследования, особенно из-за их более высокой удельной емкости, но наблюдаемым недостатком является их сильное изменение объема во время процесса интеркаляции/деинтеркаляции, что вызывает трещины и разрушение материала за несколько циклов. Как возможный путь производства улучшенного Li-Sn и Li-Si отрицательных электродов рассматриваются наноструктурные технологии. Один из возможных подходов рассматривает композиционные материалы с наночастицами металлического сплава лития в углеродной матрице, которая придает свободный объем расширению сплава, его сокращение в процессе интеркаляции/деинтеркаляции. В качестве электрода также используется тройной композит на основе Sn-Co-C. Такие образцы уже доступны на рынке, и в настоящее время ведутся исследования по использованию кобальта для снижения затрат [107–109]. В литий-ионных аккумуляторах используются два типа электролитов: жидкие электролиты и гелевые электролиты. В жидких электролитах соль лития (например, LiPF6, LiBF4, LiClO4), растворена в органической жидкости. Гелевые электролиты изготавливаются на основе полимерных пленок, обычно PVDF-ГФП, литиевой соли и углеродном растворителе [107]. Конструкции литий-ионных элементов и аккумуляторов обычно ориентированы на питание по типу энергоячеек или по типу силовых ячеек тип энергии. Схемы устройства LCO/C и NCA/C являются чаще используются в энергетических ячейках, в то время как NMC/C применяются как в силовых, так и в энергетических ячейках. LMО обычно применяют в силовых элементах с графитовым отрицательным электродом, но также и в ячейках большого срока службы с LTO отрицательным электродом. LFP часто применяют в силовых элементах с графитовым отрицательным электродом, но его также можно комбинировать с LTO отрицательным электродом, что даёт к ячейки с большим сроком службы [107,110]. Характеристики литий-ионных аккумуляторов привлекательны: высокая удельная энергия (150–250 Вт·ч/кг в энергоячейках (например, LCO/C, NMC/ C, NCA/C), 70–110 Вт·ч/кг в силовых ячейках (LMO/C, LFP/C)); высота удельная мощность (500–1000 Вт/кг, в энергоячейках (например, LCO/C, NMC/ C, NCA/C), 2000–4000 мкВт/кг в силовых элементах (например, LMO/C, LFP/C)); высокий КПД (85–90%); низкий уровень саморазряда (0,1–0,3%/сутки) и хороший срок службы (от 2000–3000 циклов при глубине разряда 80% для таких элементов, как NMC/C, NCA/C) до очень длительного срока службы (3000–5000+ при 80% глубине разряда, для таких элементов как LFP/C, LMO/LTO) [41,44,74,107,110,111]. Ожидается, что дальнейшие разработки новых материалов электродов и совершенствование технологии производства приведут к снижению затрат и к улучшению характеристик литий-ионных аккумуляторов [103]. При использовании литий-ионных аккумуляторов очень важны вопросы безопасности и охраны окружающей среды, обусловленные тем, что литий очень реакционноспособен и легко воспламеняется, а некоторые электродные материалы и электролиты являются токсичными, требующими специальной утилизации отработанных батарей и мер безопасности [112,113]. 2.2.2.2. Высокотемпературные (HT) батареи 2.2.2.2.1. Натрий-серный аккумулятор (NaS). Разработка технологии натрий-серных аккумуляторов началась в 1984 году с первой коммерческой реализацией в 2002 году, давшей наиболее хорошо зарекомендовавшие себя электрохимические хранилища [114]. Мировая установленная мощность быстро выросла с 10 МВт в 1998 г., 305 МВт в 2008 г., до 450 МВт к 2014 г. [44,114]. Батареи NaS основаны на использовании расплавленной серы и расплавленного натрия в качестве активных материалов соответственно положительного и отрицательного электродов. Для поддержания этих материалов в жидком состоянии батарею необходимо хранить при высоких температурах (290–360 °C), что дало название этой категории батарей. Электролит состоит из твердой бета глиноземной керамики, которая позволяет перемещаться только положительным ионам натрия между электродами. Реакция разряда экзотермическая, поэтому при разряде батареи, в сочетании этого эффекта с омическим нагревом получаем нагрев батареи. Во время заряда идет эндотермическая реакция, но сочетание этого эффекта с омическим нагревом приводит к небольшому снижению температуры батареи [60]. Следовательно, если батарея имеет частый график разрядки и циклы заряда, учитывая тот факт, что при разряде выделяется больше тепла чем оно поглощается зарядом, аккумулятор может поддерживать свою темтемпературу практически без потерь на саморазряд (всего 0,05%) [93,113]. Однако для поддержания температуры батареи выше 290 °C во время длительного ожидания используются электрические нагреватели на внутренней и нижней части стороны батареи, вызывая потери на саморазряд (до 20%/день) [113,115]. Есть еще одна особенность NaS батареи, называемая импульсной подачей энергии. Эта возможность позволяет батарее обеспечить выдачу импульсов электроэнергии с мощностью сверх номинальной мощности в короткие периоды от секунд до часов, и чем короче период, тем выше мощность импульса. Например, данный NaS модуль может отдавать 500 % номинальной мощности в течение 30 с или 150 % в течение 3 ч [60]. Аккумуляторы NaS имеют номинальную мощность в диапазоне от десятков кВт до несколько МВт с накопительной емкостью несколько часов (до 6–8 ч), высокую удельную энергию (150–240 Вт·ч/кг), высокий КПД (75–90%), хороший срок службы (4500–5000 циклов при глубине разряда 80 %) и срок службы (10–15 лет) [41,44,73,99,113]. Натрий и сера дешевы и доступны, и почти все материалы аккумуляторов могут быть использованы повторно. Только расплавленный натрий, обладающий высокой реакционной способностью, следует рассматривать как опасный материал что повышает требования пожарной безопасности [60,100,113,116]. 2.2.2.2.2. Натрий-никель-хлоридные батареи (Na-NiCl2). Натрий-никель-хлоридные батареи также являются высокотемпературными батареями с электродами из расплавленных материалов. Развитие Na-NiCl2 батарей началось в 1970-х годах несколькими компаниями, но с 2007 года права интеллектуальной собственности принадлежат компании General Electric и разрабатываются ей под коммерческим названием «батареи Durathon» [85,117]. Итальянская фирма под названием FIAMM также разработала и начала на основе технологии Na-NiCl2 выпуск батареи для резервного питания, хранения и мобильных устройств с коммерческое названием «батареи SoNick» [118]. Вместо расплавленной серы в этих батареях в качестве активного материала положительного электрода используется хлорид никеля (NiCl2) или смесь хлорида никеля и хлорида железа (FeCl2). Есть и конструктивное отличие между NaS и Na-NiCl2 батареями. У первых только керамический бета-глиноземный электролит, а второй имеет в дополнение к этому электролиту расплавленный электролит, состоящий из хлористого алюмината натрия (NaAlCl4). Основным эксплуатационным неудобством Na-NiCl2 батарей является то, что для их запуска от состояния затвердевших материалов до рабочего состояния требуется нагрев в течение 12–15 ч. [85]. Характеристики Na-NiCl2 батарей аналогичны характеристикам NaS батарей. Они имеют номинальную мощность в диапазоне от десятков кВт до нескольких МВт с аккумулированием емкости за несколько часов, немного уступающую удельную энергию (94– 120 Вт·ч/кг), высокий КПД (86–88%), хороший ресурс (4000– 4500 циклов при глубине разряда 80 %) и срок службы (10–15 лет) [41,44,85,113,119]. Основное отличие от NaS батарей связано с их безопасностью. В случае выхода из строя твердого электролита расплавленный натрий будет сначала реагирует с расплавленным хлоралюминатом натрия, две расплавленных жидкости превращаются в два неопасных материала, а алюминий в твердом состоянии в диапазоне рабочих температур батареи, создаёт физический барьер для предотвращения любых дальнейших реакций. Это свойство Na-NiCl2 батарей делает их более безопасными, по сравнению с NaS батареями [120, 121]. 2.2.2.3. Проточные батареи. Проточные батареи имеют такой же электрохимический процесс, как и обычные батареи, при этом ионы перемещаются от отрицательного и положительного электродов во время циклов заряда и разряда через селективную мембрану. Однако вместо двух электродов, состоящих из электроактивных материалов и селективного электролита, проточные батареи имеют резервуары с растворами жидких электролитов, содержащими ионы, которые реагируют в блоке ячеек(stack of cells), одна из которых имеет два электрода и ионоселективную мембрану, как показано на рис. Рис. 8. 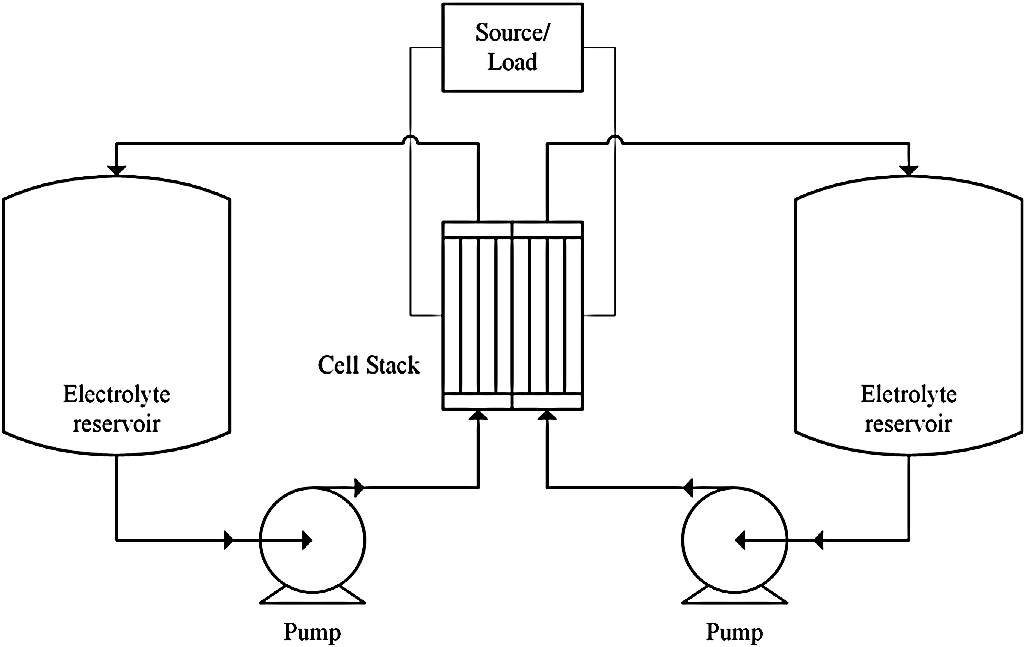 Рис. 8. Схема проточной батареи. Наиболее важным следствием этой концепции является независимость между номинальной мощностью и расчетной емкостью. Номинальная мощность зависит от активной площади, блока ячеек(cell stack), а емкость хранилища зависит от объема растворов электролитов, хранящихся во внешних резервуарах, и, следовательно, модернизация может быть выполнена с небольшими дополнительными затратами путем изменения одного или обоих этих параметров. Другие результаты этой концепции заключаются в том, что DOD(глубину разряда) можно игнорировать, а саморазряд невелик, поскольку между двумя химическими веществами почти нет контакта, за исключением случаев, когда они закачиваются в блок ячеек(cell stack). [40,41,60,100,112]. Оперативное следствие этой концепции касается фаз запуска и остановки проточной батареи. Фаза остановки происходит, когда проточная батарея не работает. Чтобы уменьшить потери на саморазряд, насосы останавливаются, а растворы двух электролитов сливаются из пакета элементов(блока ячеек). Перед повторным запуском пусковая фаза начинается с увеличения скорости насосов, затем система заполняется водой и, наконец, насосы разгоняются до рабочей скорости. Период затопления обеспечивает заполнение всех стоек соответствующими растворами электролитов и отвечает за большую часть времени начальной фазы. Фаза запуска и остановки занимает около 7 минут.[122]. Существует несколько вариантов электрохимических соединений, которые могут составить основу проточной батареи, три из которых будут рассмотрены в этом разделе: ванадиевая окислительно-восстановительная батарея (VRB), бромноцинковая батарея (ZBB) и бромисто-полисульфидная батарея (PSB). VRB — одна из наиболее изученных и продвинутых проточных батарей. VRB использует две окислительно-восстановительные пары ванадия (V2+/ V3+ и V4+/ V5+) в мягких растворах серной кислоты. Одним из наиболее востребованных преимуществ VRB является использование ванадия в растворах двух электролитов, что устраняет проблемы перекрестного загрязнения, возникающие в результате диффузии ионов через селективную мембрану. ВРБ технология, основанная на сернокислотном электролите, имеет особое ограничение из-за растворимости частиц ванадия, что ограничивает плотность энергии системы на низком уровне (<25 Вт·ч/л). Основной проблемой ВРБ является стоимость электролитов, в основном связанная с переработкой сырья, поскольку ванадий встречается в природе в основном в комбинированных формах и в низких концентрациях. Технология VRB находится в коммерческой фазе с участием таких компаний, как Sumitomo Electric и Prudent Energy, но все еще проводится много исследований, направленных на улучшение, особенно в области плотности энергии.[123–127]. Аккумулятор ZBB содержит растворы бромистого цинка в двух баках. При зарядке металлический цинк будет осаждаться в виде тонкой пленки на одной стороне отрицательных электродов, в то время как элементарный бром образуется на положительных электродах, смешиваясь с другими веществами, образуя полибромид, который будет циркулировать обратно в резервуар. Новая конструкция ZBB позволяет отказаться от одного резервуара для хранения и связанного с ним насоса, что снижает общий вес системы и выбросы брома. Основным преимуществом ZBB является более высокая плотность энергии (-80 Вт·ч/л). Есть несколько компаний, которые коммерциализируют продукты с технологией ZBB, такие как EnSync (ранее ZBB Energy), Redflow Ltd. и Primus Power. [123–125]. ПСБ использует растворы полисульфида натрия и бромистого натрия. Электроактивные частицы PSB обладают более высокой растворимостью, что приводит к потенциально более высокой плотности энергии (-80 Вт · ч / л), чем у других проточных батарей. Первоначально PSB была разработана компанией Regensys Technologies Ltd., которая успешно провела испытания прототипа мощностью 1 МВт, однако новый владелец, RWE Innogy, отменил эти проекты в 2003 году. Технология PSB была куплена Prudent Energy, и пока не было объявлено ни о какой крупномасштабной демонстрации[123–125,128]. Проточные батареи имеют такую же общую характеристику, как низкая плотность энергии (10–70 кВт*ч/м^3), средний или высокий КПД (60–70%), очень низкий уровень саморазряда (0,1–0,4%/день), очень длительный срок службы (несколько тысяч циклов) и срок службы (10–15 лет). Обычно номинальная мощность колеблется от десятков кВт до нескольких МВт с емкостью хранения до 10 ч.[40,41,60,115]. Проводятся исследования и разработки для повышения плотности энергии и мощности с использованием проводящих сетей на основе углерода.[129]. Различия между этими технологиями связаны с несколькими конструктивными аспектами. При выборе материала есть более дорогие материалы, такие как ванадий, или более распространенные и дешевые, такие как цинк и натрий. Существуют также особенности работы, такие как ZBB, когда густое бромистое масло течет на дно резервуара, что требует специальной системы рециркуляции. Также необходимо учитывать экологические проблемы, VBR имеет слабокислотный раствор, сравнимый со свинцово-кислотным аккумулятором, но представляет собой нетоксичный электроактивный материал, в то время как ZBB и PSB имеют коррозионно-активные растворы брома, а сам бром является токсичным материалом, требующим особого обращения.[60,104,130] 2.2.2.4. Металловоздушные батареи. Металл-воздух — это новая исследовательская технология с потенциально значительно лучшими техническими характеристиками, что является многообещающей концепцией для будущего. Эти батареи используют кислород из атмосферного воздуха в пористом положительном электроде и металл в качестве отрицательного электрода, как показано на Рис. 9. Воздух не включается в вес положительного электрода при расчете удельной энергии, и, следовательно, металл-воздушная батарея может достигать высокого уровня удельной энергии. Теоретическая удельная энергия для воздуха цинка, натрия-воздуха, магния-воздуха, алюминия-воздуха и лития-воздуха составляет 1350, 2260, 6460, 8100, 11 100 Втч/кг соответственно.[116,131]. 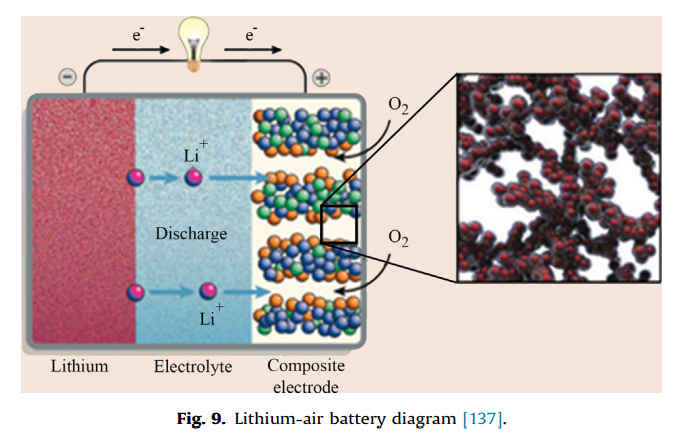 По сравнению с литий-ионными батареями, которые имеют теоретическую удельную энергию 450 Вт·ч/кг и коммерчески осуществимую удельную энергию 120 Вт·ч/кг, металловоздушные батареи обладают большим потенциалом.[116]. Возможность перезарядки магниевых и алюминиевых воздушных батарей еще не продемонстрирована, в отличие от литиевых, натриевых и цинковых воздушных батарей.[132,135]. Удельный уровень энергии 700 Вт·ч/кг для воздушно-цинкового элемента уже продемонстрирован при КПД 60–65%.[135]. Существует большой интерес к натрийвоздушным батареям, потому что натрий является гораздо более распространенным металлом на Земле, чем литий, и некоторые исследования указывают на то, что реакции натрийвоздушной ячейки легче обратить вспять по сравнению с реакциями литийвоздушной ячейки.[133,134]. Дальнейшие исследования должны решить две основные проблемы: срок службы должен быть увеличен (в настоящее время менее нескольких сотен циклов), а затраты должны быть в конкурентоспособном диапазоне. Цели Комиссии ЕС на 2020–2030 годы: металло-воздушные батареи с ресурсом более 3000 циклов с удельной энергией более 500 Вт·ч/кг.[136]. |
