генетика. Генетика. Хромосомные Аберрации
 Скачать 94.59 Kb. Скачать 94.59 Kb.
|
|
Бюджетное профессиональное образовательное учреждение Воронежской области «Острогожский медицинский колледж» РЕФЕРАТ На тему: «Хромосомные Аберрации» Учебный предмет «Генетика с основами мед.генетики» Обучающийся: Гавшина Анастасия Сергеевна Группа: М-022 Специальность «Сестринское дело» Руководитель: ОГАНИСЯН М.С 2022 год Введение: Глава 1.Возникновение хромосомных аберраций Глава 2.Причины хромосомных аберраций Глава 3.Виды хромосомных аберраций Делеции Дупликации Инверсии Транслокации Глава4.Сайты ломкости Глава5.Методы изучения хромосомных перестроек Список используемой литературы Введение Хромосомные аберрации (хромосомные мутации, хромосомные перестройки) — изменения структуры хромосом. Классифицируют делеции (удаление участка хромосомы), инверсии (изменение порядка генов участка хромосомы на обратный), дупликации (повторение участка хромосомы), транслокации (перенос участка хромосомы на другую). Хромосомные перестройки носят, как правило, патологический характер и нередко приводят к гибели организма. Показано значение хромосомных перестроек в видообразовании и эволюции. Глава 1. Возникновение хромосомных аберраций В ходе кроссинговера образуются разрывы хромосом, которые затем репарируются. Нарушения процесса репарации могут привести к появлению хромосомных перестроек. Разрывы хромосом и, как следствие, образование перестроек происходят под действием различных мутагенных факторов: физической (ионизирующее излучение), химической или биологической (транспозоны, вирусы) природы. Также некоторые хромосомные перестройки (аберрации) характерны для носителей специфических сайтов ломкости. Более 500 известных транслокаций специфически связаны со злокачественными новообразованиями. Первой такой обнаруженной аномалией была филадельфийская хромосома, которая определяет до 95 % случаев хронического миелолейкоза и большинство случаев острого лимфобластного лейкоза. Глава 2.Причины хромосомных аберраций. Большинство хромосомных аберраций происходят случайно, без видимых причин. Однако есть определенные факторы, при действии которых риски перестроек увеличиваются: возраст; действие ионизирующего излучения; прием некоторых медикаментов или химических веществ. Основной предпосылкой для возникновения хромосомных перестроек является появление в клетке двунитевых разрывов ДНК, то есть разрывов обеих нитей спирали ДНК в пределах нескольких пар оснований. Двунитевые разрывы ДНК возникают в клетке спонтанно или под действием различных мутагенных факторов: физической (ионизирующее излучение), химической или биологической (транспозоны, вирусы) природы. Двунитевые разрывы ДНК возникают запрограммированно во время профазы I мейоза, а также при созревании Т- и B-лимфоцитов во время специфической соматической V(D)J рекомбинации. Нарушения и ошибки процесса воссоединения двунитевых разрывов ДНК приводят к появлению хромосомных перестроек. Глава 3. Виды хромосомных аберраций Делеции 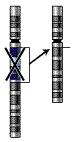 рис .1 рис .1Различают терминальные (утрата концевого участка хромосомы) и интеркалярные (утрата участка на внутреннем участке хромосомы) делеции. Если после образования делеции хромосома сохранила центромеру, она аналогично другим хромосомам передается при делении, участки же без центромеры как правило утрачиваются. При конъюгации гомологов во время кроссинговера у нормальной хромосомы на месте делеции в мутировавшей хромосоме образуется т. н. делеционная петля, которая компенсирует отсутствие делетированного участка. Исследованные делеции редко захватывает протяженные участки хромосом, обычно такие аберрации летальны. Самым хорошо изученным заболеванием, обусловленным делецией, является синдром кошачьего крика, описанный в 1963 году Джеромом Леженом. В его основе лежит делеция небольшого участка короткого плеча 5 хромосомы. Для больных характерен ряд отклонений от нормы: нарушение функций сердечно-сосудистой, пищеварительной систем, недоразвитие гортани (с характерным криком, напоминающим кошачье мяуканье), общее отставание развития, умственная отсталость, лунообразное лицо с широко расставленными глазами. Синдром встречается у 1 новорожденного из 50000. Другой интересной делецией является делеция в гене, кодирующем рецептор CCR5. Этот рецептор используется вирусом иммунодефицита человека (ВИЧ) для распознавания своей цели — Т-лимфоцитов. Продукт гена с делецией получил название CCR5-Δ32, этот вариант CCR5 не узнается ВИЧ, и носители такой мутации к ВИЧ невосприимчивы (это порядка 10 % европейцев). Дупликации 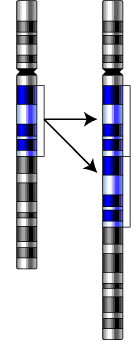 Рис.2 Рис.2Дупликации появляются в результате неравного кроссинговера (в этом случае второй гомолог несет делецию) или в результате ошибки в ходе репликации. При конъюгации хромосомы с дупликацией и нормальной хромосомы как и при делеции формируется компенсационная петля. Практически у всех организмов в норме наблюдается множественность генов, кодирующих рРНК (рибосомальную РНК). Это явление назвали избыточностью генов. Так у E. coli на рДНК (ДНК, кодирующее рРНК) приходится 0,4 % всего генома, что соответствует 5-10 копиям рибасомальных генов. Другой пример дупликации — мутация Bar у Drosophila, обнаруженная в 20-х годах XX века Т. Морганом и А. Стертевантом. Мутация обусловлена дупликацией локуса 57.0 X-хромосомы. У нормальных самок (B+/B+) глаз имеет 800 фасеток, у гетерозиготных самок (B+/B) глаз имеет 350 фасеток, у гомозигот по мутации (B/B) — всего 70 фасеток. Обнаружены также самки с трижды повторенным геном — double Bar (BD/B+). В 1970 году Сусумо Оно в монографии «Эволюция путем дупликации генов» разработал гипотезу об эволюционной роли дупликаций, поставляющих новые гены, не затрагивая при этом функций исходных генов. В пользу этой идеи говорит близость ряда генов по нуклеотидному составу, кодирующих разные продукты. Это трипсин и химотрипсин, гемоглобин и миоглобин и ряд других белков. Инверсии  a — нормальная хромосома, b — парацентрическая инверсия, c — перицентрическая инверсия. a — нормальная хромосома, b — парацентрическая инверсия, c — перицентрическая инверсия.Различают парацентрические (инвертированный фрагмент лежит по одну сторону от центромеры) и перицентрические (инвертированный фрагмент лежит по разные стороны от центромеры) инверсии. При инверсиях не происходит потери генетического материала, потому как таковые инверсии как правило не влияют на фенотип, но если в инверсионной гетерозиготе (то есть организме, несущем как нормальную хромосому, так и хромосому с инверсией) происходит кроссинговер, то существует вероятность формирования аномальных хроматид. В случае парацентрической инверсии образуется одна нормальная и одна инвертированная (фенотипически нормальная) хроматиды, дицентрическая хроматида с дупликацией и делецией (при расхождении хроматид она обычно разрывается на две) и ацентрическая хроматида с дупликацией и делецией (обычно утрачивается). В случае перицентрической инверсии образуется одна нормальная и одна инвертированная хроматиды, а также две хроматиды с дупликацией и делецией. Гаметы, несущие дефектные хромосомы, обычно не развиваются или погибают на ранних этапах онтогенеза. Но гаметы с инвертированной хромосомой развиваются в организмы, 50 % гамет которых нежизнеспособны. Т.о. мутация сохраняется в популяции. У человека наиболее распространенной является инверсия в 9 хромосоме, не вредящая носителю, хотя существуют данные, что у женщин с этой мутацией существует 30 % вероятность выкидыша. 6. Транслокации 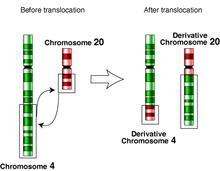 Реципрокная транслокация 4 и 20 хромосом человека. Помимо переносов участков с одной негомологичной хромосомы на другую, классифицируют также реципрокные транслокации (когда две негомологичные хромосомы обмениваются участками), Робертсоновские транслокации (при этом две негомологичные хромосомы объединяются в одну), а также транспозиции (перенос участка хромосомы на другое место на той же хромосоме). Транслокация, реципрокная транслокация и транспозиция, которые не сопровождаются утратой проявляются фенотипически. Однако, как и в случае с инверсиями, в процессе гаметогенеза часть сформированных гамет несет летальные перестройки. Например, в случае реципрокной транслокации обычно выживает не более 50 % зигот. Примером транслокации может служить "семейный" синдром Дауна. При этом заболевании у одного из родителей обнаруживается фенотипически не проявляющаяся транслокация 21-ой хромосомы на 14-ую. У такого человека с вероятностью в 1/4 образуются гаметы с двумя 21 хромосомами (одна свободная и одна траслоцированная). При слиянии генетического материала (сбалансированные транслокации), часто не такой гаметы с нормальной образуется трисомик по 21 хромосоме. Другой пример — транслокация типа "Филадельфийская транслокация" между девятой и двадцать второй хромосомами. В 95 % случаев именно эта мутация является причиной одной из форм хронической лейкемии (chronic myelogenous leukemia). Робертсоновские транслокации, возможно, являются причиной различий между числом хромосом у близкородственных видов. Показано, что два плеча 2-й хромосомы человека соответствуют 12 и 13 хромосомам шимпанзе. Возможно, 2-я хромосома образовалась в результате робертсоновской транслокации двух хромосом обезьяноподобного предка человека. Таким же образом объясняют тот факт, что различные виды дрозофилы имеют от 3 до 6 хромосом. Робертсоновские транслокации привели к появлению в Европе нескольких видов-двойников (хромосомные расы) у мышей группы видов Mus musculus, которые, как правило, географически изолированы друг от друга. Набор и, как правило. экспрессия генов при робертсоновских транслокациях не изменяются, поэтому виды практически неотличимы внешне. Однако они имеют разные кариотипы, а плодовитость при межвидовых скрещиваниях резко понижена. Сайты ломкости В 70-х годах XX века было обнаружено явление повышенной ломкости хромосом — при окраске метафазных хромосом культур клеток некоторых индивидов красителями некоторые их участки оставались бесцветными. Для этих участков характерна повышенная вероятность хромосомных разрывов. Природа этого явления не до конца изучена, возможно оно связано с тем, что в этих участках хроматин находится в неконденсированной форме. Исследования говорят о связи этого явления с одной из форм слабоумия (синдром Мартина-Белла), а также заболеваемостью раком. Методы изучения хромосомных перестроек Хромосомные аберрации (ХА) изучаются на стадии метафазы(метафазный метод), а так же на стадиях анафазы и телофазы (ана-телофазный метод). Эти методы позволяют выявлять мутагенную активность того или иного фактора, оценить степень мутагенной активности фактора, силу воздействия разных его доз, определять минимальную действующую дозу, определять зависимость доза-эффект. Метафазный метод является наиболее точным, так как он позволяет регистрировать большое количество типов аберраций, определяет тип перестройки и в какой именно хромосоме она произошла. Но этот метод пригоден только для объектов, для которых уже идентифицированы все хромосомы, определен кариотип. Метафазный анализ более сложный и требует высокой квалификации исследователя. Этот метод используется, например, для диагностики хромосомных болезней человека. Ана-телофазный анализ простой, экономичный, не требует знания кариотипа и идентификации типов повреждений хромосом. Он позволяет регистрировать меньшее типов аберраций, но его чувствительность вполне достаточна для заключения "мутагенен" или "не мутагенен" фактор. Методы выявления хромосомных аберраций.Необходимость поиска хромосомных аберраций может возникнуть в рамках пренатальной диагностики, когда имеются данные о высоком риске тех или иных врожденных аномалий. В других случаях исследование назначают при подозрении на врожденные патологии у детей и взрослых. Кроме того, определение хромосомных аберраций является краеугольным камнем при типировании злокачественных солидных и опухолей кроветворения, иммунной системы. В этом случае наличие мутаций будет определять протоколы лечения и прогноз выздоровления и/или выживаемости. Для выявления хромосомных аберраций используются специальные молекулярно-генетические и цитогенетические методы. В пренатальной диагностике анализ перестроек проводят с помощью G-бэндинга в метафазной стадии деления клетки. Однако для забора материала требуется инвазивное вмешательство, которое несет определенные риски как для матери, так и для плода. Список используемой литературы Клаг У., Каммингс М. Основы генетики — М.: Мир, 2007. Биология. Книга 1. Под ред. акад. РАМН Ярыгина В. Н. — М.: Высшая школа, 2003. Грин Н. и др., Биология — М.: Мир, 1990. Т. 1-3. Жимулев И. Ф. Общая и молекулярная генетика. — Новосибирск: Изд-во НГУ, 2003. Прохорова И. М., Фомичёва П. Н., Ковалёва М. И. Оценка митотоксического и мутагенного действия факторов окружающей среды // ЯрГУ : Методические указания. — Ярославль: ЯрГУ, 2003. — С. 23. |
