Хронические заболевания и опухоли поджелудочной железы Цели, достигаемые при обучении
 Скачать 0.62 Mb. Скачать 0.62 Mb.
|
|
Лечение Самое удовлетворительное лечение для пациентов с глюкогономой – полное удаление всей ткани опухоли. У пациентов с глюкогономами имеет место длительный и глубокий катаболический статус. Должны быть определены пищевые добавки, восполняющие дефицит аминокислот и другие метаболические дефициты. Необходимо рассматривать применение аналогов соматостатина в предоперационной подготовке при этих опухолях, поскольку они могут заметно уменьшить уровни циркулирующего глюкагона и, следовательно, уменьшить или полностью изменить его анаболические эффекты. Большинство опухолей расположены в теле и хвосте поджелудочной железы, таким образом, дистальная резекция поджелудочной железы может быть выполнена в большинстве случаев резектабельных опухолей. Глюкагономы являются злокачественными у 60-70% пациентов, и вероятность радикального излечения мала. Однако, резекция первичных и даже метастатических поражений может послужить реальной паллиативной процедурой, если ткань опухоли может быть безопасно удалена. Большинство островковоклеточных карцином обладает медленным ростом, и опухоли альфа-клеток – не исключение. Контроль гормональных эффектов этих опухолей в основном приносит пользу пациентам. Медикаментозная терапия может облегчить гормональные симптомы у пациентов с запущенной метастатической болезнью, у которых хирургическое уменьшение объема опухолевой массы не возможно. Аналог соматостатина – октреотид – снижает уровни глюкагона сыворотки и уменьшает проявления некролитической мигрирующей эритемы, диабета, диарею и неврологические симптомы. Дакарбазин и стрептозоцин используют для лечения при метастазах глюкагономы с некоторым успехом. Как и при других эндокринно-клеточных опухолях поджелудочной железы, при метастазах в печень также применимы резекция, эмболизация печеночной артерии или трансплантация печени. ВИПОМА В 1958 г. Вернер [Verner] и Моррисон [Morrison] первыми описали синдром водянистой диареи, гипокалиемии и ахлоргидрии, связанный с не-бета-клеточной опухолью поджелудочной железы. Другие названия этого синдрома включают панкреатическую холеру и сокращение ВДГА, принятое для обозначения водянистой диареи, гипокалиемии и ахлоргидрии. В 1970-ых, когда был обнаружен вазоактивный интестинальный пептид (ВИП), который был связан с этим синдромом, опухоли стали называть ВИПомами. ВИПомы – редкие опухоли (1 случай на 10 миллионов популяции ежегодно), которые главным образом встречаются в хвосте поджелудочной железы. Когда эти опухоли действительно встречаются, они часто бывают большими и имеют метастазы в печень. Десять процентов опухолей являются производными островковоклеточной гиперплазии поджелудочной железы, а примерно 10% могут быть выявлены в экстрапанкреатических участках, типа ободочной кишки, бронхов, надпочечников, печени и симпатических ганглиев. Проявления ВИПомы обычно находят у пациентов в возрасте 40-50 лет. Преобладающая из имеющих место жалоб – профузная секреторная диарея объемом до 10 л в день. Диарея является безболезненной, кал не имеет запаха, имеет цвет чая и сохраняется несмотря на ограничение пищи. В результате диареи у пациентов развивается гипокалиемия и ацидоз. Дефицит жидкости и электролитов при ВИПоме настолько глубок, что он подлежит коррекции перед переходом к процессу диагностики и лечения. Диагностика и определение локализации Эти пациенты обычно подвергаются тщательному обследованию для выявления более частых причин диареи перед исследованием уровня ВИП в плазме крови. Среднее время от появления первых симптомов до постановки диагноза – 3 года. Для подтверждения диагноза необходимо, чтобы уровень ВИП в сыворотке крови натощак составлял более 200 пг/мл. У пациентов с ВИПомой средний уровень ВИП близок к 1000 пг/мл. Некоторые исследователи являются сторонниками применения СРС в качестве первой линии радиологического исследования для определения локализации этих опухолей. ВИПомы обычно без труда визуализируются с помощью КТ что, однако, связано с большими размерами (> 3 см) большинства этих опухолей (рис. 23). 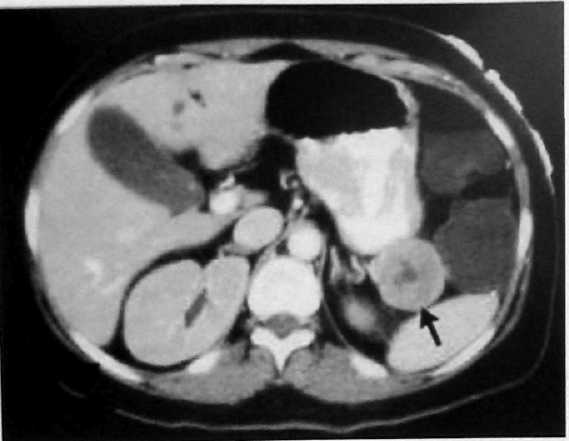 Рис. 23. КТ-сканограмма ВИПомы. Лечение Хирургическое лечение – единственное радикальное мероприятие при этой опухоли. Перед операцией у пациентов должен быть адекватно восполнен дефицит жидкости в организме и скоррегированы электролитные нарушения. Диарею можно контролировать перед операцией с помощью соматостатиновых аналогов октреотида длительного действия. Большинство этих опухолей расположено в хвосте поджелудочной железы, и, вследствие их злокачественного потенциала, показана дистальная резекция поджелудочной железы, а не энуклеация. В зависимости от опыта хирурга в случае небольших неинвазивных опухолей предпочтительно выполнение лапароскопической операции с сохранением селезенки. Если радикальная резекция невозможна – более 50% опухолей имеют метастазы при манифестации – уменьшение объема опухоли может помочь в облегчении симптоматики. Октреотид может использоваться после операции для контроля симптомов и стабилизации роста опухоли у больных с резидуальным заболеванием. Эти опухоли особенно чувствительны к стрептозоцину. Соматостатинома Среди самых редких из эндокринных опухолей поджелудочной железы соматостатиномы являются производными дельта-клеток островков Лангерганца. В 1977 г. Ганда [Ganda] и его коллеги, а также Ларсон [Larsson] с соавторами независимо друг от друга сообщили о первых пациентах с соматостатиномой. Синдром соматостатиномы, который описал Крейс [Krejs] с соавторами в 1979 г., включает в себя гипергликемию, холелитиаз, стеаторею и диарею. Средний возраст пациентов с данным диагнозом составляет 50 лет, с равным распределением между мужчинами и женщинами. Большинство соматостатинóм являются злокачественными. Клиническая картина Классический синдром сахарного диабета, холелитиаз, стеаторея и диарея не позволяют рано обнаружить опухоль, поскольку эти симптомы обычно являются невыраженными, неспецифичными и относительно частыми во всей популяции. Ингибирование секреции инсулина ведет к легкой гипергликемии. Уменьшенная сократительная способность желчного пузыря вследствие ингибирования холецистокинина приводит к формированию желчных камней. Ингибирование панкреатических ферментов, секреции бикарбонатов и кишечного всасывания приводит к диарее и стеаторрее. У пациентов также может проявляться желудочная гипохлоргидрия вследствие ингибирования секреции гастрина. Эти клинические проявления редко сопутствуют соматостатиномам, возникающим в двенадцатиперстной кишке. Вместо этого у пациентов с дуоденальными соматостатиномами наблюдаются обструктивные симптомы, включающие боль в животе и желтуху. Дуоденальные соматостатиномы часто идентифицируются как случайные находки. Диагностика и определение локализации Ранняя диагностика соматостатинóм трудна, поскольку симптомы часто слабо выражены и неспецифичны. Эти опухоли часто обнаруживают случайно во время оценки неопределенных абдоминальных симптомов или во время холецистэктомии или эксплоративной лапаротомии. Измерение уровня соматостатина сыворотки крови натощак может помочь подтвердить диагноз, если значение выше 100 пг/мл. Большинство соматостатинóм – солитарные опухоли, 70% которых расположены в поджелудочной железе, чаще в ее головке. Оставшиеся опухоли расположены в двенадцатиперстной кишке, ампуле или проксимальном отделе тонкой кишки. Поскольку большинство этих опухолей, расположенных в головке поджелудочной железы, являются крупными, определение локализации соматостатинóм поджелудочной железы часто достигается с помощью КТ или УЗИ. ЭУЗИ, МРТ и СРС также могут играть определенную роль при определении локализации небольших или метастатических опухолей. Поскольку большое число дуоденальных соматостатинóм являются небольшими (<1 см), УЗИ может быть особенно полезным при определении их локализации. Лечение Хирургическая резекция предлагает единственный шанс для излечения, но большинство соматостатинóм уже имеют метастазы во время манифестации. Уменьшение объема опухоли может обеспечить симптоматическое облегчение. Во время операции должна быть выполнена холецистэктомия из-за высокой частоты холелитиаза. При нерезектабельных случаях октреотид и альфа-интерферон могут облегчить симптомы. В целом, прогноз не благоприятный, поскольку у большинства пациентов проявляется метастатическая болезнь. НЕФУНКЦИОНИРУЮЩИЕ НЕЙРОЭНДОКРИННЫЕ ОПУХОЛИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Нефункционирующие нейроэндокринные опухоли поджелудочной железы могут быть самыми многочисленными эндокринными опухолями поджелудочной железы, с предполагаемой частотой 10-25% от всех опухолей клеточных островков. Они обычно идентифицируются у пациентов в возрасте 40-50 лет с равным распределением между мужчинами и женщинами. Традиционно полагали, что нефункционирующие опухоли представляют собой большие опухоли с метастазированием в 60-80% случаев, установленным во время постановки диагноза. Однако, благодаря широкому распространению визуализирующих методик исследования брюшной полости с высокой разрешающей способностью эти опухоли все более и более часто идентифицируют как небольшие бессимптомные опухоли. Однако, отсутствие функции, возможно, является некорректным термином, поскольку эти опухоли неотличимы при патогистологическом анализе от функционирующих опухолей. Клиническая картина Поскольку эти опухоли, как оказалось, не секретируют известные активные гормоны, нефункционирующие нейроэндокринные опухоли поджелудочной железы не имеют идентифицируемого синдрома, присущего их функционирующим аналогам. Эти опухоли часто проявляются поздно при наличии уже большой опухолевой массы и метастазов. В результате пациенты жалуются на локальные симптомы сдавления, включающие боль в животе, потерю массы тела или желтуху, что симулирует аденокарциному поджелудочной железы. Аденокарциномы поджелудочной железы обычно меньше размерами, таким образом, если поражение больше 4-5 см в размере, должна быть заподозрена нефункционирующая опухоль островковых клеток поджелудочной железы. Отмечается рост числа нефункционирующих опухолей, случайно идентифицируемых с помощью современных методов визуализации. Поскольку они представляют собой случайные находки, у пациентов часто отсутствуют симптомы вследствие отсутствия какого-либо определимого синдрома. Хотя эти опухоли могут секретировать различные гормоны, включая панкреатический полипептид, нейротензин и кальцитонин, эти гормоны, как известно, не проявляются какими-либо симптомами. С другой стороны, они могут продуцировать незначительные количества биологически активных гормонов, неактивные формы гормонов или гормоны, которые все же должны быть идентифицированы. Диагностика Опухоли, проявляющиеся симптомами сдавления, легко идентифицируются при КТ или МРТ. Они обладают характеристиками, сходными с их функционирующими аналогами, включая высокую степень контрастного усиления вследствие васкуляризации, кистозную дегенерацию и кальцификацию. В отличие от аденокарциномы, эти опухоли не прорастают в окружающие сосудистые структуры или билиарное дерево на ранних стадиях своего течения. При случайно идентифицированных поражениях ЭУЗИ с биопсией может подтвердить наличие нефункционирующей опухоли поджелудочной железы. Опухолевые маркеры также могут быть полезными при идентификации этих опухолей. Кроме панкреатического полипептида, нейротензина и кальцитонина, у этих пациентов идентифицируют увеличенный уровень таких протеинов, как нейроно-специфичная энолаза и хромогранин A. Кроме того, такие гормоны, как инсулин, глюкагон, соматостатин и серотонин, могут быть обнаружены при нефункционирующих опухолях поджелудочной железы. Хромогранин A, вероятно, является лучшим общим маркером сыворотки для диагностики и последующего наблюдения этих опухолей. Маркеры,_выявляемые_при_нефункционирующих_нейроэндокринных_опухолях_поджелудочной_железы'>Маркеры, выявляемые при нефункционирующих нейроэндокринных опухолях поджелудочной железы
Лечение При больших опухолях, проявляющихся симптомами сдавления, если возможно, показано полное хирургическое удаление в объеме ПДР, при опухолях головки поджелудочной железы, или дистальной резекции железы, при опухолях тела и хвоста. Поскольку биологические свойства нефункционирующих опухолей противоречивы, способ идеального лечения для небольших опухолей остается неясен. Для опухолей менее 2 см, которые были случайно идентифицированы, энуклеация может послужить адекватным контролем заболевания. Напротив, наблюдение с серией радиологических исследований, может быть адекватным в случае определенных клинических сценариев, при которых не оправдана операция. Поскольку течение этих опухолей часто безболезненное, необходимо длительное последующее наблюдение, независимо от терапевтического подхода. ЛИТЕРАТУРА Основная литература: Хирургические болезни: учебник / Под ред. М.И. Кузина, - М.: Медицина, 2006. Хирургические болезни: учебник в 2 т. / Под ред. В.С. Савельева, - М.: ГЭОТАР-МЕДИА, 2008. Хирургия: учебное пособие в 2 ч. / Е.М. Благитко, А.С. Полякевич, - Новосибирск: Сибмедиздат НГМА, 2005. Дополнительная литература: Амбулаторно-поликлиническая хирургия: Руководство для врачей, преподавателей и студентов / Под ред. Е.М.Благитко. – Новосибирск: Наука, 2001. – 572 с. Бауэр И.В., Благитко Е.М., Вардосанидзе К.В. и др. Хирургия центральной районной больницы: Руководство для врачей / Под ред. Е.М. Благитко. — Новосибирск: Наука, Сиб. отд-ние, 1994. — 536 с. Благитко Е.М. Кровотечение из кист поджелудочной железы // Хирургия. — 1985. — № 8. — С. 22—23. Благитко Е.М. Ложные кисты поджелудочной железы, осложненные кровотечением // Клин. мед. — 1984. — № 5. — С. 82—85. Гришин И.П. Аскальдович Г.И. Хирургия поджелудочной железы. Минск: Вышейшая школа, 1493. - 180с. Данилов М.В., Федоров В.Д. Хирургия поджелудочной железы. – М.: Медицина, 1995. - С. 510 Добров С.Д. Выбор способа операции при кистах поджелудочной железы: Автореф. дис. ... канд. мед. наук. - Новосибирск. – 1999. – 17 с. Заболевания поджелудочной железы: мат. конф. / Под ред. Е.М. Благитко. – Новосибирск, 1992. – 212 с. Кузин М.И., Данилов М.В., Благовидов Д.Ф. Хронический панкреатит. — М.: Медицина, 1985. — 386 с. Лопаткина Т. Н. Хронический панкреатит // Новый медицинский журнал. - 1997. - № 2. - С. 7-11. Лотов А.Н., Андрианов В.Н., Кулезнева Ю.В., Кузин Н.М. Чрескожное дренирование псевдокист поджелудочной железы под контролем УЗИ и рентгенотелевидения // Хирургия. — 1994. — № 5. — С. 42—45. Мараховский Ю.X. Хронический панкреатит: Новые данные об этиологии и патогенезе. Современная классификация. Успехи в диагностике и лечении// Русский мед. журнал. - 1996. - Т. 4. - № 3. - С. 156-160. Методические рекомендации для преподавателей V-VI курсов кафедры госпитальной хирургии / Под ред. Е.М. Благитко. – Новосибирск, 2002. — Ч. 2. — С. 30–37. Милонов О.Б., Соколов В.И. Хронический панкреатит. — М.: Медицина, 1976. — 188 с. Попов А.Л. Эндоскопические методы при лечении больных с кистами поджелудочной железы: Автореф. дис. ... канд. мед. наук. - Новосибирск. – 2001. – 16 с. Скуя Н. А. Заболевания поджелудочной железы. — М.: Медицина, 1986. — 240с. Шалимов А.А. Болезни поджелудочной железы и их хирургическое лечение. М., 1970. 280с. Юдин В.А., Низов А.А. Хронический панкреатит: Актуальные вопросы хирургии. - Рязань, 1997. Beger H.G., Buchler M. Duodenum-preserving resection of the head of the pancreas in chronic pancreatitis with inflammatory mass in the head // World J. Surg. – 1990 - Vol. 14. - P. 83-87. Beger HG, Witte С, Krautzberger W. et al. Erfahrung mit einer das duodenum erhaltenden pankreaskopfresektion bei chronischer pancreatitis. Chirurg 1980; 51: 303-7. Duval MK. Caudal pancreaticojejunostomy for chronic relapsing pancreatitis. Annals of Surgery 1954; 140: 775-85. Frey CF, Katsumi Amikura. Local resection of the head of pancreas combined with longitudinal pancreatico-jejunostomy in the management of patients with chronic pancretitis. Annals of Surgery 1994; 220(4): 492-507. Frey CF. Smith GJ. Description and rationale of a new operation for chronic pancreatitis. Pancreas 1987; 2: 701-7. Frey CF. The surgical management of chronic pancreatitis: The Frey procedure. Advances in surgery. 1999; 32: 41-85. Izbicki JR, Bloechle С, Knoefel WT, et al. Duodenum preserving resection of the head of pancreas in chronic pancreatitis. Annals of Surgery 1995; 221(4): 350-8. Izbicki JR, Bloechle С. Knoefel WT, et al. Longitudinal V shaped excision of the ventral pancreas for small duct disease in severe chronic pancreatitis. Annals of Surgery 1998; 227(2): 213-21. Partington RF, Rochelle REL. Modified Puestow procedure for retrograde drainage of the pancreatic duct. Annals of Surgery I960; 152: 1037-42. Prinz RA, 1986: Islet-cell tumors of the pancreas. Cresse et ResMedica 3:3-10. Prinz RA, et al, 1981: Clinical aspects of glucagon-producing islet cell tumors. Am J Gastroenterol 76:125-131. Prinz RA, et al, 1983: '"Non-functioning" islet cell carcinoma of the pancreas. Am Surg 49:345-349. Proye C, et al, 1998: Noninvasive imaging of insulinomas and gastrinomas with endoscopic ultrasonography and somatostatin receptor scintigraphy. Surgery 124:1134-1143. Puestow CB, Gillesby WT. Retrograde surgical drainage of pancreas for chronic pancreatitis. Archives of Surgery 1958; 76: 898-906. Rumpf KD. Pichlmayr R. Eine method zur chirurgischen behand lung der chronischen pankreatitis. Die transduodenal pancreaticoplastik. Chirurg 1983; 54: 722-7. Stabile BE, et al, 1984: The gastrinoma triangle: operative implications. Am J Surg 147:25-31. Stacpoole РW, 1981: The glucagonoma syndrome; clinical features, diagnosis, and treatment. Endocr Rev 2:347. Stefanini P, et al, 1974: Beta-islet cell tumors of the pancreas: results of a study on 1,067 cases. Surg 75:596-609. Stephens DH, 1997: CT of pancreatic neoplasms. Curr Probl Diagn Radiol 26:53-108. Thomason JW, et al, 2000: Somatostatin receptor scintigraphy: the definitive technique for characterizing vasoactive intestinal peptide-secreting tumors. Clin Nucl Med 9:661-664. Traverso LW, Longmire WP. Preservation of pylorus in pancreatico-duodenectomy. Surgery Gynecology Obstetrics 1978; 156: 954-62. Verner JV Jr, Morrison AB, 1958: Islet cell tumor and a syndrome of refractory watery diarrhea and hypokalemia. Am J Med 25:374-380. Vitas GJ, Sarr MG. Selected management of pancreatic pseudocysts: operative versus expectant management. Surgery 1992;111 : 123-130. Vortmeyer АО, et al, 2004: Non-islet origin of pancreatic islet cell tumors. J Clin Endocrinol Metab 89:1934-1938. Warren WD, Millikan W Jr, Henderson JM, et al. A denervated pancreatic flap for control of chronic pain in pancreatitis. Surgery Gynecology Obstetrics 1984; 159: 581-6. Wermers RA, et al, 1966: The glucagonoma syndrome: clinical and pathologic features in 21 patients. Medicine (Baltimore) 75:53-63. Whipple АО, Frantz VK, 1935: Adenoma of islet cells with hyperinsulinism: a review. Аnn Surg 101:1299-1335. William JF, Charles G. Child 95% distal pancreatectomy for chronic pancreatitis. Annals of Surgery Oct., 1965; 162 (4): 534-49. Wittingen J, Frey CF. Islet concentration in the head, body, tail and uncinate process of the pancreas. Annals of Surgery 1974; 179: 412-8. Yeo CJ, Bastidas JA, Lynch-Nyhan A, et at. The natural history of pancreatic pseudocysts documented with computed tomography. Surgery 1990; 170 : 411-417. Zollinger RM, Ellison EH, 1955: Primary peptic ulcerations of the jejunum associated with islet cell tumors of the pancreas. Ann Surg 142:709-723. |
