ВКР нади последний. I. Обзор литературы 5 1 Общая характеристика антиоксидантной системы растений 5
 Скачать 106.58 Kb. Скачать 106.58 Kb.
|
2.2. Результаты исследования и их обсуждение2.2.1 Совместное действие антиоксиданта амбиола и фитогормонов (ИУК и 6-БАП) на активность ферментов-антиоксидантов) в листьях растения картофеляТаблица1. Активность пероксидазы в листьях картофеля
Таким образом, мы видим, что максимальная активность у пероксидазы в листьях картофеля, который был обработан амбиолом с добавлением 6-БАП. Наименьшая антиоксидантная активность у контрольного варианта с водой. Определение содержания хлорофиллов в листе показало, что обработка регуляторами роста не оказала существенного влияния на концентрацию хлорофиллов в листе (табл.2). Вместе с тем, показано увеличение соотношения «А»/«В» под действием изучаемых регуляторов. В большей степени, в варианте с совместной обработкой амбиолом и 6-БАП.
Расчет ростовой активности доминирующего побега картофеля показал, что обработка регуляторами роста неоднозначно повлияла на данный показатель, а именно, ростовая активность существенно возросла в варианте «амбиол + ИУК» (до фазы бутонизации) (табл.3). По-видимому, это связано с содержанием свободной воды в листе и аттрагирующей ролью ауксинов (табл.1). В фазе бутонизации тенденция сохранилась. Ростовая активность побегов картофеля в вариантах с регуляторами роста оказалась выше контрольного варианта (табл.3). Таблица 3. Совместное действие амбиола и фитогормонов на ростовую активность побегов растения картофеля
В фазе бутонизации тенденция сохранилась. Ростовая активность побегов картофеля в вариантах с регуляторами роста оказалась выше контрольного варианта (табл.3). ВыводыВ ходе исследования мы установили, что: 1. Все эти растения были обогащены азотом, фосфором и калием, но мы отмечаем разницу между этими растениями, в частности растения, которые ранее были вымочены в воде, выше по высоте, но более хрупкие, в отличие от других растений, пропитанных растворами амбиола, амбиола+ИУК и амбиола+БАП, у них самые высокие ростовые показатели. 2. Все эти растения были обогащены азотом, фосфором и калием, но мы отмечаем разницу между этими растениями, в частности у растений, которые ранее были пропитаны растворами амбиола, амбиола+ИУК и амбиола+БАП имеют самые крупные клубни, чего нельзя сказать о контрольном варианте с водой. 3. Максимальная активность у пероксидазы в листьях картофеля, который был обработан амбиолом с добавлением 6-БАП. Наименьшая антиоксидантная активность у контрольного варианта с водой. ЗаключениеВ дополнение к тому, что антиоксиданты необходимы для жизнедеятельности растений, они могут принести пользу людям и хорошо. Это утверждение было поддержано множеством антиоксидантных составов, предлагаемых и доступных нам на рынках. Основными компонентами этих составов являются главным образом экстракты растений, содержащие биологически активные соединения, хорошо известные своим благоприятным эффектом. Например, было исследовано, что природные соединения могут помочь, например, в профилактике нейродегенеративных заболеваний. Кроме того, тот факт, что многие из этих антиоксидантов не могут быть синтезированы в клетках человека из-за отсутствия ферментов в первую очередь, квалифицирует их как необходимые питательные вещества для нашего населения. Обширные исследования проводятся для изучения природных соединений, которые могут обуздать или облегчить окислительный стресс и, следовательно, укрепить иммунную систему, и в настоящее время у нас растет число сторонников растительного питания. Последнее десятилетие поддерживается исследованиями потенциально полезных мягких прооксидантных эффектов. А именно, воздействие умеренных доз вредных агентов или факторов вызывает адаптивный ответ клеток, называемый гормезисом. В целом, хотя шесть десятилетий, эта мультиплексная область исследований все еще динамична и подлежит развитию благодаря приобретению более глубоких знаний и новых знаний об этой сложной сети молекул и их реакциях. Хотя определенные антиоксидантные соединения проявляют экстраординарную антиоксидантную способность in vitro, следует проводить более сложные и сложные исследования in vivo, которые будут идеально имитировать внутриклеточную среду с наличием организованной сети про‐ и антиоксидантов. Список литературыХавинсон В.Х., Баринов В.А., Арутюнян А.В., Малинин В.В. Свободнорадикальное окисление и старение. СПб., 2003. 327 с. Заявка 2003132741/13, РФ. Способ определения интегральной антиоксидантной емкости продуктов питания и напитков / Г.К. Будников, Н.Н. Чернышева, Г.К. Зиятдинова., А.А. Лапин. Опубл. 27.04.2005. Бюл. №12. Общие методы анализа. Лекарственное сырье. Настои и отвары // Государственная фармакопея СССР. 11-е изд. Вып. 2. М., 1990. С. 147. Пат. № 2277099, РФ. Способ получения водорастворимого лигнина / А.П. Карманов, Л.С. Кочева, М.Ф. Борисенков, С.В. Загирова. Опубл. 27.05.2006. Бюл. №15. Лапин А.А., Герасимов М.К., Михайлова А.В. Методологические подходы к созданию геропрофилактических продуктов. Вино // Проблемы геронтологии и гериатрии-2004: Мат. 2-й Республ. науч.-практ. конф. с междунар. участием. Сыктывкар, 2004. С. 64–67. Лапин А.А., Герасимов М.К., Борисенков М.Ф., Портнов И.Ю., Жарковский А.П. Методологические подходы к созданию геропрофилактических продуктов. Бальзамы // Проблемы геронтологии и гериатрии-2004: Мат. 2-й Республ. науч.-практ. конф. с междунар. участием. Сыктывкар, 2004. С. 62–64. Лапин А.А., Герасимов М.К., Борисенков М.Ф., Портнов И.Ю., Жарковский А.П. Изучение антиоксидантных свойств пива // Проблемы геронтологии и гериатрии-2004: Мат. 2-й Республ. науч.-практ. конф. с междунар. участием. Сыктывкар, 2004. С. 67–70. Кочева Л.С., Карманов А.П., Борисенков М.Ф. Антиоксиданты на основе лигнина // Физикохимия лигнина: Мат. междунар. конф. Архангельск, 2005. С. 56–60. Борисенков М.Ф., Карманов А.П., Кочева Л.С. Физиологическая роль лигнинов // Успехи геронтологии. 2005. Вып. 17. С. 34–41. Дудкин М.С., Казанская И.С., Базилевский А.С. Пищевые волокна (Обзор) // Химия древесины. 1984. №2. С. 3–14. 11. Карманов А.П. Самоорганизация и структурная организация лигнина. Екатеринбург, 2004. 270 с. Wegener, C.B.; Jansen, G.; Jürgens, H.U.; Schütze, W. Special quality traits of coloured potato breeding clones: Anthocyanins, soluble phenols and antioxidant capacity. J. Sci. Food Agric. 2008, 89, 206–215. Wang, H.; Cao, G.; Prior, R.L. Oxygen radical absorbing capacity of anthocyanins. J. Agric. Food Chem. 1997, 45, 304–309. Wegener, C.B.; Jansen, G. Antioxidant capacity in cultivated and wild Solanum species: The effect of wound stress. Food Funct. 2010, 1, 209–218. Grace, S.C. Phenolics as Antioxidants. In Antioxidants and Rreactive Oxygen Species; Smirnoff, N., Ed.; Blackwall Publishing Ltd.: Oxford, UK, 2005; pp. 141–168. Vinson, J.A.; Demkosky, C.A.; Navarre, D.A.; Smyda, M.A. High-antioxidant potatoes: Acute in vivo antioxidant source and hypotensive agent in humans after supplementation to hypertensive subjects. J. Agric. Food Chem. 2012, 60, 6749–6754. Dixon, R.A.; Paiva, N.L. Stress induced phenylpropanoid metabolism. Plant Cell 1995, 7, 1085–1097. Bohnert, H.J.; Nelson, D.E.; Jensen, R.G. Adaptations to environmental stress. Plant Cell 1995, 7, 1099–1111. Heldt, H.W. Photosynthesis is Associated with Water Consumption. In Plant Biochemistry; Heldt, H.W., Ed.; Spektrum Akademischer Verlag: Berlin, Germany, 2003; pp. 221–251. Van Loon, C.D. The effect of water stress on potato growth, development and yield. Am. Potato J. 1981, 58, 51–69. Levy, D. The response of potatoes to a single transient heat or drought stress imposed at different stages of tuber growth. Potato Res. 1985, 28, 415–424. Vayda, M.E. Environmental Stress and Its Impact on Tuber Yield. In Potato Genetics; Bradshaw, J.E., Mackay, G.R., Eds.; CAB International: Wallingford, UK, 1994; pp. 239–261. Hooper, L.; Cassidy, A. A review of the health care potential of bioactive compounds. J. Agric. Food Chem. 2006, 86, 1805–1813. Rice-Evans, C.A.; Miller, N.J.; Paganga, G. Antioxidant properties of phenolic compounds. Trends Plant Sci. 1997, 2, 152–159. Chalker-Scott, L. Environmental significance of anthocyanins in plant stress responses. Photochem. Phytobiol. 1999, 70, 1–9. Camm, E.L.; McCallum, J.; Leaf, E.; Koupai-Abyazani, M.R. Cold induced purpling of Pinus contorta seedlings depend on previous day length treatment. Plant Cell Environ. 1993, 16, 761–764. Hammerschmidt, R.; Nuckles, E.M.; Kuc, J. Association of enhanced peroxidase activity with systemic resistance of cucumber to Colletotrichum lagenarium. Physiol. Plant Pathol. 1982, 20, 73–82. Borchert, R. Time course of spatial distribution of phenylalanine ammonia-lyase and peroxidase activity in wounded potato tuber tissue. Plant Physiol. 1978, 62, 789–793. Espelie, K.E.; Franceschi, V.R.; Kolattukudy, P.E. Immocytochemical localization and time course of appearance of an anionic peroxidase associated with suberization in wound-healing potato tuber tissue. Plant Physiol. 1986, 81, 487–492. Cevahier, G.; Yentür, S.; Yazgan, M.; Ünal, M.; Yilmazer, N. Peroxidase activity in relation to anthocyanin and chlorophyll content in juvenile and adult leaves of “MINI-STAR” Gazania splendens. Pak. J. Bot. 2004, 36, 603–609. Reyes, L.F.; Cisneros-Zevallos, L. Wounding stress increases the phenolic content and antioxidant capacity of purple-flesh potatoes (Solanum tuberosum L.). J. Agric. Food Chem. 2003, 51, 5296–5300. Chen, J.H.; Ho, C.T. Antioxidant activities of caffeic acid and its related hydroxycinnamic acid compounds. J. Agric. Food Chem. 1997, 45, 2374–2378. Tudela, J.A.; Cantos, E.; Espin, J.C.; Tomas-Barberan, F.A.; Gil, M.I. Induction of antioxidant flavonol biosynthesis in fresh-cut potatoes: Effect of domestic cooking. J. Agric. Food Chem. 2002, 50, 5925–5931. Ghanekar, A.S.; Padwal-Desai, S.R.; Nadkarni, G.B. The involvement of phenolics and phytoalexins in resistance of potato to soft rot. Potato Res. 1984, 27, 189–199. Vance, C.P.; Kirk, T.K.; Sherwood, R.T. Lignification as a mechanism of disease resistance. Ann. Rev. Phytopathol. 1980, 18, 259–288. Lulai, E.C. Tuber Periderm and Disease Resistance. In Compendium of Potato Diseases; Stevenson, W.R., Loria, R., Franc, G.D., Weingartner, D.P., Eds.; APS Press: St. Paul, MN, USA, 2001; pp. 3–6. Meier, U. Growth stages of mono- and dicotyledonous plants. In BBC—Monograph; Meier, U., Ed.; Blackwall Publishing Ltd.: Berlin, Germany, 1997; p. 48. Fuleki, T.; Francis, F.J. Quantitative methods for anthocyanins. 1. Extraction and determination of total anthocyanins in cranberries. J. Food Sci. 1968, 33, 72–77. Bi, J.L.; Felton, G.W.; Murphy, J.B.; Howles, P.A.; Dixon, R.A.; Lamb, C.J. Do plant phenolics confer resistance to specialist and generalist insect herbivores? J. Agric. Food Chem. 1997, 45, 4500–4504. Popov, I.N.; Lewin, G. Photochemiluminescent detection of antiradical activity: IV. Testing of lipid-soluble antioxidants. J. Biochem. Biophys. Methods 1996, 31, 1–8. Buckenhüskes, H.J. Nutritionally relevant aspects of potatoes and potato constituents. In Potato in Progress; Haverkort, A.J., Struik, P.C., Eds.; Academic Publishers: Wageningen, The Netherlands, 2005; pp. 17–26. Jansen, G.; Flamme, W.; Schüler, K.; Vandrey, M. Tuber and starch quality of wild and cultivated potato species and cultivars. Potato Res. 2001, 44, 137–146. Приложение 1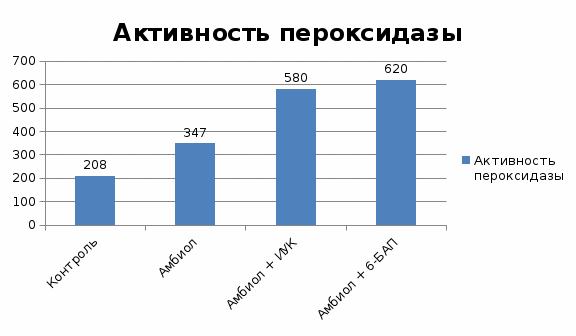 Рисунок 1. Активность пероксидазы в листьях картофеля |
