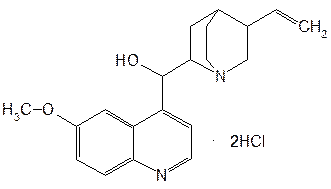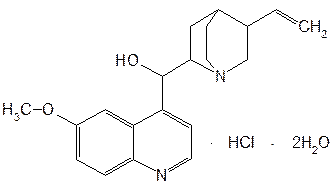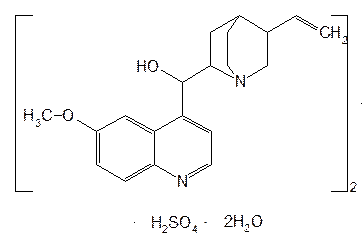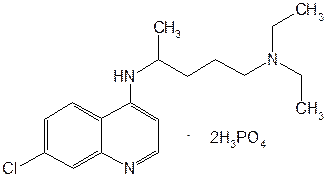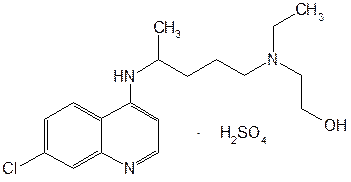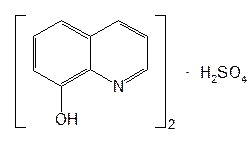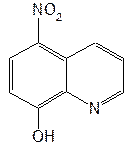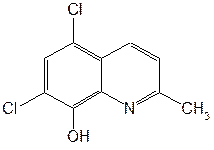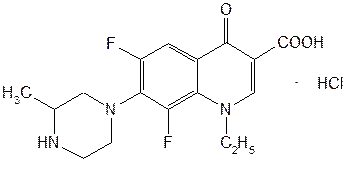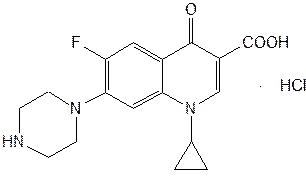КУРСОВАЯ РАБОТА.doc1. И. С. Тургенева Медицинский институт Кафедра общей, биологической фармацевтической химии и фармакогнозии Ламтюгина Елена Владимировна 4 курс, специальность фармация курсовая
 Скачать 350.5 Kb. Скачать 350.5 Kb.
|
|
Министерство образования Российской Федерации ФГБОУ ВПО « Орловский государственный университет имени И.С. Тургенева » Медицинский институт Кафедра общей, биологической фармацевтической химии и фармакогнозии Ламтюгина Елена Владимировна 4 курс, специальность: фармация КУРСОВАЯ РАБОТА (Определение лекарственных средств производных хинолина с применением физико-химических методов) Руководитель: Семенова Екатерина Сергеевна Г. Орёл 2016 Оглавление Введение………………………………………………………………………….4 1.Производные хинолина…………………...……………………………….…..5 1.1Производные инхонана..……………………………………………….……6 1.2Производные 4-аминохилина………...……………………………….......11 1.3Производные 8-оксихинолина…………………………………….……...13 1.4Фторхинолоны………...………….……………………………………….17 2.Заключение……………………………………...………………………….…18 3.Приложения……………………………………………………………..……20 Основные обозначения и сокращения ГЖХ – газо-жидкостная хроматография ИК - инфракрасная спектрофотометрия УФ - ультрафиолетовая спектрофотометрия ТСХ – тонкослойная хроматография ВЭЖХ – высокоэффективная жидкостная хроматография ФС – фармакопейная статья Введение Фармацевтическая химия – наука, изучающая способы получения, физические и химические свойства, методы контроля качества лекарственных веществ, влияние отдельных особенностей строения молекул лекарственных веществ на характер действия их на организм, изменения, происходящие при их хранении. Решение задач, стоящих перед фармацевтической химией поможет выявить новые свойства уже имеющихся лекарственных препаратов и открыть новые. Бронхиальная астма, сахарный диабет, СПИД, рак – это неполный перечень заболеваний для которых так и не найдены альтернативные препараты, помогающие полностью излечить их. Задачей здравоохранения является найти лекарственные препараты для излечения этих болезней. Хинолин − содержится в молекуле алкалода хинного дерева хинина. В коре хинного дерева кроме хинина содержится еще около 30 алкалоидов. В 1792 г. А.Ф. Фуркруа (Fourcroy) и в 1809 г. Л.Н. Воклен (Vauqelin) ввели в медицинскую практику препарат “хина”, являющийся суммой неочищенных алкалоидов коры хинного дерева. В 1842 г. Ш.Ф. Жерар (Gerhardt) получает хинолин при гидролизе хинина. Истинную структуру хинина установили Кениг (Коnig) и З.Х. Скрауп (Skraup) в 1880 г. Химическая структура хинина выяснена в 1907 г., а полный синтез осуществлён 1945 г. американскими учёными Вудвордом и Дерингом. Крупные исследования в области изучения химической структуры хинина и получения его синтетических аналогов были выполнены во ВНИХФИ в 1929-1950 гг. М.В. Рубцовым, О.Ю. Магидсоном и др. После установления структуры хинина, был проведен ряд целенаправленных синтезов противомалярийных, антибактериальных и др. лекарственных средств. Производные хинолина Большинство лекарственных веществ производных хинолина можно разделить на следующие группы:
Структурной основой большинства алкалоидов, содержащихся в хинной корке, служат две гетероциклические системы: хинолин (конденсированное ядро пиридина и бензола) и хинуклидин (конденсированная система, состоящая из двух пиперидиновых циклов): (рис.1) В молекуле хинина эти два цикла связаны между собой карбинольной группой –CH(OH)–. Общая формула алкалоидов хинной корки: (рис. 2) Алкалоиды отличаются друг от друга радикалами R1 и R2 (табл.1). Фармакологическая активность алкалоидов хинной корки находится в зависимости как от химической структуры, так и от оптической изомерии. Применяемые в медицинской практике алкалоиды хинин и хинидин едины по химическому строению. Оба представляют собой 6’-метоксихинолил-(4’)-[5-винилхинуклидил-(2)]-карбинол, но являются оптическими антиподами. ПРОИЗВОДНЫЕ ЦИНХОНАНА Гетероциклическая система цинхонана лежит в основе химического строения хинина и его оптического изомера хинидина. Цинхонан состоит из хинолинового ядра,связанного через метиленовый мостик с хинуклидиновым ядром, имеющим винильную группу. Хинуклидиновый фрагмент содержит три асимметрических углеродных атома. (рис.3) Хинин (и его правовращающий изомер хинидин) является 9-Окси-6’- метоксицинхонаном. У хинина появляется четвертый асимметричный атом углерода. Препараты хинина применяются в качестве антималярийных, антипиретических лекарственных средств. Хинин оказывает разностороннее влияние на организм. Местное действие проявляется в раздражении тканей: при подкожном введении растворы солей хинина могут вызывать болевые ощущения, а иногда и некротические изменения. Резорбтивное действие проявляется в первую очередь изменением состояния центральной нервной системы, сердечно-сосудистой системы, мускулатуры матки. Хинин может вызывать угнетение центральной нервной системы, состояние оглушения, звон в ушах, головную боль, головокружение; в больших дозах — нарушение зрения, а иногда потерю сознания. Хинин угнетает терморегулирующие центры и понижает температуру при лихорадочных заболеваниях; понижает возбудимость сердечной мышцы, удлиняет рефрактерный период и несколько уменьшает ее сократительную способность; возбуждает мускулатуру матки и усиливает ее сокращения, сокращает селезенку. Характерной особенностью хинина является его способность угнетать жизнедеятельность эритроцитарных форм малярийных плазмодиев. Хинин быстро всасывается и быстро выводится из организма. Хинин является двукислотным основанием и, поэтому, может образовывать одно- и дву- замещенные соли. Соли, содержащие два эквивалента кислоты, в растворах подвергаются гидролизу и показывают кислую реакцию. Более выраженным центром основности является ядро хинуклидина, где неподеленная пара электронов локализована на CH гетероатоме азота. (рис.4) В медицине применяют соли хинина: хинина дигидрохлорид, хинина гидрохлорид и хинина сульфат (табл.2). Источник их получения — хинная корка. Поскольку в растительном сырье алкалоиды содержатся в виде солей хинной кислоты, измельченную хинную корку обрабатывают известковым молоком в смеси со щелочью. Образовавшиеся основания извлекают бензолом, получая сумму алкалоидов. Хинин отделяют в виде малорастворимого сульфата. Остальные алкалоиды разделяют с помощью ионообменной хроматографии. Хинина сульфат очищают перекристаллизацией и переводят вновь в основание. Из основания получают хинина дигидрохлорид и гидрохлорид. По физическим свойствам соли хинина представляют собой бесцветные кристаллические вещества, без запаха, отличающиеся очень горьким вкусом. Под действием света постепенно желтеют. Все они являются левовращающими оптическими изомерами (табл.2). Соли хинина различаются по растворимости в воде: дигидрохлорид — очень легко растворим, гидрохлорид — растворим, а сульфат — мало растворим в воде. Хинина гидрохлорид лучше, чем сульфат и дигидрохлорид, растворим в этаноле и хлороформе. Хинина сульфат можно отличить от гидрохлорида и дигидрохлорида не только по растворимости в воде, но и с помощью химических реакций на хлорид- и сульфат-ионы. Для испытания на подлинность используют УФ-спектрофотометрию. Растворы в этаноле хинина гидрохлорида и хинина сульфата имеют максимумы поглощения при 234, 278 и 331 нм, а в 0,1 М растворе хлороводородной кислоты — при 318 и 347 нм. Используемые для испытаний солей хинина химические реакции основаны на наличии восстановительных, кислотно-основных свойств, третичных атомов азота в молекулах и связанных с основаниями алкалоидов минеральных кислот. Общей реакцией на хинин является так называемая талейохинная проба. Она заключается в окислении хинина бромной водой до образования бесцветного раствора орто-хинона. Последующее действие раствором аммиака приводит к образованию дииминопроизводных орто-хиноидной структуры, окрашенных в изумрудно-зеленый цвет: (рис.5) Алкалоиды хинной корки, не содержащие в молекуле метоксильной группы, этой реакции не дают. Характерной особенностью хинина является наличие голубой флуоресценции в растворах серной кислоты. В присутствии окислителей цвет флуоресценции изменяется. Так, например, при действии насыщенным раствором бромной воды образуется желто-зеленая флуоресценция. Флуоресцентные реакции происходят и при воздействии на соли хинина и хинидина другими окислителями (концентрированных серной и азотной кислот, пероксида водорода, периодата калия) в различных растворителях (воде, этаноле, диоксане, диметилформамиде). Для идентификации солей хинина можно использовать осадительные (общеалкалоидные) реактивы на органические основания: пикриновую кислоту, дихлорид ртути, танин, фосфорновольфрамовую кислоту. Подкисленный серной кислотой раствор хинина в этаноле при взаимодействии со спиртовым раствором иода образует характерные (в виде листочков) зеленые кристаллы герепатита: (Ф.1) Наличие метоксильной группы в молекуле хинина можно обнаружить сплавлением с перекисью бензоила. Образуется формальдегид, который под действием хромотроповой кислоты в присутствии концентрированной серной кислоты приобретает фиолетовое окрашивание. Количественное определение солей хинина выполняют гравиметрическим методом. Он основан на осаждении основания хинина из солей (раствором гидроксида натрия), четырехкратном извлечении его хлороформом и взвешивании остатка, полученного после отгонки хлороформа. Определить содержание солей хинина можно также методом нейтрализации 0,1 М раствором гидроксида натрия в смеси этанола и хлороформа (индикатор фенолфталеин). Оба способа основаны на реакции нейтрализации солей, например хинина сульфата: (Ф.2) МФ рекомендует для определения солей хинина метод неводного титрования в смеси ледяной уксусной кислоты и уксусного ангидрида (50:20). При определении хинина гидрохлорида и дигидрохлорида прибавляют раствор ацетата ртути в ледяной уксусной кислоте и титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый). Известен метод бромид-броматометрического определения хинина гидрохлорида. В присутствии концентрированной хлороводородной кислоты и бромида калия титруют 0,1 М раствором бромата калия до устойчивой желтой окраски. Соли хинина определяют иодометрическим методом, основанным на образовании полииодида в среде насыщенного раствора хлорида натрия, а хинина гидрохлорид и хинина сульфат — спектрофотометрическим методом (растворитель этанол или 0,1 М раствор хлороводородной кислоты). Выделенное из солей (хлороформом с этанолом 2:1) основание хинина определяют флуориметрическим методом. Для этого растворитель отгоняют, остаток растворяют в 0,1 М серной кислоте и измеряют при 430 нм интенсивность флуоресценции. Показана возможность использования метода ГЖХ для качественного и количественного анализа хинина гидрохлорида путем прямого хроматографирования. Качественную оценку проводят, устанавливая величину отношения его времени удерживания к внутреннему стандарту (2,22 отн. ед.). Количественное определение выполняют методом внутреннего стандарта. Соли хинина хранят в хорошо укупоренной таре, предохраняющей от действия света, так как под его влиянием хинин постепенно разлагается, приобретая желтое окрашивание. Применяют соли хинина в качестве противомалярийных средств. Назначают хинина сульфат и гидрохлорид внутрь по 1,0–2,0 г в сутки, а хинина дигидрохлорид — для парентерального введения по 1–2 мл 25–50%-ного раствора. Правовращающим оптическим изомером хинина является сопутствующий ему в хинной корке алкалоид хинидин, который в виде сульфата (Quinidine Sulfate) применяют в медицинской практике. По фармакологическим свойствам близок к хинину, но оказывает более сильное противоаритмическое действие. Действие хинидина частично связано с угнетением окислительных процессов в сердце. Имеются указания на то, что антиаритмическое действие хинидина (так же как новокаинамида) связано с изменением обмена электролитов в миокарде. Обнаружено также, что под влиянием хинидина меняется обмен ацетилхолина в мышце сердца. Хинидин оказывает местноанестезирующее и сосудорасширяющее действие; блокирует передачу возбуждения в окончаниях сердечных волокон блуждающего нерва; может вызвать учащение сокращений желудочков сердца. Обладает относительно высокой токсичностью; должен применяться с особёй осторожностью при значительном повреждении миокарда. По внешнему виду хинидина сульфат и хинина сульфат идентичны. Хинидина сульфат умеренно растворим в воде, растворим в этаноле и хлороформе. В медицинской практике применяют хинидина сульфат: белый кристаллический порошок. Для испытаний хинидина сульфата используют те же методы и химические реакции, что и для оценки качества хинина сульфата. Небольшое различие имеется в ИК-спектрах. У хинина характерные полосы наблюдаются при 1235 и 1030 см–1, а у хинидина — при 1262 и 1040 см–1. Удельное вращение 2%-ного раствора хинидина в 0,1М растворе хлороводородной кислоты в отличие от солей хинина находится в пределах от +275 до +290°. Соли хинина и хинидина с солями алюминия в водной среде образуют голубую флуоресценцию с максимумом излучения 450 нм. Реакция обусловлена образованием комплексов иона алюминия с хинином или хинидином за счет свободных электронных пар гетероатомов азота и гидроксильной группы. Известны цветные реакции, позволяющие отличать хинин от хинидина. Так, если одну каплю спиртового подкисленного серной кислотой раствора нанести на фильтровальную бумагу и в течение 30 сек обрабатывать парами иода, то в присутствии хинина появляется серовато-синее пятно с темно-желтым ободком, а в присутствии хинидина — темно-желтое пятно. Хинин и хинидин могут быть разделены методом ТСХ на пластинках с силикагелем в системе растворителей хлороформ–ацетон–диэтиламин (5:4:1). В качестве проявителя используют разведенную серную кислоту, после чего в УФ-свете обнаруживаются пятна с синей флуоресценцией. Значения Rf хинина и хинидина соответственно равны 0,19 и 0,33. Известна методика титриметрического определения сульфатов хинина и хинидина в неводной среде. Вначале избытком перхлората бария осаждают сульфат ионы в среде уксусной кислоты. Затем титруют основания хинина или хинидина в системе диоксан — уксусная кислота (2:1) раствором хлорной кислоты в безводной уксусной кислоте (индикатор кристаллический фиолетовый). Количественное определение хинидина выполняют также методом неводного титрования, растворяя навеску в смеси хлороформа и уксусного ангидрида. Титрантом служит хлорная кислота, а эквивалентную точку устанавливают потенциометрическим методом. Определить содержание хинидина сульфата можно также методом ВЭЖХ на обращенных фазах с применением флуоресцентного детектора. Время удерживания хинидина составляет 5,6 мин. Оно отличается от времени удерживания дигидрохинина (6,5 мин), примесь которого в хинидине часто встречается и составляет 10–15%. Расчет содержания выполняют с помощью метода абсолютной калибровки. Хранят хинидина сульфат в хорошо укупоренной таре, предохраняющей от действия света. Назначают при различных видах аритмий в виде таблеток по 0,1 и 0,2 г, как антиаритмическое средство продленного действия. Производные 4-аминохинолина Из числа производных 4-аминохинолина применяют лекарственные вещества хлорохина фосфат (хингамин) и гидроксихлорохина сульфат (плаквенил) (табл.3). Хингамин применяется, главным образом, для лечения малярии, а трихомонацид − для лечения трихомонадоза и других протозойных инфекций. Общий принцип их синтеза основан на предварительном получении ядра хинолина, содержащего метоксигpуппу или атом хлора. Затем к этому ядру присоединяют радикал диэтиламиноалкиламина и превращают органическое основание в соль. Рассмотрим в качестве примера общую схему синтеза хлорохина фосфата: (Рис. 6) Сходство химической структуры обуславливает общность физических и химических свойств (табл. 3) хлорохина фосфата и гидроксихлорохина сульфата. Это белые кристаллические вещества горького вкуса, легко растворимые в воде и очень мало (хлорохина фосфат) или практически нерастворимые (гидроксихлорохина сульфат) в органических растворителях: этаноле, эфире, хлороформе. Водные растворы имеют кислую реакцию (pH 3,5-4,5). Гидроксихлорохина сульфат от хлорохина фосфата отличается наличием двух полиморфных структур, которые имеют различные температуры плавления: 198 и 240 °C. Хлорохина фосфат имеет в УФ-области (240-360 нм) три максимума поглощения: при 257, 329, 343 нм (0,001%-ный раствор в 0,01 М растворе хлороводородной кислоты) с оптическими плотностями около 0,29, 0,32 и 0,37. Отношения этих значений при 257 и 329 нм к поглощению при 343 нм должно быть в пределах 0,86-0,95. Известен ряд реакций осаждения, с помощью которых можно подтвердить подлинность хлорохина фосфата и гидроксихлорохина сульфата. Из растворов солей под действием щелочей выпадают осадки оснований. Отличить их друг от друга можно, выполняя соответственно реакции на сульфат- (с растворимой солью бария) и фосфат-ионы (с раствором молибдата аммония). Являясь азотсодержащими органическими основаниями, они дают положительные реакции с осадительными (общеалкалоидными) реактивами: Вагнера, Майера, Драгендорфа. С пикриновой кислотой образуют пикраты (осадки желтого цвета). Пикрат хлорохина фосфата имеет температуру плавления 204-207 °C. С 5%-ным раствором дихромата калия производные 4-аминохинолина образуют оранжевые осадки. Испытание на подлинность и количественное определение гидроксихлорохина сульфата выполняют методом ВЭЖХ. Время удерживания основного пика у испытуемого и стандартного растворов должно быть идентичным. Расчет количественного содержания выполняют по площадям пиков. Количественное определение хлорохина фосфата выполняют методом неводного титрования. МФ рекомендует использовать в качестве растворителя ледяную уксусную кислоту (при нагревании с обратным холодильником) и диоксан. Титрант — 0,1 М раствор хлорной кислоты. Индикатор кристаллический фиолетовый — при визуальном или каломельный электрод — при потенциометрическом установлении конечной точки титрования. По ФС хлорохина фосфат определяют в среде только ледяной уксусной кислоты, используя тот же титрант и индикатор. Фармакопея США рекомендует для количественного определения гидроксихлорохина сульфата спектрофотометрию в УФ-области. Измерение выполняют при длине волны 343 нм относительно растворителя — хлороводородной кислоты (1:100). Расчёты проводят по стандартному образцу. Хранят хлорохина фосфат и гидроксихлорохина сульфат по списку Б, в хорошо укупоренной таре оранжевого стекла, предохраняющей от действия света. Они постепенно окрашиваются на свету. Хлорохина фосфат и гидроксихлорохина сульфат — эффективные антипротозойные и иммунодепрессивные средства. Оказывают лечебное и профилактическое противомалярийное действие как на бесполые, так и на половые формы малярийных плазмодиев. Назначают также при лечении артритов, красной волчанки и др. Выпускают хлорохина фосфат в таблетках по 0,25 г и в виде 5%-ного раствора в ампулах по 5 мл для инъекций, а гидроксихлорохина сульфат в таблетках по 0,2 г. Производные 8-оксихинолина В качестве антисептических средств применяют хинозол, нитроксолин, хлорхинальдол (табл. 4). Для синтеза хинозола в качестве исходного продукта берут фенол, из которого последовательно получают вначале o-нитрофенол, а затем o-аминофенол. Последний по методу Скраупа сочетают с акролеином. Происходит образование 8-оксидигидрохинолина, который в результате окисления нитробензолом переходит в 8-оксихинолин. Из него получают хинозол, действуя разведенной серной кислотой: (Рис. 7) Нитроксолин синтезируют методом, разработанным в филиале ВНИХФИ (пос. Купавна) из 8-оксихинолина путем нитрозирования с последующим окислением нитрозо-группы до нитрогруппы: (Рис.8) По физическим свойствам указанные три лекарственные вещества представляют собой мелкокристаллические порошки, имеющие окраску (лимонно-желтую, желтую, оранжево-кремовую) и своеобразный запах (табл. 4). Хлорхинальдол может существовать в двух полимерных модификациях, отличающихся температурами плавления. Производные 8-оксихинолина различаются по растворимости. Хинозол легко растворим в воде и этаноле, практически нерастворим в эфире и хлороформе. Нитроксолин и хлорхинальдол практически нерастворимы в воде, мало растворимы в этаноле. Нитроксолин мало растворим в эфире и умеренно растворим в хлороформе. Хлорхинальдол умеренно растворим в ацетоне. Для испытания подлинности используют УФ-спектры. Раствор хинозола в 0,1 М хлороводородной кислоте в области 220-270 нм должен иметь максимум поглощения при 252 нм, а в области 270-400 нм — максимумы при 308, 320 и 360 нм. УФ-спектр 0,0005%-ного раствора нитроксолина в смеси этанол-буферный раствор с pH 9,18 (98:2) в области 220-500 нм имеет максимумы поглощения при 249, 341, 452,5 нм и два плеча — от 228 до 238 нм и от 258 до 268 нм. Растворы хлорхинальдола в хлороводородной кислоте (различной концентрации) имеют максимумы поглощения в области 290-450 нм при 330, 357 нм и плечо при 318 нм, а в области 220-290 нм — один максимум при 263 нм. Используемые для испытаний производных 8-оксихинолина химические реакции основаны на наличии в молекулах фенольных гидроксилов и нитрогруппы (реакции азосочетания, комплексообразования, окисления), третичного атома азота (реакция осаждения), связанной серной кислоты (кислотно-основные свойства). Поскольку все три лекарственных вещества имеют в молекулах фенольные гидроксилы, для испытания их подлинности ФС рекомендует общую цветную реакцию с раствором хлорида железа (III). Растворы (водные, спиртовые или ацетоновые) приобретают зеленое окрашивание различной интенсивности. Наличие фенольного гидроксила в молекуле хинозола позволяет получать окрашенные азосоединения с диазореактивом или с диазотированными первичными ароматическими аминами. Эту реакцию используют как для идентификации, так и для фотоколориметрического определения хинозола в лекарственных формах (Н.И.Кpикова). После гидрирования нитрогруппы в молекуле нитроксолина до ароматической аминогруппы, выполняют реакцию диазотирования и азосочетания со щелочным раствором β-нафтола. Появляется красно-оранжевое окрашивание. Наличие нитрогруппы в молекуле нитроксалина можно подтвердить реакцией с дифениламином в присутствии концентрированной серной кислоты (синее окрашивание) и по образованию ацисоли с раствором гидроксида натрия (красно-оранжевое окрашивание). Если нагреть хинозол в растворе лимонной кислоты и уксусном ангидриде, то появляется пурпурно-красное окрашивание (реакция на третичный атом азота). Присутствие третичного азота в хинолиновом ядре обусловливает положительные реакции хинозола с осадительными(общеалкалоидными) реактивами: Вагнера, Майера, Драгендорфа, раствором пикриновой кислоты, а также с раствором дихромата калия (желтый осадок). Хинозол и нитроксалин образуют окрашенные внутрикомплексные соединения с катионами металлов: магния, кадмия, меди (II), цинка, алюминия. При нагревании хинозола с хлороформом и раствором гидроксида натрия появляется быстро исчезающая зеленая окраска. Хинозол и другие производные 8-оксихинолина в присутствии цинковой пыли и разведенной хлороводородной кислоты гидрируются в дигидропроизводные. Последующее добавление к фильтрату нескольких капель пергидроля или бромной воды приводит к постепенному появлению красно-фиолетового окрашивания вследствие образования соединения хиноидной структуры: (Рис. 9) Прибавление одной капли раствора сульфата меди ускоряет эту реакцию. С ее помощью можно отличать производные 8-оксихинолина от производных цинхониновой кислоты и 8-аминохинолина, которые не образуют в этих условиях окрашенных продуктов. Нитроксолин дает эту реакцию сразу, без добавления сульфата меди. Сульфат-ион в хинозоле открывают с помощью раствора хлорида бария. При действии на раствор хинозола раствором карбоната натрия выпадает в осадок 8-оксихинолин: (Рис. 10) Если карбонат натрия взят в избытке, то он гидролизуется и осадок растворяется вследствие образования растворимого в воде 8-оксихинолината натрия: (Ф.3), (Рис. 11) При испытании на чистоту методом ТСХ на пластинках Силуфол УФ-254 устанавливают наличие в нитроксолине примеси промежуточного продукта синтеза — 5-нитрозо-8-оксихинолина. Пластинку предварительно пропитывают насыщенным раствором трилона Б и размечают по методу «клиновидных полос». Водные растворы хинозола имеют кислую реакцию (рH 5%-ного раствора 2,4–3,4) ввиду наличия связанной серной кислоты. Это позволяет выполнять количественное определение методом нейтрализации связанной серной кислоты 0,1 М раствором гидроксида натрия (индикатор фенолфталеин). Титрование ведут в присутствии хлороформа, который добавляют для извлечения выделяющегося основания хинозола (8-оксихинолина): (Рис. 12) Хинозол количественно определяют обратным комплексонометрическим методом (после перевода в основание). Основание растворяют в этаноле при нагревании до 60°C, осаждают избытком 0,1 М раствора сульфата цинка и добавляют буферный раствор (рH 10). Осадок растворяют в хлороформе, прибавляют воду и оттитровывают избыток сульфата цинка 0,1 М раствором трилона Б (индикатор эриохром черный Т). Обратный броматометрический метод определения хинозола основан на образовании 7-бромпроизводного. Избыток 0,1 М раствора бромата калия в присутствии бромида калия устанавливают иодометрическим методом: (Ф.4), (Рис. 13), (Ф.5,Ф. 6) Нитроксолин и хлорхинальдол количественно определяют методом неводного титрования, используя в качестве растворителя уксусный ангидрид и титранта — 0,1 М раствор хлорной кислоты. Определение нитроксолина выполняют в присутствии муравьиной кислоты и индикатора малахитового зеленого, а определение хлорхинальдола проводят с индикатором кристаллическим фиолетовым. Хранят лекарственные вещества в сухом, защищенном от света месте, в хорошо укупоренной таре. Нитроксолин и хлорхинальдол хранят по списку Б. Производные 8-оксихинолина относятся к числу антибактериальных лекарственных средств. Хинозол обладает антисептическими и сперматоцидными свойствами. В разведении 1:1000-1:2000 его используют для дезинфекции рук, промываний, спринцеваний. Он входит в состав мазей, присыпок. Нитроксолин применяют как противомикробное средство для профилактики и лечения инфекций мочеполовых путей внутрь в виде таблеток по 0,05 г. Хлорхинальдол обладает антибактериальной, противогрибковой и антипротозойной активностью. Применяют его внутрь в виде таблеток по 0,1 г при кишечных инфекционных заболеваниях. Фторхинолоны Высокая антибактериальная активность производных 8-оксихинолина побудила ученых к проведению исследований в ряду хинолона-4. Среди них были найдены соединения с широким спектром антибактериального действия. Особенно активными оказались фторхинолоны — кислоты, содержащие в положении 7 хинолонового ядра свободный или замещенный пиперазиновый цикл, а в положении 6 — атом фтора: (Рис. 14) Создание в 80-х годах 20 века фторхинолонов — высокоэффективных синтетических антибактериальных средств, равных по своей активности современным антибиотикам — явилось крупным достижением. Равным ему можно считать создание сульфаниламидов. Установлена взаимосвязь структуры хинолонов с фармакологическим действием, заключающаяся в следующем:
Производные хинолона-4 делят на четыре поколения. К I поколению относят нефторированные хинолоны: налидиксовую, оксолиновую и пипемидиновую кислоты. Они потеряли свое значение после создания, имеющих значительные преимущества перед ними, фторхинолонов (II поколение): ципрофлоксацина, норфлоксацина, офлоксацина, пефлоксацина, ломефлоксацина, у которых спектр активности значительно шире. К хинолонам III поколения относится левофлоксацин — левовращающий изомер офлоксацина, так называемый «респираторный» хинолон, имеющий более высокую активность в отношении пневмококков, чем у II поколения. Хинолоном IV поколения является моксифлоксацин (респираторный и антианаэробный хинолон). Он превосходит хинолоны II поколения по активности в отношении пневмококков и хорошо действует на неспорообразующие анаэробы. Из большого числа полученных в последние годы фторхинолонов наиболее широко применяют ломефлоксацина гидрохлорид, ципрофлоксацина гидрохлорид и офлоксацин (табл. 5). Исходными продуктами синтеза ломефлоксацина являются тригалогенанилин и этоксиметиленмалонат. При их конденсации образуется имин, который циклизуют в смеси таутомерных хинолинов. Затем последовательно алкилируют (бромэтилом) хинолин, гидролизуют эфирную группу и замещают атом хлора метилпиперазиновым радикалом: (Рис.15) На эффективность фармакологического действия фторхинолонов оказывают влияние особенности их химической структуры. Наличие в молекуле фторхинолона (ломефлоксацин) двух атомов фтора (в положении 6 и 8) способствует более активному и длительному действию. Так, ломефлоксацин медленнее выводится из организма и поэтому достаточен одноразовый прием его в сутки. Циклопентильный радикал в положении 1 хинолинового ядра у ципрофлоксацина привел к повышению в 3-8 раз его активности. Поэтому он быстро нашел наиболее широкое применение в медицинской практике многих стран. Офлоксацин по сравнению с другими фторхинолонами имеет дополнительно «встроенное» метилзамещенное оксазиновое ядро. Это изменение в химической структуре расширило спектр его антибактериального действия, в т.ч. преимущественное действие на грамотрицательные бактерии. По физическим свойствам Офлоксацин − белый с желтым оттенком кристаллический порошок, без запаха. Очень мало растворим в воде, метаноле; трудно растворим в хлороформе; легко растворим в ледяной уксусной кислоте. Обладает амфотерными свойствами. Ципрофлоксацин (выпускается в виде гидрохлорида или лактата) − белый кристаллический порошок без запаха, растворим в воде, мало растворим в спирте, нерастворим в хлороформе. Кроме офлоксацина и ципрофлоксацина к хинолонам третьего поколения относятся еще около десяти лекарственных средств. Среди них ломефлоксацин (содержит два атома фтора) и эноксацин (производный нафтиридина). (Рис. 16) Подлинность фторхинолонов подтверждают с помощью ИК- и УФ-спектров, которые должны соответствовать спектрам стандартных образцов. ИК-спектры снимают после прессования в таблетках с бромидом калия. УФ-спектры растворов фторхинолонов в воде, метаноле и этаноле имеют четко выраженные максимумы поглощения в диапозоне от 270 до 300 нм. УФ-спектр водного раствора ципрофлоксацина гидрохлорида имеет максимум при 313 и 279 нм. Подлинность ципрофлоксацина гидрохлорида подтверждают методом ТСХ на пластинках Сорбфил по идентичности значений Rf основного пятна у испытуемого и стандартного растворов. Используют подвижную фазу, состоящую из метиленхлорида-метанола-раствора аммиака-ацетонитрила (4:4:2:1). Пластинку просматривают при коротких и длинных волнах УФ-света. Для гидрохлоридов ципрофлоксацина и ломефлоксацина выполняют испытания на наличие хлорид-ионов. Фармакопея США рекомендует для количественного определения офлоксацина метод неводного титрования. Навеску растворяют в уксусном ангидриде, титрантом служит 0,1 М раствор хлорной кислоты, точку эквивалентности устанавливают потенциометрическим методом. Ципрофлоксацина гидрохлорид количественно определяют методом ВЭЖХ, используя подвижную фазу, включающую 0,025 М раствор фосфорной кислоты-ацетонитрил (87:13). Детектируют при длине волны 278 нм, используют стандартный образец ципрофлоксацина. Этот же метод рекомендован для определения содержания примесей. В таблетках содержание и однородность дозирования ципрофлоксацина гидрохлорида определяют спектрофотометрическим методом при длине волны 279 нм после извлечения водой (с обработкой ультразвуком). Хранят производные фторхинолонов по списку Б в защищенном от света месте в плотно закрытых склянках оранжевого стекла при температуре не выше 25°C. Защищать от высоких температур! Фторхинолоны оказывают активное антибактериальное действие на аэробные бактерии. Назначают их при инфекциях мочевых и дыхательных путей, брюшной полости, кожи, мягких тканей и др. Поскольку фторхинолоны быстро всасываются из желудочно-кишечного тракта, они эффективны при приеме внутрь (в таблетках). Ломефлоксацина гидрохлорид принимают по 0,4 г один раз в день, офлоксацин — по 0,2 г 2 раза в день, ципрофлоксацина гидрохлорид — по 0,125-0,25-0,5 г 2 раза в день или в виде 0,2%-ного раствора для инфузий. \ Заключение по работе В ходе проделанной работы, были выявлены основные и наиболее важные методы синтеза хинолинов и изохинолинов. В хинолинах возможно четыре типа построения скелета молекулы. В синтезах типа I-замыкание цикла происходит между γ-углеродным атомом и бензольным ядром, в синтезах типа II-замыкание цикла осуществляется между β- и γ-углеродными атомами, в синтезах типа III цикл замыкается между α- и β-углеродными атомами, и в синтезах типа IV-замыкание цикла осуществляется между азотом и α-углеродным атомам. Кроме этих четырёх основных типов реакций, применяемых при синтезе хинолина, известны и многочисленные их разновидности. Следует иметь в виду возможность того, что иногда один тип синтеза перекрывается другим, так как точный механизм реакций в ряде случаев до конца не выяснен. Помимо указанных методов имеются некоторые другие методы получения хинолиновых производных. К ним относятся реакции окисления полициклических соединений, а также некоторые пиролитические методы. Список использованной литературы
Приложения Рис.1  Рис.2 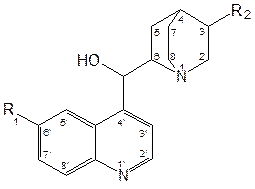 Таблица 1. Радикалы и оптическая изомерия алкалоидов хинной корки 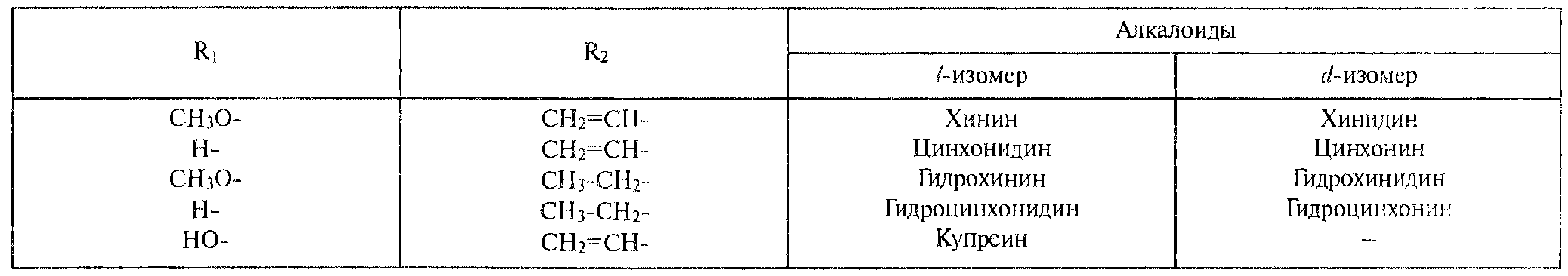 Рис.3 Рис.4 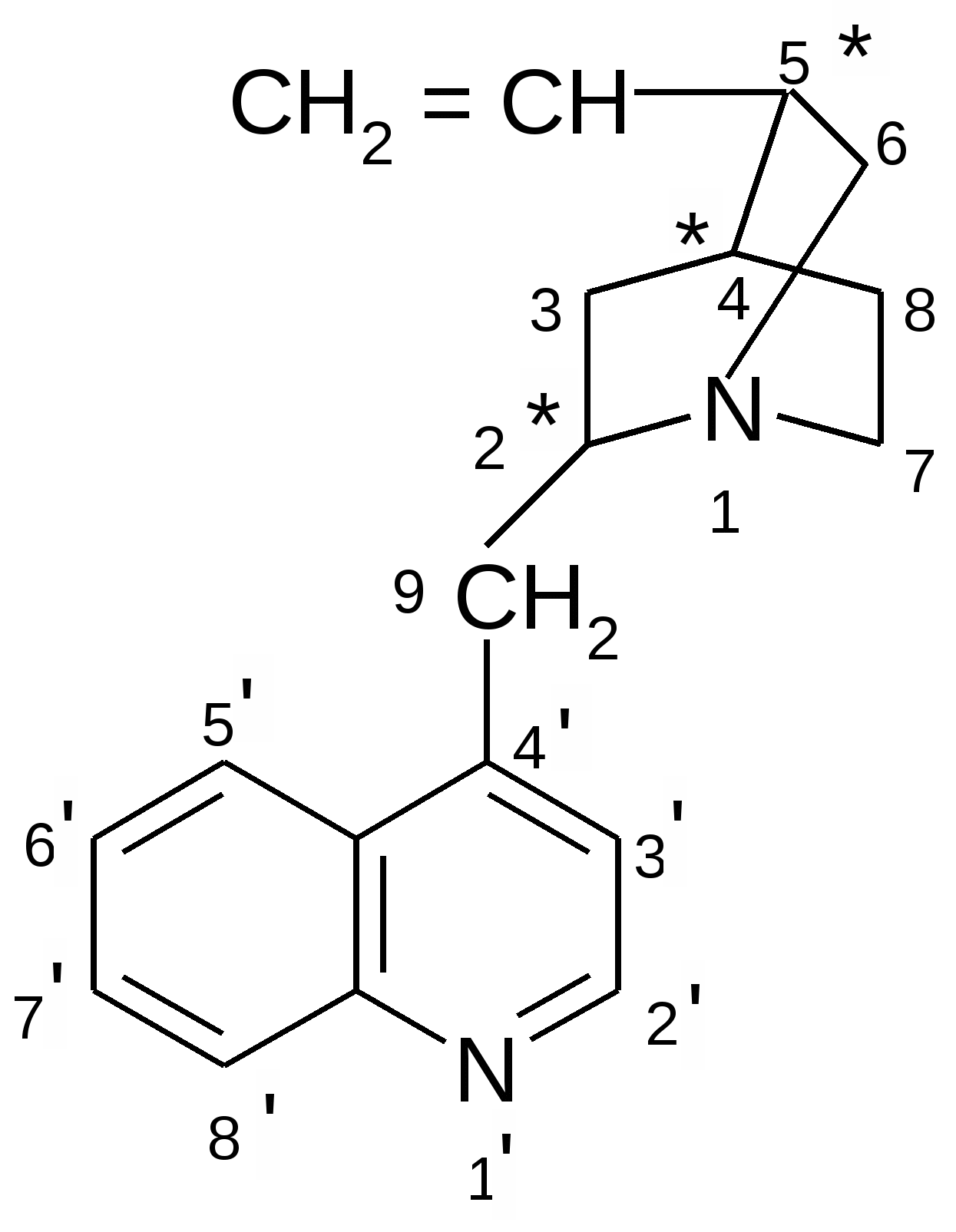 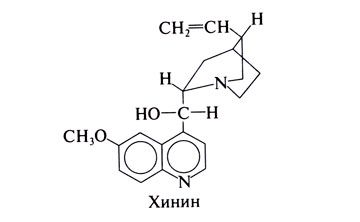 Цинхонан Таблица 2. Свойства солей хинина
Рис.5 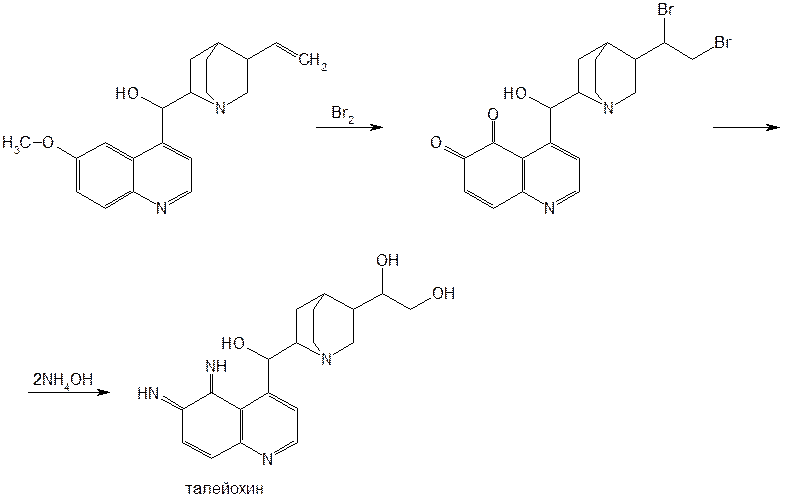 Ф.1 [C20H24O2N2]4 × (H2SO4)2 × (HI)2 × I4 × 6H2O Ф.2 [C20H24O2N2]2 × H2SO4 + 2NaOH ¾® 2C20H24O2N2¯ + Na2SO4 + 2H2O Рис.6 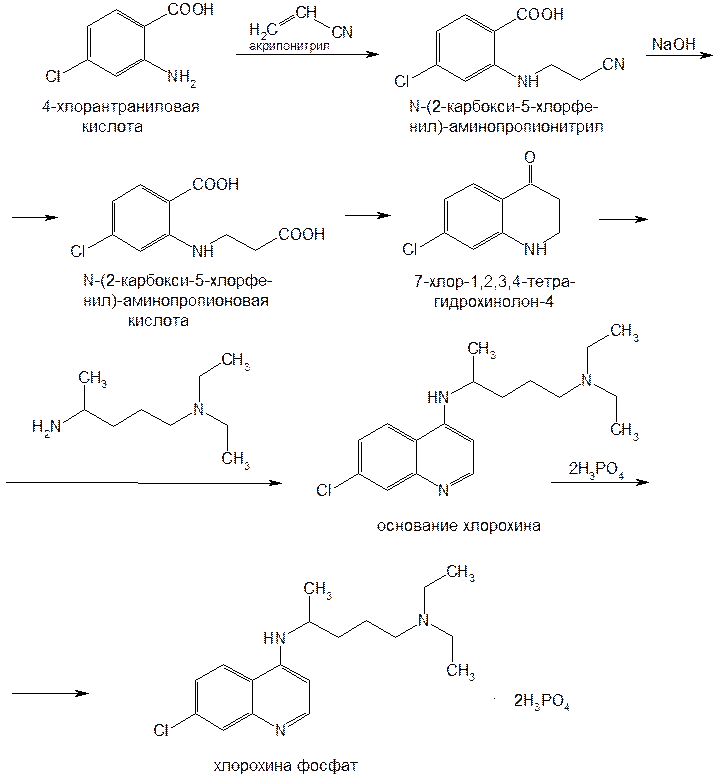 Таблица 3 Свойства производных 4-аминохинолина
Рис.7 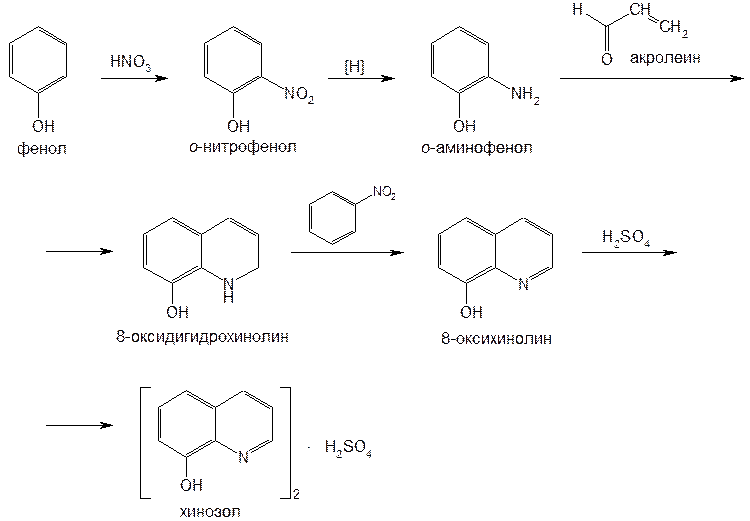 Рис.8 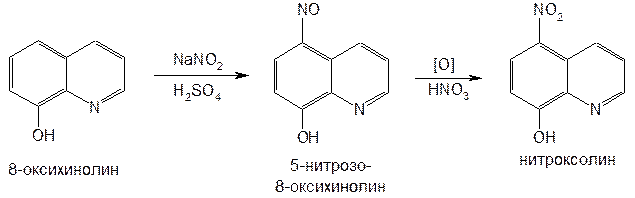 Таблица 4. Свойства производных 8-оксихинолина
Рис.9 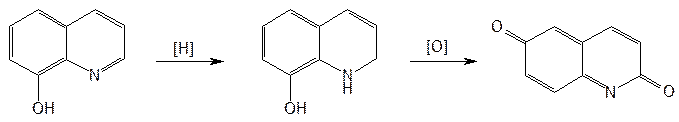 Рис.10 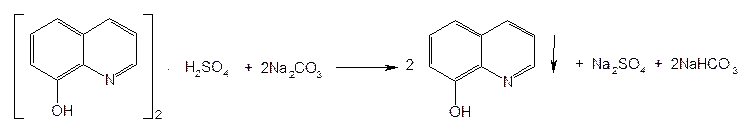 Ф.3 Na2CO3 + H2O —→ 2Na+ + HCO3– + OH– Рис.11 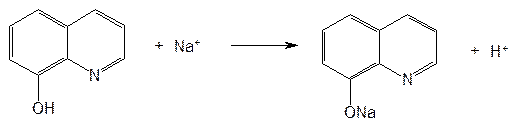 Рис.12 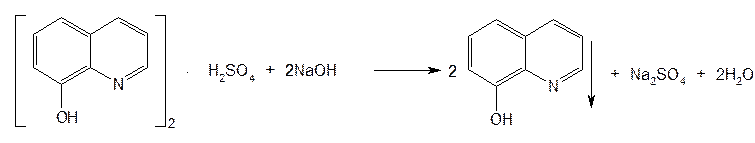 Ф.4 KBrO3 + 5KBr + 3H2SO4 ¾® 3Br2 + 3K2SO4 + 3H2O Рис.13 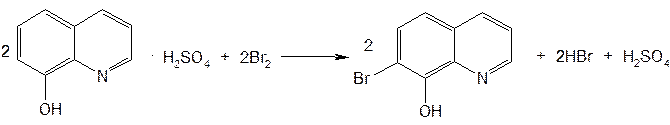 Ф.5 Br2 + 2KI ¾® I2 + 2KBr Ф.6 I2 + 2Na2S2O3 ¾® 2NaI + Na2S4O6 Рис.14 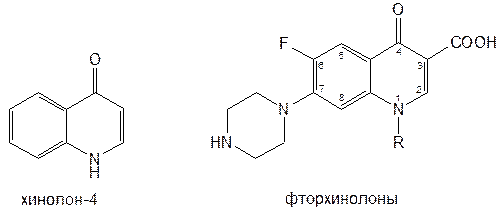 Рис.15 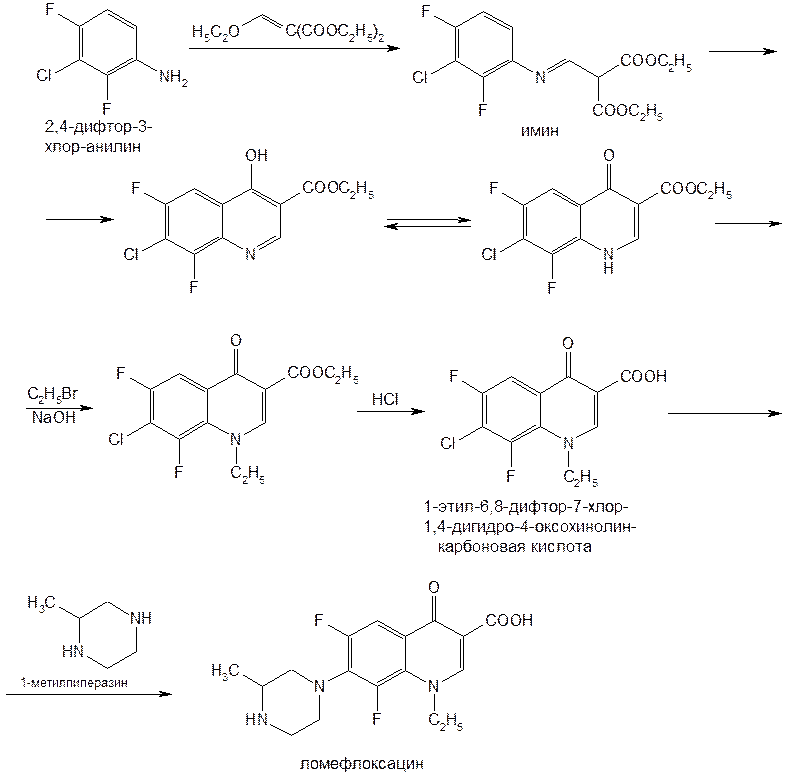 Таблица 5. Свойства производных фторхинолонов
Рис.16  (Enoxacinum) Эноксацин |