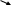Пример 2. На титрование 25 мл раствора хлороводородной кислоты требуется 24,8 мл раствора гидроксида калия с титром 0,02806г/мл. Определить нормальную концентрацию гидроксиса калия?
Алгоритм решения
1. Записать данные условия задачи.
|
Дано:
V(HCl) = 25 мл
V(KOH) =24,8мл
Т(КОН)=0,02806 г/мл
Сн(HCl) - ?
|
2. Определить нормальную концентрацию гидроксида калия по формуле (12)
|
Сн•Мэ
Т= ———
1000
М(КОН) 56
Мэ(КОН) = ———— = —— = 56г/экв
1 1
Т(КОН)•1000 0,02806•1000
Сн(КОН) = ——— = —————=
Мэ(КОН) 56
= 0,50107 экв/л
|
3. Определить нормальную концентрацию хлороводородной
кислоты из закона эквивалентов
|
Сн(HCl)• V(HCl) =Сн(КОН) • V(КОН)
0,501071 • 24,8
Сн(HCl)= —————— = 0,4971 экв/л
25
|
5. Приготовление разбавленных растворов из концентрированных растворов
Пример 1.
Сколько литров 96% раствора серной кислоты (с плотностью -1840кг/м3) требуется для приготовления 20л 0,5 М раствора серной кислоты?
Алгоритм решения
1. Записывать данные условия задачи
|
Дано:
ω1(H2SO4) =96%
ρ1=1840 кг/м3 = 1,84 г/мл
V2 = 20 л
См2(H2SO4) =0,5 моль/л
V1 -?
|
2. Определить, сколько граммов серной кислоты содержится в 20л 0,5 М раствора по формуле (3)
|
m рв
Cм = ————, (3)
M•V
М(H2SO4) = 98г/моль
m(H2SO4) =См2(H2SO4) •М(H2SO4) •V2=
= 0,5 моль/л•98г/моль • 20л = 980 г
|
3. Определить, в каком объеме 96% раствора серной кислоты содержится 980 г серной кислоты по формуле (2)
|
mр.в.
ω р.в. = ———— •100%, =>
ρ•V
m(H2SO4)
V1 = ——————— •100%
ρ1• ω1(H2SO4)
980 г
V1 = ——————— •100% = 0,54л
1,84 г/мл • 96%
|
Пример 2
Сколько миллилитров 50% раствора азотной кислоты , плотность которого 1,315 г/мл, требуется для приготовления 5л 2% раствора, плотность которого 1,010 г/мл?
Алгоритм решения
Расчет ведем, исходя из теоретического положения, вытекающего из понятия о процентной концентрации раствора, а именно: при одном и том же количестве растворенного вещества массы растворов и их процентная концентрация обратно пропорциональны друг другу:
ρ1•V1 ω2
———— ═ ———— (16),
ρ2•V2 ω1
где
ρ1,V1,ω1 – плотность, объем и массовая доля растворенного вещества в 1 растворе
ρ2,V2,ω2 – плотность, объем и массовая доля растворенного вещества в 2 растворе
1.Записать данные условия задачи
|
Дано:
ω1(HNO3) = 50%
ρ1(HNO3)= 1,315 г/мл
V2(HNO3)= 5 л
ω2(HNO3) = 2%
ρ2(HNO3)= 1,010 г/м
V1(HNO3)-?
|
2. Определить объем 50%-ного раствора азотной кислоты из формулы
|
ρ1•V1 ω2
———— ═ ———, (16)
ρ2•V2 ω1
ρ2•V2 • ω2 1,010•5 •2
V1(HNO3) = ————— = ————— =
ρ1•ω1 1,315 •50
=0,154 л
|
6.Смешение растворов разных концентрации
Задачи такого типа легко решаются с помощью диагональной схемы («правила креста»).
Диагональную схему строят следующим образом. В точке пересечения двух прямых обозначают концентрацию смеси, у концов этих прямых по одну сторону от точки пересечения указывают концентрации составных частей смеси, а по другую – разности концентраций смеси и ее составных частей
( см. ІІ)
Пример1 Найти массу воды, которую надо добавить к 200 г 50%-ного раствора КОН, чтобы получить 10% раствор.
Алгоритм решения
1. Записать условие задачи
|
Дано:
m1= 200 г
ω1 = 50%
ω2 = 0% (чистая вода)
ωсм= 10%
m2 -?
|
2 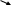  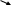 . Составить диагональную схему (см. раздел ІІ) . Составить диагональную схему (см. раздел ІІ)
|
ω1 =50% ωсм – ω2 =10-0=10
ωсм =10%
ω2 = 0% ω1 – ωсм =50-10=40
|
3. Найти массу воды из соотношения массовых частей
|
m1 ωсм – ω2 10
—— = ———— = ———=0,25 m2 ω1 – ωсм 40
m2= m1/0,25 = 200г/0,25 = 1000г
|
Пример2. Найти массы 20%-ного и 50%-ного растворов серной кислоты, необходимые для получения 500мл 30%-ного раствора с плотностью 1,11 г/мл .
Алгоритм решения
1. Записать условие задачи
|
Дано:
ω1 = 50%
ω2 = 20%
ωсм= 30%
Vсм = 500 мл
ρсм = 1,11 г/мл
m1, m2 -?
|
2. Найти массу итогового раствора по плотности и объему.
|
mсм = ρсм •Vсм
mсм = 1,11г/мл•500мл = 555 г
|
2 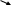  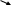 . Составить диагональную схему (см. раздел ІІ) . Составить диагональную схему (см. раздел ІІ)
|
ω1 =50% ωсм – ω2 =30-20=10
ωсм =30%
ω2 = 20% ω1 – ωсм =50-30=20
|
3. Найти соотношение масс исходных растворов
|
m1 ωсм – ω2 10
—— = ———— = ——— = 0,5 m2 ω1 – ωсм 20
m1 = 0,5 m2
|
4. Найти массы исходных растворов, исходя из предположения, что в сумме они дают массу итогового раствора.
|
mсм = m1 + m2 = 0,5 m2 + m2 = 1,5 m2
m2 = mсм/1,5 = 555/1,5 = 370 (г)
m1 = 0,5 m2 = 185 (г)
| |
 Скачать 63.51 Kb.
Скачать 63.51 Kb.