I. Способы выражения содержания растворенного вещества в растворе Концентрацией
 Скачать 63.51 Kb. Скачать 63.51 Kb.
|
ΙΙ. Расчет концентрации при смешении растворов.Расчет концентраций при смешении растворов производят по правилу смешения: Отношение массы одного компонента к массе второго обратно пропорционально отношению разности массовых долей каждого компонента и смеси в абсолютном значении. Это правила выражают в виде диагональной схемы правила смешения, которая получила название правила креста или «конверт Пирсона». Предположим, что смешивают два раствора с разной концентрацией. Масса первого раствора m1, масса второго раствора m2. Обозначим массовые доли растворенного вещества в смешиваемых растворов через ω1 и ω2. Массовую долю растворенного вещества в смеси примем за ωсм. Тогда: ω   1 ωсм – ω2 (массовые части 1-го раствора) 1 ωсм – ω2 (массовые части 1-го раствора) ωсм ωсмω  2 ω1 – ωсм (массовые части 2-го раствора) 2 ω1 – ωсм (массовые части 2-го раствора)То есть: m1 ωсм – ω2 —— = —————— m2 ω1 – ωсм Аналогичную схему применяют для расчетов при смешении растворов с разной молярной или нормальной концентраций, однако вместо массовых долей берут соответственно молярные или нормальные концентрации растворов, а вместо их массы – объемы растворов: С 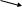 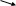 1 Ссм – С2 (объемные части 1-го раствора) 1 Ссм – С2 (объемные части 1-го раствора)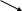 Ссм СсмС 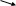 2 С1 – Ссм (объемные части 2-го раствора) 2 С1 – Ссм (объемные части 2-го раствора)То есть: V1 Ссм – С2 —— = —————— V2 С1 – Ссм Расчеты также можно производить обычным алгебраическим способом, сопоставляя массы растворенного вещества и массы (или объемы) смешиваемых растворов. ΙΙΙ. Примеры решения задач1. Определение массовой доли вещества в раствореПример 1. В 420 г воды растворено 180 г нитрата кальция. Определить массовую долю (в %) нитрата кальция в растворе ?Алгоритм решения
Пример 2. Определите массовую долю (в %) хлорида калия в растворе, полученном при смешении 150 г 20% раствора и 250 г 40% раствора хлорида калия? Алгоритм решения
Пример 3. Определить массу соли, содержащейся в растворе объемом 0,5 л , если массовая доля соли в этом растворе 20%, а плотность раствора 1,2 г/мл? Алгоритм решения
2. Определение молярной, нормальной концентраций растворов Пример1. 500 мл раствора серной кислоты содержат 196 г серной кислоты. Определить молярную и нормальную концентрации раствора серной кислоты? Алгоритм решения
Определение титра раствора Пример 1. Определить титр раствора, в 150 мл которого содержится 7,5 г карбоната натрия? Алгоритм решения
Пример2. Определить титр уксусной кислоты по гидроксиду натрия для 0,4 Н раствора уксусной кислоты? Алгоритм решения
4. Отношение между эквивалентными концентрациями и объемами растворов реагирующих веществ. Пример1. Для нейтрализации 50 мл раствора серной кислоты израсходовано 25 мл 0,4 Н раствора щелочи. Определить нормальную концентрацию раствора серной кислоты. Алгоритм решения
|
