Реферат Основы иммунной генетики. Иммунитет 3 Глава Антитела 6
 Скачать 456.5 Kb. Скачать 456.5 Kb.
|
|
СОДЕРЖАНИЕ: ВВЕДЕНИЕ 2 Глава 1. Иммунитет 3 Глава 2. Антитела 6 Глава 3. Отклонение в работе иммунной системы 11 Глава 3.1. Врожденный иммунодефицит 11 Глава 3.2. Приобретенный иммунодефицит 13 Глава 3.3. Аутоиммунные заболевания 15 Заболевания, вызванные гиперактивностью иммунной системы 17 ЗАКЛЮЧЕНИЕ: 17 СПИСОК ЛИТЕРАТУРЫ: 18 ВВЕДЕНИЕМы живем в потенциально враждебном мире, наполненном огромным множеством инфекционных агентов, которые имеют различные размеры форму, строение и разрушительную способность. Они были бы рады использовать нас для размножения своих генов, если бы мы в свою очередь не выработали целый ряд защитных механизмов, обеспечивающих возникновение иммунитета. Иммунитет- это невосприимчивость организма к инфекционным агентам и генетически чужеродным веществам антигенной природы. Главная функция иммунитета – иммунологический надзор за внутренним состоянием организма. Следствием этой функции является распознание специфическое блокирование нейтрализация или уничтожение генетически чужеродных веществ и клеток (бактерий, вирусов, раковых клеток и т.д.). За сохранение генетически обусловленной биологической индивидуальности отвечает иммунная система организма. Она включает совокупность всех лимфоидных органов и скоплений лимфоидных клеток, обеспечивающих реакцию иммунитета. Иммунная система состоит из центральных и периферических органов. Центральные органы иммунной системы включают тимус (у млекопитающих), сумку Фабриция (у птиц), костный мозг, пейеровы бляшки и миндалины. К периферическим органам относят лимфатические узлы, селезенку и кровь. Иммунная - система и ее главные исполнители - лимфоциты обеспечивают специфическую реакцию организма на чужеродные антигены. Кроме этой системы, существуют механизмы, обеспечивающие первичную ступень неспецифической сопротивляемости организма паразитам (бактерия, вирусам, гельминтам и т.д.). Глава 1. ИммунитетИммуногенетика-это область генетики, которая изучает генетические механизмы иммунного ответа. Иммунитет-это защита организма от инфекции или, в более широком смысле, реакция организма на чужеродные макромолекулы, микроорганизмы и клетки. Защита осуществляется с помощью двух систем-неспецифического( врождённого, естественного)и специфического иммунитета. Неспецифический иммунитет выступает как первая линия защиты. Система врождённого иммунитета действует на основе реакции воспаления и фагоцитоза. Она реагирует только на корпускулярные агенты (микроорганизмы, занозы) и на токсические вещества, разрушающие клетки и ткани, вернее, на корпускулярные продукты этого разрушения .Вторая и наиболее сложная система-приобретенного иммунитета-основана на специфических функциях лимфоцитов-клеток крови, распознающих чужеродные макромолекулы (антигены)и реагирующих на них либо непосредственно, либо выработкой защитных белковых молекул-антител. Антигеном (генератором антител) может быть не всякое вещество. Оно должно быть чужеродным, макромолекулярным ( с мол. массой более 10-12 кДа) и иметь устойчивую химическую структуру. К типичным антигенам относятся белки и полисахариды. Приобретённый иммунитет характеризуется четырьмя свойствами, которые неразделимы и всегда проявляются вместе: 1.Организм отличает свои антигены от чужих. 2. Способность отличать запоминается. Это так называемая иммунологическая «память». 3. «Память» специфична, запоминается контакт лишь с определённым антигеном. Специфичность этого запоминания очень высока. 4.Иммунный ответ на чужеродную макромолекулу можно избирательно подавить, если ввести её в развивающийся организм внутриутробно или в первые часы после рождения. Такое подавление реакции на белок называется толерантностью ( терпимостью). Система приобретённого иммунитета имеется в организме человека и других животных ( рыбы, земноводные, пресмыкающиеся, птицы, млекопитающие). Она хорошо используется для вакцинации, т.е. введения ослабленных или убитых микроорганизмов или выделенных из них макромолекул, вызывающих иммунную реакцию на эти микроорганизмы. Вакцинация является основным способом предупреждения таких заболеваний как оспа, туберкулёз, полиомиелит, сибирская язва и многие другие. Приобретённый иммунитет составляет основное препятствие для пересадки органов (сердце, почки, печень) и тканей ( кожа) от одного человека другому. Для преодоления этого барьера несовместимости пользуются препаратами, подавляющими иммунную систему. Каким образом возникает иммунитет? У человека существуют триллионы лимфоцитов- белых кровяных клеток. Они находятся в кровеносном русле, в лимфоидных органах( тимус, лимфоузлы, селезёнка и аппендикс)и в лимфе ( бесцветная жидкость в лимфатических сосудах, соединяющих лимфоузлы). Существуют две составляющие иммунной системы, каждая из которых ассоциирована с лимфоцитами определённого типа: гуморальный и клеточный иммунитет. Лимфоциты, созревающие в тимусе ( вилочковой железе), называются Т-лимфоцитами, в отличие от В-лимфоцитов, развивающихся в костном мозге.   Рис 1- Т-лимфоцит Рис 2- В-лимфоцит Клеточный иммунитет обеспечивается Т-клетками, а гуморальный-как В-,так и Т-лимфоцитами. Клеточный иммунитет опосредуется преимущественно специфическими Т-клетками- цитотоксичными Т-лимфоцитами, или « киллерами» ( CTL), и направлен против клеток, несущих на своей поверхности чужеродные антигены. Активирование как гуморальной, так и клеточной ветви иммунной системы требует цитокинов, продуцируемых Тн-клетками, которые в свою очередь активируются только в том случае , если антиген появляется в комплексе с молекулами белков, кодируемых МНС ( локус гистосовместимости), на поверхности специализированных клеток, называемых антиген-представляющими клетками (АРС). Эти клетки ( макрофаги, В-лимфоциты, дендритные клетки) поглощают антигены и затем выделяют часть антигена в комплексе с молекулой МНС на своей мембране. Затем Тн-клетки опознают антиген, связанный с молекулой МНС на поверхности антигенпредставляющих клеток. Гуморальная ветвь иммунной системы включает в себя взаимодействие В-клеток с антигеном, последующую их пролиферацию и дифференцировку в плазматические клетки, секретирующие антитела. Когда антигены связываются с антителами, эти комплексы тем или иным способом удаляются из организма. Несмотря на то что антигены обычно имеют большие размеры, они опознаются В- или Т-лимфоцитами , поскольку антитела, расположенные на этих клетках, связываются с небольшими участками антигена, называемыми антигенными детерминантами или эпитопами. В-клетки распознают эпитоп самостоятельно, в то время как Т-клетки-только если он расположен на поверхности антигенпредставляющей клетки в комплексе с молекулой МНС. Часть антигена, взаимодействующая с белками МНС , называется агритопом. Глава 2. АнтителаКак устроены антитела и рецепторы лимфоцитов? Очевидно, что их структура должна быть необычной, так как они строго специфически распознают громадное множество различных антигенов: любой чужеродный белок, полисахарид или синтетическую молекулу , вообще в природе не встречающуюся. Антитела являются иммуноглобулинами. У млекопитающих, включая человека, известны 5 классов иммуноглобулинов: IgМ, IgG, IgА, IgD, IgE. Каждый класс обладает своими структурными и биологическими свойствами. Иммуноглобулины всех классов построены по общему плану. Это можно проиллюстрировать на примере молекулярной организации IgG. Антитело состоит из двух идентичных пар полипептидных цепей: H-тяжелой с молекулярной массой примерно 50 000 Да и L- легкой с молекулярной массой около 25 000 Да. 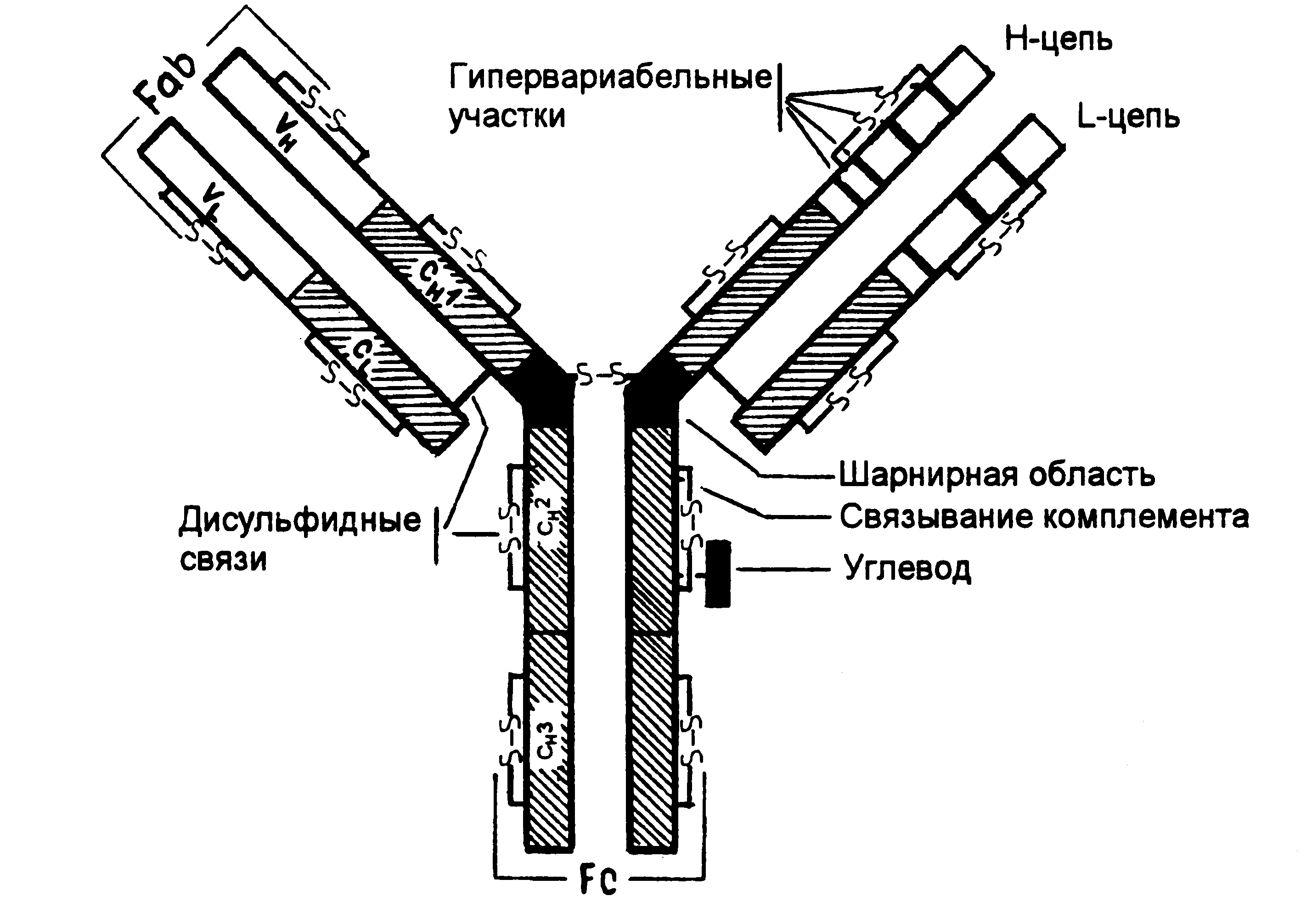 Рис 3 – Схема строение антитела Цепи соединены друг с другом ковалентными ( дисульфидными ) связями. Рецептор лимфоцитов, в отличие от антител-гетеродимер, состоящий из пары различных цепей- a и b с молекулярной массой около 50 000Да, соединенных между собой одной дисульфидной связью. В основе структуры иммуноглобулинов лежит сходное повторяющиеся звено( домен) примерно из 110 аминокислот, свёрнутых в глобулины. Каждый домен в молекуле антитела или рецептора Т-клеток( РТК)выполняет свою биологическую функцию, а наиболее важную из них- распознавание и связывание с антигеном-осуществляют концевые домены. Пара концевых доменов ( один из H –цепи, другой из L-цепи, а в РТК- один из b-цепи, другой из a-цепи) образует активный центр, уникальную по структуре полость, распознающую в молекуле антигена небольшие дискретные участки из 4-8 аминокислот. Эти участки антигена подходят к структуре активного центра, « как ключ к замку», образуя прочные нековалентные связи антигена с антителом. Разные антитела ( иРНК) отличаются друг от друга структурой активных центров. На молекулярном уровне эти различия определяются первичной структурой концевых доменов H и L, a- и b-цепей, т.е. последовательностью аминокислот в них. Участки H и L цепей ( равно как a и b),образующие «стенки» активного центра, носят название вариабельных ( V) районов. Остальная часть молекул постоянна- это константный (С) район. Вариабельных районов среди молекул антител тысячи, константных-единицы. Главная функция вариабельных районов- образование активных центров антител и РТК. Разнообразие активных центров очень велико, не менее 107-108 , что вполне достаточно для более или менее специфического распознавания любого произвольно взятого антигена. Таким образом, структура антител, а точнее, их активных центров обеспечивает узнавание любого чужеродного белка или полисахарида , попавшего в организм. Как же осуществляется контроль полипептидных цепей, один из районов которых постоянно варьирует при переходе от одного антитела ( или РТК) к другому (вариабельный, V-район), а остальные строго постоянны ( константные, С-районы)? Это задача решается благодаря уникальному генетическому механизму-независимому генетическому контролю V и С-районов, составляющих одну полипептидную цепь, и сборке гена, контролирующего вариабельный район, из фрагментов в процессе созревания лимфоцита. Загадка сосуществования константных и вариабельных участков в одной и той же полипептидной цепи была разрешена в конце 1970-х гг. С. Тонегавой. Он показал, что фрагменты ДНК, кодирующие V и С участки, расположенные в виде непрерывных последовательностей в геноме миеломы мыши, пространственно разобщены у эмбрионов или в сперматозоидах мыши. Гены, контролирующие структуру одной полипептидной цепи антитела или РТК, объединены в семейства, расположенные в одном участке хромосомы. При этом гены, соответствующие V-районам, « разорваны» на 2 или 3 фрагмента- основной V’ и один или два дополнительных D и J (D- разнообразие, J-соединяющий). V’-фрагмент гена контролирует первые 95 аминокислот в V-доменах, D- от 2 до 10 и J- от 5 до 15. V’-фрагментов в геноме недифференцированных лимфоцитов много-от 50 до 1000 для разных цепей, и все они отличаются друг от друга по своей структуре. D-гены представлены несколькими десятками копий, а , J- единичными последовательностями, причём каждая из них уникальна. В процессе созревания лимфоцита фрагменты объединяются на случайной основе в V’ DJ-ген, причём число возможных сочетаний равно произведению числа V’-,. D и J-генов. Для различных цепей антител или РТК число таких сочетаний варьирует от тысячи до десятков тысяч. Кроме того, в процессе сборки возможны ошибки и изменения в последовательности нуклеотидов объединяющихся фрагментов, что резко увеличивает число возможных комбинаций. Дальнейшее разнообразия активных центров возникает за счёт объединения вариабельных районов в пары цепей, составляющих этот центр. Таким образом, благодаря сборке V-гена из фрагментов и образованию активных центров из разных цепей, создаётся 107-108 уникальных по своей структуре участков молекулы антител, среди которых всегда найдутся способные взаимодействовать с любым произвольно взятым антигеном. Все это разнообразие и составляет репертуар антител. Следует подчеркнуть, что этот репертуар возникает до встречи с антигеном и независимо от антигена и что большая часть антител не потребуется в течение всей жизни особи. Эти антитела присутствуют на поверхности лимфоцитов, образуя там распознающие антиген рецепторы. Чрезвычайно важно, что на поверхности одной клетки находятся антитела одной и той же специфичности. Один лимфоцит может синтезировать антитела только одной специфичности, не отличающиеся друг от друга по структуре активного центра. Это формулируется как принцип «один лимфоцит-одно антитело». Каким же образом антиген, попадая в организм, вызывает усиленный синтез именно тех антител, которые специфично реагируют только с ним? Ответ на этот вопрос дала теория селекции клонов, предложенная австралийским исследователем Ф. Бернетом. Согласно этой теории, высказанной в 1957 г. и полностью подтвержденной последующими экспериментами, одна клетка синтезирует лишь один тип антител, которые локализуются на ее поверхности. Роль антигена заключается лишь в том ,чтобы найти клетку, несущую на своей мембране антитело, реагирующее именно с ним, и активировать эту клетку. Активированный лимфоцит вступает в деление и дифференцировку. В результате из одной клетки возникает 500-1000 генетически идентичный клеток ( клон), синтезирующих один и тот же тип антител, способных специфически распознавать антиген и соединяться с ним. В результате дальнейшей дифференцировки лимфоцит превращается в клетку, не только синтезирующую данное антитело, но и секретирующую его в окружающую среду. Таким образом, функции антигена- найти соответствующий ему лимфоцит, вызвать его деление и дифференцировку в клетку, секретирующую антитела. В этом и заключается суть иммунного ответа: в селекции нужных клонов и их стимуляции к делению. Динамика первичного и повторного ответов, согласно теории Бернета,- это отражение динамики размножения клонов клеток, продуцирующих антитела к данному антигену. Толерантность- утрата клона клеток вследствие их контакта с антигеном в процессе созревания лимфоцита. Для того чтобы чужеродный белковый антиген опознавался Т-клетками, он должен деградировать на небольшие пептиды, формирующие комплексы с молекулами белков класса I или II ,кодируемых генами МНС. Это превращение белков в МНС- связанные пептидные фрагменты называется процессингом антигена. В результате процессинга пептиды в комплексе с белками МНС появляются на мембране так называемых антигенпредставляющих клеток( макрофаги, В-лимфоциты, дендритные клетки). Затем Т-клетки опознают этот комплекс антигена и МНС-белков, причём CD4 Тн-клетки связываются сс клетками, содержащими на мембране белки класса II МНС, а CD8 Тс-клетки- класса I МНС. У человека белки классов I и II локуса МНС кодируются генами, расположенными в кластере, HLA хромосомы 6, у мыши-в H-2 комплексе хромосомы 17. Молекулы МНС класса I состоят из тяжелой α -цепи, соединенной нековалентно с легкой цепью- β2-микроглобулином. α-цепь- это трансмембранный белок размером 45 кДа, кодируемый локусом МНС классаI ( гены A, В и C локуса HLA у человека и K,D локуса Н-2 у мыши). β2-микроглобулин является инвариантным белком размером 12кДа и кодируется не в локусе МНС, а в другой хромосоме. Молекулы МНС класса II также содержат две цепи- α и β. Обе цепи кодируются генами района D комплекса HLA ( у человека) или района I комплекса Н-2 ( у мыши). Глава 3. Отклонение в работе иммунной системыНарушения иммунной системы: Иммунодефицит. Низкая активность иммунитета. Гипофункция иммунной системы. Иммунитет снижен. Дисфункция иммунной системы. Извращенные реакции иммунитета. Гиперактивность. Избыточная активность иммунной системы. Избыточно повышен иммунитет. Глава 3.1. Врожденный иммунодефицитВрожденные иммунодефициты встречаются редко, но они могут повлиять на все основные аспекты иммунной системы. К счастью многие из этих заболеваний можно лечить. — Болезнь Брутона. Наследуется по Х-сцепленному рецессивному типу: признаки заболевания выявляются только у мальчиков (набор половых хромосом XY). Девочки не болеют, так как даже если они гетерозиготны, то рецессивный ген одной X-хромосомы компенсируется нормальным геном гомологичной X-хромосомы. Болезнь встречается среди мальчиков с частотой 1:250000. Пациент Брутона, четырехлетний мальчик, впервые был госпитализирован в военный госпиталь Уолтера Рида из-за инфицированного колена. Ребенок выздоровел, когда Брутон дал ему антибиотики. Однако в течение следующих четырех лет у него было несколько инфекций. Агаммаглобулинемия встречается во всех расовых группах с частотой от одного до пяти тысяч человек до одного на 100 000 человек. Агаммаглобулинемия является дефектом в В-клетках. Это приводит к снижению антител в крови и повышенной уязвимости к инфекции некоторыми типами бактерий и вирусами. Дети с такой болезнью Брутона рождаются здоровыми. Но они начинают проявлять признаки инфекции в первые три-девять месяцев жизни. То есть в то время, когда исчезают антитела, которые приходят от матери во время беременности и раннего кормления грудью. Пациенты могут иметь инфекции, связанные с: кожей, костями, мозгом, желудочно-кишечным трактом, глазами, ушами, носом, дыхательными путями в легкие. Кроме того, бактерии могут мигрировать из первоначального места инфекции и попадать в кровоток. Это приводит к подавляющему заражению организма, что потенциально смертельно. Помимо признаков рецидивирующих инфекций, у пациентов с агаммаглобулинемией могут быть физические проявления: медленный рост, одышку, небольшие миндалины, ненормальный уровень кариеса У детей могут развиваться такие необычные симптомы, как: заболевания суставов, разрушение эритроцитов, повреждение почек, воспаление кожи и мышц Увеличение заболеваемости раком, таким как лейкемия, лимфома и, возможно, рак толстой кишки, было связано у небольшого процента людей. Текущие исследования по лечению болезни Брутона сосредоточены на возможности трансплантации костного мозга или генной терапии для коррекции аномального гена BTK. Однако в настоящее время лечения нет. — Синдром Ди Георга. Врожденное, но не наследственное заболевание иммунной системы. Связано с нарушением тимуса в период эмбрионального развития. Поврежденный тимус не может обеспечить нормальное развитие Т-клеток. Глава 3.2. Приобретенный иммунодефицитПриобретенный иммунодефицит – это устойчивые и выраженные нарушения функций ранее здоровой иммунной системы, возникающие в процессе жизнедеятельности человека. Вторичный иммунодефицит может появляться в результате заболеваний и ряда факторов, негативно влияющих на функции иммунной системы. Иммунная система может быть ослаблена приемом некоторых лекарств. Иммунодефицит может возникнуть у людей, находящихся на химиотерапии, или принимающих другие препараты для лечения рака. Поражение гельминтами (глистами), протозойными инвазиями (лямблии, хламидии, токсоплазма), бактериальной инфекцией (стафилококк, пневмококк, стрептококк), вирусными инфекциями (грипп, корь, гепатиты, герпес, цитомегаловирус, СПИД и т.д.) приводит к возникновению вторичного (приобретенного) иммунодефицита. Иммунная система также может быть ослаблена курением, алкоголем, плохим питанием и недостатком витаминов и минеральных компонентов. Синдром приобретенного иммунодефицита-СПИД Болезнью иммунной системы является СПИД. Возбудителем является ретровирус, получивший название вируса иммунодефицита человека- ВИЧ. На вирусной молекуле РНК с помощью обратной транскриптазы синтезируется ДНК, встраивающаяся в геном. В результате транскрипции провирусной ДНК и сборки вирусных частиц клетка-хозяин гибнет. Это болезнь сопровождается развитием у больных глубокой иммунной недостаточности, проявляющейся в том, что безопасные для здорового человека микроорганизмы приобретают способность вызывать тяжелые инфекционные заболевания. Отличительным свойством ВИЧ является то , что он адсорбируется на поверхности только тех клеток , которые содержат мембранный белок, называемый антигеном CD4. Такой поверхностный антиген в основном содержат Тн-лимфоциты, играющие важнейшую роль в координации работы всей иммунной системы человека. Уничтожение лимфоцитов этого типа и обуславливает иммуносупрессорное действие ВИЧ. Моноклональные антитела При введении даже одного антигена в организм в ответ возникает большое семейство антител. Связано это с тем, что каждое антитело вырабатывается не на белок или полисахарид, а на их детерминантные группы. В белках детерминантная группа состоит из 6-8 аминокислот, формирующих пространственную структуру данной молекулы. В одной молекуле белка может быть около десятка разных детерминант. В полисахаридах детерминантные группы формируются 3-6 остатками моносахаридов. И даже к одной детерминанте образуется несколько антител, различающихся по свойствам. Для некоторых целей, в первую очередь экспериментальных, требуются не многокомпонентные смеси антител, а отдельные антитела, направленные лишь к одной детерминанте антигена-моноклональные антитела. Моноклональные антитела получают из гибридом- клеток, образовавшихся в результате слияния антителообразующих клеток ( АОК) и опухолевой клетки. У таких гибридных клеток сочетается способность к синтезу антител от нормальных клеток и к неограниченному и бесконтрольному росту- от опухолевых клеток. Технически гибридомы получают следующим образом: мышей интенсивно иммунизируют определенным антигеном. Когда в их крови появляются антитела, у них берут селезенку и лимфоузлы и готовят взвесь клеток из этих органов. К ней добавляют клетки плазмоцитомы ( Пл)- опухоли, в которой избирательно перерабатываются иммуноглобулины и весь синтетический аппарат которой переключен на этот синтез. С помощью полиэтиленгликоля клетки сливают в гибридные. При этом могут образовываться гибриды АОК/ АОК, АОК/Пл, Пл/Пл. Из них отбирают только АОК/Пл. После недолгого( несколько дней) культивирования клеток In vitro на специфической ГАТ-среде одиночные АОК, а также гибриды АОК/АОК погибают, так как заканчивается срок их жизни. Клетки Пл/Пл и Пл гибнут, так как не способны жить на Гат-среде. Выживают только гибриды АОК и плазмоцитомы, так как бессмертие они унаследовали от опухоли, а способность выживать на ГАТ-среде- от нормальной клетки. Глава 3.3. Аутоиммунные заболеванияПри аутоиммунных заболеваниях, иммунная система атакует нормальные, здоровые клетки организма. Точные причины аутоиммунных заболеваний на сегодняшний день не известны. Но существуют определенные факторы риска возникновения аутоиммунных заболеваний. Факторы риска возникновения аутоиммунных заболеваний Генетика. Генетическая предрасположенность к аутоиммунным нарушениям. Тем не менее, разные члены семьи могут быть повергнуты различным аутоиммунным нарушениям. Например, один человек может иметь диабет, а другой член этой семьи имеет ревматоидный артрит. Медики склоняются к тому, что одной только генетической предрасположенности к появлению аутоиммунного заболевания недостаточно. Безусловно, что в дополнение к генетической предрасположенности к аутоиммунным заболеваниям, большую степень влияния оказывают другие факторы! Факторы окружающей среды. Наследственная предрасположенность к аутоиммунным заболеваниям вместе с факторами окружающей среды (питание, воздух, вода, и т.п.) может привести к аутоиммунному заболеванию. Пол человека. Примерно три четверти людей с аутоиммунными нарушениями являются женщины. Половые гормоны. Аутоиммунные нарушения, как правило, возникают у женщин в период детородного возраста. На развитие некоторых аутоиммунных заболеваний влияют крупные гормональные изменения в организме, такие как беременность, роды и менопауза. Инфекция. Аутоиммунное заболевание может стать результатом длительных хронических инфекций в организме. Иммунная система работает по принципу: свой – чужой. Своих не трогает, чужих уничтожает. В результате гормональных изменений, а также, длительных хронических инфекций (гепатиты, герпес, цитомегаловирус и т.д.), клетки организма изменяются. А иммунная система, эти измененные гормонами или вирусами клетки, воспринимает как чужие и атакует их. Типичные аутоиммунные заболеванияДиабет 1 типа. В этом типе диабета, иммунная система атакует клетки поджелудочной железы, которые вырабатывают инсулин. Инсулин снижает концентрацию сахара в крови. Ревматоидный артрит. Этот тип артрита вызывает набухание и деформацию суставов. Увеличение количества лейкоцитов в крови и скорости оседания эритроцитов (СОЭ) — указывают на инфекционную природу процесса. Полагают, что заболевание развивается в результате инфекции, вызывающей нарушения иммунной системы у наследственно предрасположенных лиц; при этом образуются так называемые иммунные комплексы (из антител, вирусов и проч.), которые откладываются в тканях и приводят к повреждению суставов. Системная красная волчанка. Является системным аутоиммунным заболеванием, которое поражает ткани организма, в том числе легкие, почки и кожу. Иммунная системы вырабатывает антитела, которые поражают ДНК здоровых клеток, преимущественно поражаются соединительные ткани. Заболевания, вызванные гиперактивностью иммунной системыАстма. Отек дыхательных путей, вызывающих удушье, кашель, свистящее и затрудненное дыхание. Астма может быть вызвана такими аллергенами, как пыль или пыльца. Раздражителем, вызвавшим приступ астмы может быть и табачный дым. Экзема. Аллерген вызывает сыпь, зуд. Заболевание, также, имеет другое название — атопический дерматит. Аллергический ринит или Сенная лихорадка. Воспалительное заболевание слизистой оболочки носа. Вызывается бытовыми аллергенами, такими как пыль, шерсть домашних животных, пыльца или плесень. ЗАКЛЮЧЕНИЕ:До настоящего времени лечение аутоиммунных заболеваний сводится в основном к неспецифическому подавлению иммунитета, что является обоюдоострым оружием, поскольку снижает сопротивляемость организма инфекциям. Кроме того, врачи борются с воспалением и симптомами каждого заболевания в отдельности. Главнейшей задачей иммунологии является создание методов избирательного подавления аутоиммунной патологии, для чего требуется глубокое знание всех механизмов этого сложнейшего заболевания у каждого конкретного больного. СПИСОК ЛИТЕРАТУРЫ:1. Рабсон А. Основы медицинской иммунологии / А.Рабсон, А.Ройт, П.Делвз. - М.: Мир, 2006. - 320 с. 2. Ройт А. Основы иммуногенетики М.: Мир, 1991. С.327. 3. Щелкунов С.Н. Эпидемия СПИДА // Соросовский образовательный журнал-1999- №1. С.22-28 4. Абелев Г.И. Основы иммунитета // Соросовский образовательный журнал -1996-№5. С.4-10. 5. Попова Н.А. Иммунология. Новосибирск: Изд.НГУ,-1999.-С 96. |
