Инструкция к лабораторным работам
 Скачать 5.94 Mb. Скачать 5.94 Mb.
|
КОНТРОЛЬНЫЕ ВОПРОСЫЧто называется дифракцией света? Условия наблюдения дифракции. Виды дифракции. Сформулировать принцип Гюйгенса, принцип Гюйгенса-Френеля. Что такое дифракционная решетка, период решетки? Записать условие главных максимумов дифракционной решетки. ТЕСТОВЫЕ ЗАДАНИЯ
ОТЧЕТ
ЛАБОРАТОРНАЯ РАБОТА №20 ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА Цель работы: изучить теорию атома Томсона, Резерфорда и Бора, определить постоянную Ридберга. Теоретическое введение. Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Томсону (1903 г.). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10-10 м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет Резерфордом было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно. Опытами Резерфорда по рассеянию -частиц в 1911г. было установлено, что атом любого химического элемента состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Масса атома почти полностью сосредоточена в его ядре, однако, размеры ядра ничтожно малы по сравнению с радиусом атома, который, в свою очередь, может быть оценен как среднее расстояние от ядра до электронов. Классическая электродинамика не в состоянии объяснить стационарное состояние атома, потому что электроны, испытывая непрерывные ускорения, должны излучать в пространство электромагнитные волны и, следовательно, терять энергию. При этом излучаемый атомом спектр должен быть непрерывным. В результате потери энергии электрон должен упасть на ядро, а атом прекратить свое существование. Однако этого не происходит, и атом может находиться в стационарном состоянии неограниченно долго. Кроме этого, экспериментальные исследования показали линейчатость спектров излучения атомов (у газов и паров металлов). Для устранения данных противоречий в 1913 г. датский физик Нильс Бор выдвинул постулат (первый постулат Бора) согласно которому атом может находиться в стационарном состоянии неограниченно долго. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Атомы, находящиеся в стационарном состоянии, не излучают электромагнитных волн. Изучая энергетический спектр атома водорода, Бор пришел к выводу, что собственный момент импульса атома водорода Ln, который почти полностью совпадает с моментом импульса электрона относительно ядра, кратен где n=1, 2, 3, - целое положительное число, называемое главным квантовым числом; m - масса электрона, v - его скорость, а r - радиус орбиты. Соотношение (1) называется правилом квантования круговых орбит. Внутренняя энергия атома водорода складывается из кинетической энергии электрона относительно ядра (протона) и потенциальной, равной энергии кулоновского взаимодействия электрона и протона где е =1,60210-19 Кл – модуль элементарного заряда; 0 =8,8510-12 Ф/м – электрическая постоянная. и потенциальной, равной энергии кулоновского взаимодействия электрона и протона Роль центростремительной силы, удерживающей электрон на стационарной орбите радиуса r, выполняет сила кулоновского притяжения между электроном и ядром: Из сопоставления (2) и (4) видно, что А полная энергия Возведем соотношение (1) в квадрат, а соотношение (4) умножим на mr3 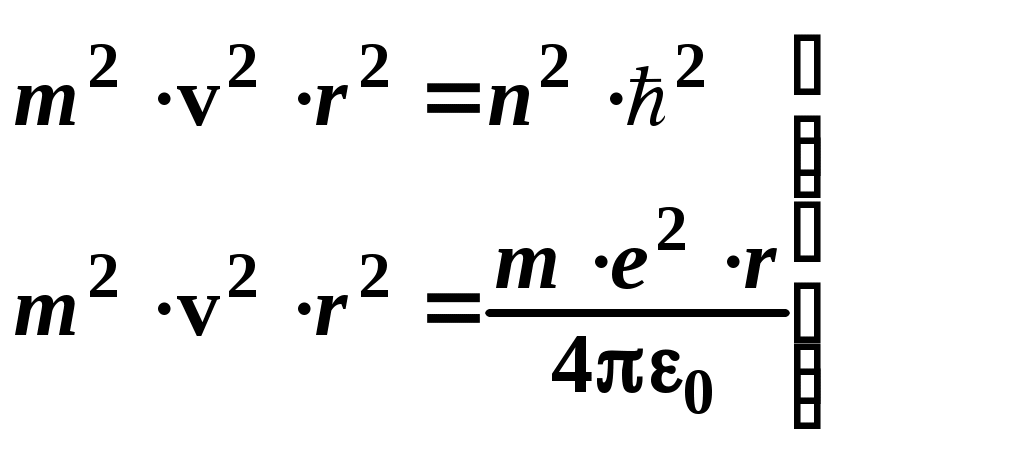 . (7) . (7)Левые части системы (7) одинаковы, а значит, правые равны друг другу: откуда находятся радиусы стационарных орбит электрона: где 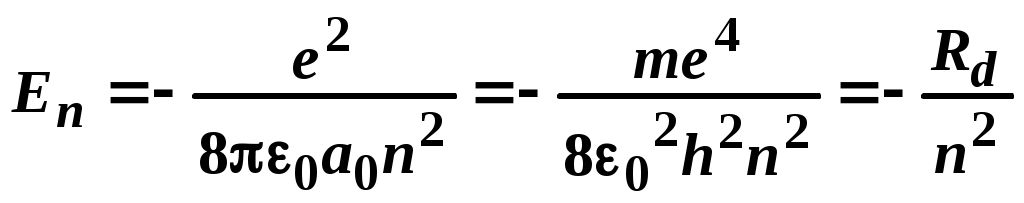 , (10) , (10)где 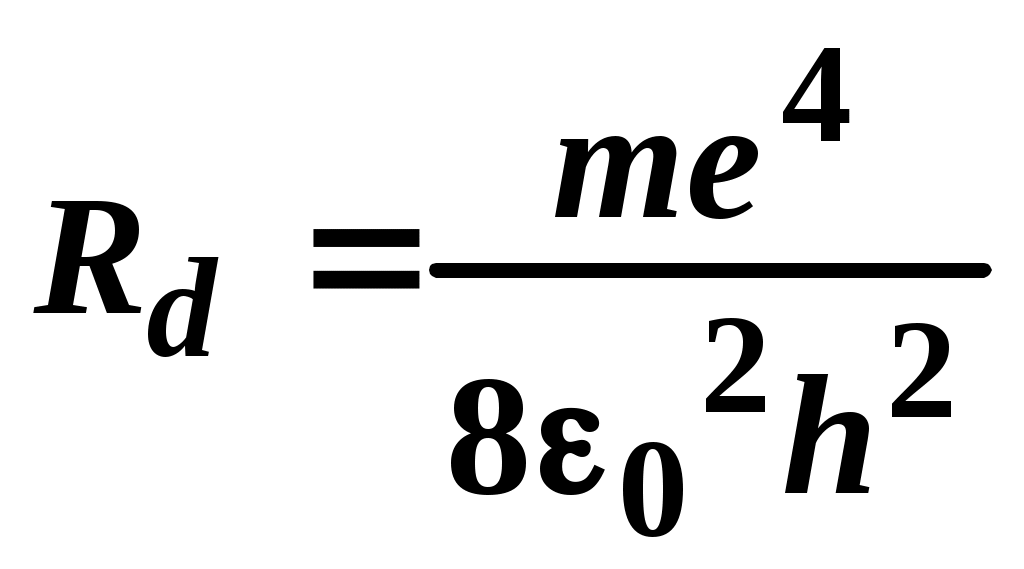 =2,1710-15 Дж=13,6 эВ – ридберг – атомная единица измерения энергии. =2,1710-15 Дж=13,6 эВ – ридберг – атомная единица измерения энергии.Из соотношений (9) и (10) видно, что радиусы электронных орбит в атоме водорода и энергии электрона на этих орбитах полностью определяются главным квантовым числом n. Причем, радиус орбиты r пропорционален n2, а уровни энергии находятся в интервале от –13,6 эВ до нуля. На схеме (рис. 1) в соответствующем масштабе отложены уровни энергий с n=1,2,3. Видно, что энергия электрона возрастает с увеличением номера орбиты. Энергетическое состояние с n=1 является основным (нормальным) состоянием; состояния с n>1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Согласно второму постулату Бора, при переходе электрона с более удаленной от ядра (высокой) k-ой орбиты на более близкую к нему (низкую) n-ую орбиту происходит испускание кванта излучения: где Ek и En – соответственно энергии стационарных состояний атома до излучения и после излучения. 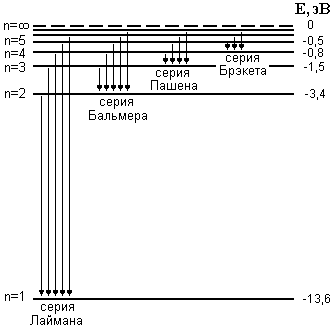 Рис. 1. Схема переходов, соответствующих спектру испускания атомов водорода. Наоборот, для того, чтобы перейти с низкой n-ой орбиты (более близкой к ядру) на более высокую k-ую орбиту, электрону необходимо поглотить такой же квант энергии h. Если каким-либо образом возбуждать атомы разряженного газа (с помощью электрического разряда, воздействием жесткого внешнего излучения, бомбардировкой пучком ускоренных частиц), то с помощью спектрального прибора можно наблюдать спектр излучения – узкие цветные линии на темном фоне. Цвет линии определяется частотой испускаемого света. Наоборот, если луч белого света пропускать через разряженный газ, то будет наблюдаться спектр поглощения – узкие темные полосы на сплошном спектре, причем поглощаются те же длины волн, что и излучаются. Возникновение спектра поглощения объясняется тем, что атомы газа способны поглощать только кванты света вполне определенной частоты. Подставим выражение для энергии (10) в формулу (11). Тогда частота фотона, излученного атомом водорода при переходе электрона с k-ой орбиты на n-ую (k>n), может быть найдена по формуле: 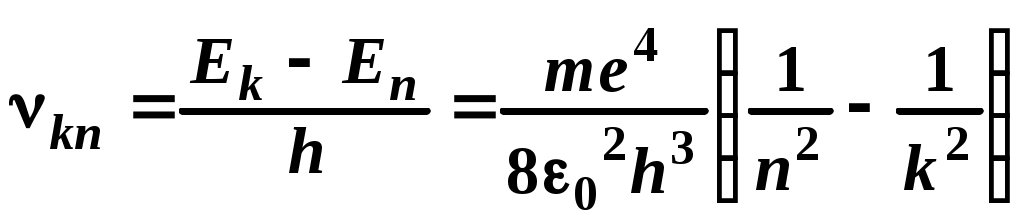 , (12) , (12)а соответствующая ей длина волны из соотношения: 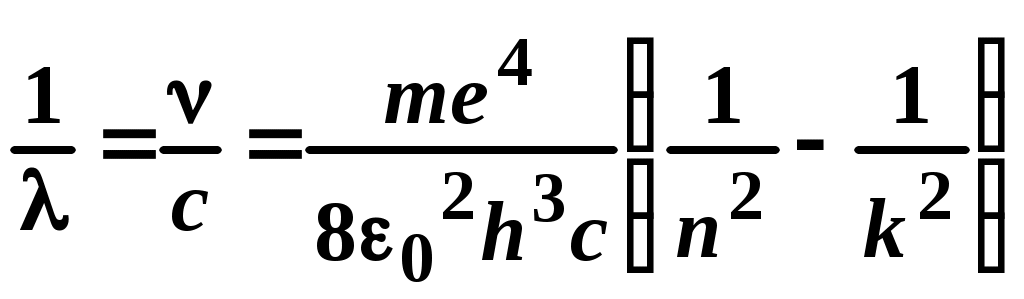 или или где 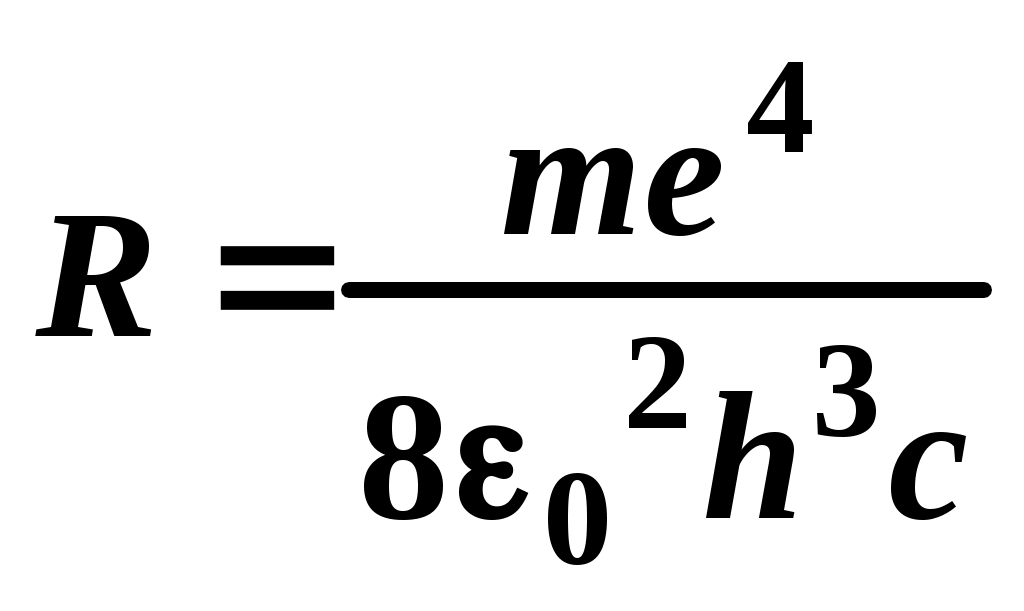 - постоянная Ридберга. (14) - постоянная Ридберга. (14)Соотношение (13) носит название формулы Бальмера, полученной эмпирически в 1885 г. Энергии квантов излучения и соответствующие им частоты объединяются в серии по номеру уровня, на который происходит переход электрона. Серия Лаймана n=1, k=2,3,4,5, - ультрафиолетовая область. Серия Бальмера n=2, k=3, 4, 5, - видимая область спектра. Серия Пашена n=3, k=4, 5, 6, - инфракрасная область спектра. На схеме (рис. 1) стрелками показаны переходы электрона с верхних уровней на нижние. Длина стрелок пропорциональна частоте излучения. Первые три частоты в серии Бальмера соответствуют видимому свету (красный, сине-голубой, фиолетовый). Более высокие частоты попадают в ультрафиолетовую область. Легко видеть, что самая малая частота в серии Лаймана (переход со второго уровня на первый) больше самой большой частоты в серии Бальмера (переход с уровня n= на второй), поэтому все переходы в серии Лаймана соответствуют ультрафиолетовому излучению. Точно также самая малая частота в серии Бальмера, соответствующая красному свету и переходу с 3-го уровня на 2-ой, больше самой большой частоты в серии Пашена (n=3, k=), поэтому в серии Пашена, Брэкета и др. имеет место только инфракрасное излучение. ОПИСАНИЕ УСТАНОВКИ  |