реферат ХИМИЯ. Ионообменная хроматография по направлению подготовки
 Скачать 150.83 Kb. Скачать 150.83 Kb.
|
|
Министерство образования и науки РФ Федеральное государственное автономное образовательное учреждение высшего образования БАЛТИЙСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ ИМЕНИ И. КАНТА Медицинский институт СПО Р Е Ф Е РАТ на тему: «Ионообменная хроматография» по направлению подготовки : Фармация направленность программы: Аналитическая химия Выполнили: Романенко Ю Кулинич В Проверил: Князева Е.Г Калининград 2017 г. Содержание 1. Сущность метода 3 2. Объекты определения 4 3. Условия проведения анализа 4 4. Аппаратура 7 5.Применение в медицине 9 1. Сущность метода Хроматография – это метод разделения и анализа смесей, основанный на многократном перераспределении компонентов смеси между двумя фазами при прохождении подвижной фазы (ПФ) через неподвижную (НФ). Ионообменная хроматографии позволяет разделить практически любые заряженные молекулы, в том числе: крупные — белки, малые—молекулы нуклеотидов и аминокислот. Часто ионообменная хроматография используют как первый этап очистки белков. Принцип ионообменной хроматографии Ионообменная хроматография позволяет разделить молекулы, основываясь на ионных взаимодействиях. Неподвижная фаза имеет заряженные функциональные группы, которые взаимодействуют с анализируемыми ионизированными молекулами противоположного заряда. Этот вариант хроматографии классифицируется на два типа — катионную и анионную ионообменную хроматографию:
По характеру ионогенных групп иониты делятся на катиониты, способные к обмену катионов, и аниониты, способные к обмену анионов. Существуют также иониты, обладающие амфотерными свойствами,— амфолиты, которые при различных значениях рН могут осуществлять обмен катионов и анионов. Механизм анионного обмена можно представить в виде уравнения: X - + R+ Y - ↔ Y - + R+ X - Аналогично уравнение для катионного обмена: Х+ + R - Y+ ↔ Y+ + R - X+ Метод ионообменной хроматографии основан на использовании яв ления ионного обмена между неподвижной твердой фазой ‒ ионообменником (сорбентом) и подвижной жидкой фазой ‒ раствором, содер жащим ионы, обмениваемые с ионами сорбента. Существуют адсорбенты, которые способны обмениваться ионами с окружающей средой. Наиболее распространенный вид ионной адсорбции - ионообменная хроматография. Она заключается в том, что твердая фаза, практически не растворимая в воде, обменивается ионами с раствором, причем этот обмен происходит в эквивалентных количествах и подчиняется закону действующих масс. В качестве ионообменных материалов первоначально были использованы природные алюмосиликаты (цеолиты), состав которых может быть выражен формулой: МхЭуО3уnH2O (где М – Na, K, Ca; Э – Si, Al в переменных соотношениях). В настоящее время синтезированы высокомолекулярные смолы – иониты, содержащие определенные активные группы, способные к обмену ионов с раствором электролита. По характеру действия смолы подразделяют на катиониты и аниониты. Для катионитов активными группами являются –SO3H, -SO2H, COOH, все они имеют кислотный они имеют кислотный характер и в водных раствора обменивают ионы водорода на катионы 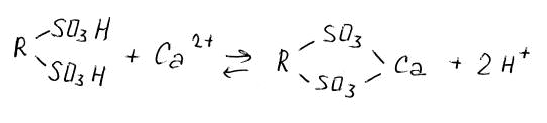 Для анионитов характерны группы –NH2, =NH, N , переходящие в водной среде в радикалы –NH3OH, =NH2OH, N HOH, т.к. вода проникая в зерно частицы «раздвигает» молекулы полимера, вызывая набухание в ионообменнике. В таких условиях, в результате диссоциации активных групп катионитов и анионитов, образуется подвижный диффузионный слой, ионы которого противоположно заряжены каркасу из нерастворимых поливалентных ионов. Ионы подвижного диффузионного слоя способны обмениваться местами с ионами окружающей среды: 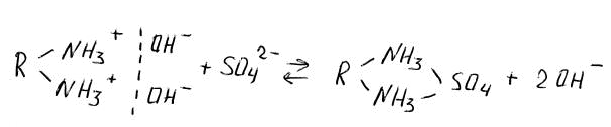 Как следует из приведенных уравнений, при такой обменной адсорбции изменяется рН среды. Кроме катионитов и анионитов известны амфотерные иониты, которые в зависимости от условий способны к обмену и катионов и анионов, т.к. содержат в своей структуре и кислотные и основные группы. К ионитам предъявляют ряд общих требований К ионитам предъявляют ряд общих требований: 1. Ионит должен быть твердым, не растворимым в воде и органических растворителях веществом, стойким к действию кислот, оснований и окислителей. 2. Одной из важных физико-химических характеристик ионитов является их обменная емкость, которая определяется содержанием в ионите ионогенных групп. Обменная емкость не зависит ни от состояния ионита (например размера зерен), ни от природы противоионов. Обменную емкость выражают числом миллиграмм-эквивалентов израсходованной щелочи или кислоты на 1 г сухой смолы. Для определения обменной емкости применяют иониты в водородной и гидроксильной формах. Наиболее полную качественную характеристику ионогенных групп, присутствующих в ионите, дает метод потенциометрического титрования. В основе ионообменной хроматографии лежит обратимый стехио- метрический обмен ионов, содержащихся в хроматографируемом растворе, на ионы веществ, называемых ионитами или ионобменника- ми. Иониты могут быть органические и неорганические, природные и синтетические. По знаку обменивающихся ионов различают катиониты (для обмена катионов) и аниониты (для обмена анионов). К природным ионитам относятся алюмосиликаты, некоторые сорта каменных углей, мягкие и твердые угли даже без предварительной обра- ботки. В аналитической практике широко используют синтетические иониты. Ионообменники получают реакциями поликонденсации либо полимеризации, линейные цепи полимеров разветвлены и связаны друг с другом ≪мостиками≫, например, молекулами дивинилбензола; в состав ионитов входят различные функциональные (ионогенные) группы, кото- рые и определяют наиболее характерные свойства ионитов. Иониты не- растворимы в воде, кислотах, щелочах и во многих органических растворителях, но способны набухать в воде за счет гидрофильных ионогенных групп. Органические катиониты содержат кислотные функциональные группы: – SO3 –, – PO3 –, – COO–, – OH –. Органические аниониты содер- жат группы основного характера: – NH2 +, = NH+, º N+, – N(CH3)3 +. Ка- тиониты представляют собой полиэлектролиты, диссоциирующие с об- разованием высокомолекулярного аниона (например, RSO3 –) и подвиж- ного катиона (например, Н+- иона),легко обменивающегося на другие катионы. Аниониты диссоциируют на высокомолекулярный катион (например, RNH+) и подвижный анион (например, ОН–), способный об- мениваться на другие анионы (R – высокомолекулярный углеводород- ный радикал ионообменной смолы). Реакции ионного обмена можно представить схематично сле-дую- щим образом: RSO3H + CaCl2 Ђ (RSO3)2Ca + 2HCl (катионный обмен) 3 3 3 3 RN(CH ) OH + NaCl Ђ RN(CH ) Cl + NaOH (анионный обмен) Реакции ионного обмена обратимы и в первом приближении под- чиняются закону действующих масс. Важной характеристикой ионита является его обменная емкость. Обменная емкость (ОЕ) – количественная мера способности ионита поглощать противоионы. Численно обменную емкость выражают коли чеством поглощенных миллимоль эквивалентов ионов на 1г сухой смолы в Н+ -форме для катионита и Сl - -форме для анионита. Определение емкости можно отнести и к единице объема набухшего слоя ионита. Обменная емкость, полученная в статических условиях, когда навеску ионита помещают в раствор насыщающего иона определенной концентрации и выдерживают при встряхивании до полного насыщения ионита, называется статической (СОЕ). Величина ее отличается от величины обменной емкости, полученной в динамических условиях при пропускании насыщающего раствора через колонку с ионитом. 2.Объекты определения Ионообменная хроматография широко используется для решения многих биохимических проблем в научных исследованиях. Ионообменная хроматография целесообразна при разделении высокополярных веществ, которые без перевода в производные не могут быть проанализированы методом ГЖХ. К таким соединениям относятся аминокислоты, пептиды, гетероциклические основания, углеводы 3.Условия проведения анализа Ионообменная хроматография в экспериментальном отношении – один из самых трудных видов ВЭЖХ, так как имеется много параметров, которые необходимо учитывать и контролировать. 1)Если анализ необходимо вести при рН ниже 2 или выше 7,5, то должна быть применена соответствующая анионная или катионная смола, а в остальных случаях – силикатель с привитой ионообменной смолой. 2)Для анализа молекул с молекулярной массой до 2000 применяют ионообменники с химически привитой фазой к силикагелю с размером частиц 5–10 мкм, а при препаративном разделении можно применять полимерные пористые сорбенты типа даррум ДА-Х8. При разделении крупных молекул с молекулярной массой 2000 применяют слабоосновный ионит, привитый на крупнопористый силикагель. 3)Скорость элюента обычно устанавливают 1 мл/мин, температуру 50 °С или комнатную, если контроль температуры неудобен, а рН подбирают так, чтобы компоненты были ионизированы. 4)Так как в ионообменной хроматографии изотермы не параллельны, необходимо найти оптимальную для каждого частотного разделения температуру, изменяя ее с инкрементом 10 °С. Обычно придерживаются середины найденного интервала оптимальных температур, контролируя ее с точностью 1 °С. Для создания определенного рН и поддержания на необходимом уровне готовят соответствующий буферный раствор. Если это возможно, то буферный раствор подбирают таким образом, чтобы его функциональная группа была похожа на функциональную группу образца. Так, ацетатный буферный раствор приемлем для анализа карбоновых кислот, фосфатный – для люирования нуклеотидов. Большое значение имеет чистота буферного раствора, так как он не должен детектироваться выбранным детектором, что особенно важно при работе в режиме градиентного элюирования. Чистота буферного раствора зависит от фирм-производителей, и даже разные партии одной фирмы могут различаться по составу. Каждая новая партия буферного раствора тестируется двумя холостыми хроматографическими опытами перед использованием. Второй опыт показывает, существуют ли вещества, отложившиеся в колонке в процессе регенерации или в течение последних стадий предыдущего градиента. Хотя большинство разделений проводят в водных буферных растворах, иногда добавляют органический растворитель (метанол, этанол) в количестве 3–10% для повышения селективности и улучшения растворимости образца. При этом концентрация растворителя не должна быть велика, чтобы не выдать осаждения буферной соли, о чем будет свидетельствовать появление течи в системе и увеличение сопротивления в колонке. При работе в градиентном режиме желательно, чтобы к концу разделения ионная сила буферного раствора повышалась. Начинают работать с концентрации буферного раствора 0,1 M , так как оптимизация разделения при работе с низкими концентрациями (0,001 М) отнимает много времени. Если при этих условиях вещества не удается удовлетворительно разделить, то дальнейшее улучшение разделения происходит за счет снижения концентрации буферного раствора, изменения рН или температуры шаговым методом, приводящих к повышению значений k ' и увеличению времени удерживания. Часто в буферный раствор для регулирования силы подвижной фазы добавляют нейтральные соли. Особой популярностью пользуется нитрат натрия, поскольку он не вызывает коррозии аппаратуры. Галогенид-ионы оказывают вредное влияние на нержавеющую сталь, и поэтому их лучше не применять. 4. Аппаратура 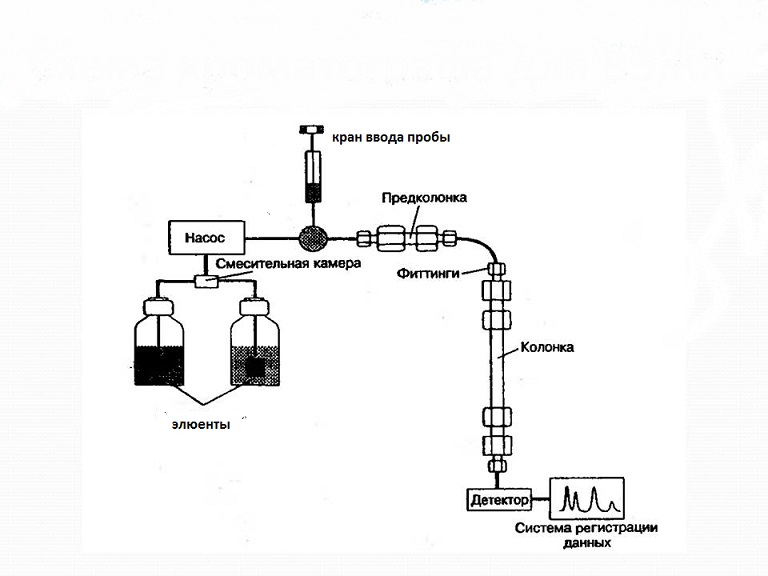 Рис.1 хроматографическая колонка В ионообменной хроматографии ионный обмен проводят в хромато графических колонках, представляющих собой стеклянные трубки с кра ном в нижней части (иногда ‒ это обычные стеклянные бюретки). Ко лонки заполняют заранее приготовленным ионитом в той или иной фор ме и заливают дистиллированной водой (или раствором) так, чтобы верхний уровень жидкости всегда находился на 1‒1,5 см выше уровня иони та. В нижнюю часть колонки перед ее заполнением ионитом помещают стеклянную вату. Для подготовки исходного катионита в Н-форме определенное коли чество катионита (5—10 г с размером частиц 0,2‒0,5 мм) вносят в сосуд (стакан), промывают несколько раз дистиллированной водой, затем ‒ раствором разбавленной хлороводородной кислоты НСl и оставляют смесь катионита и раствора НСl на несколько часов (около 12), периоди чески встряхивая ее. При этом все катионы ионогенных групп катионита замещаются на ионы водорода Н+. После этого катионит промывают дис тиллированной водой до отрицательной реакции на хлорид-ионы (при прибавлении к промывной жидкости одной-двух капель раствора AgNО3 не должно наблюдаться помутнение раствора). При выдерживании с рас твором НСl катионит несколько набухает. Таким образом получают гото вый к употреблению катионит в Н-форме, которым и заполняют колонку, следя за тем, чтобы смола находилась под слоем жидкости. Для подготовки исходного анионита в основной форме его помеща ют в сосуд, промывают несколько раз дистиллированной водой, заливают 5%-ным водным раствором карбоната натрия Na2CО3 или 2%-ным вод ным раствором NaOH и оставляют примерно на 2 часа (в условиях, ис ключающих поглощение углекислого газа из воздуха), периодически встряхивая смесь. Если взятый первоначально анионит находился в соле вой Cl-форме, то после его выдерживания с раствором карбоната натрия или щелочи проверяют раствор на присутствие хлорид-ионов. При необ ходимости операцию выдерживания с раствором соды или щелочи про водят повторно до отрицательной реакции на хлорид-ионы. После этого раствор сливают, анионит промывают (при встряхивании) несколько раз дистиллированной водой. Таким способом получают готовый для работы (несколько набухший) анионит, которым и заполняют колонку (анионит должен находиться под слоем жидкости). В слое ионита не должны находиться пузырьки воздуха. Наполненную ионитом колонку промывают дистиллированной во дой до нейтральной реакции вытекающей жидкости ‒ элюата. В колоночной ионообменной хроматографии применяют методы элюентной (проявительной) и вытеснительной хроматографии. Разделение ионов осуществляется вследствие их неодинакового сродства к сорбенту, различий констант ионного обмена, коэффициентов распределения и связанной с этим разности скоростей перемещения зон, содержащих соответствующие ионы, при их элюировании подвижной фазой. Глубина и скорость ионообменного разделения ионов зависят от природы самих ионов, сорбента, подвижной фазы, температуры, разме ров колонки, физического состояния ионита (размер зерен, предварительная подготовка, степень набухаемости), скорости перемещения под вижной фазы и т. д.  Рис. 2 Выходная хроматографическая кривая 5.Применение в медицине Ионообменную хроматографию широко применяют в медицине, биологии, биохимии, для контроля окружающей среды Ионообменную хроматографию широко применяют в медицине, биологии, биохимии, для контроля окружающей среды, при анализе содержания лекарств и их метаболитов в крови и моче, ядохимикатов в пищевом сырье, а также для разделения неорганических соединений, в том числе радиоизотопов, лантаноидов, актиноидов и др. Анализ биополимеров (белков, нуклеиновых кислот и др.), на который обычно затрачивали часы или дни, с помощью ионообменной хроматографии проводят за 20–40 мин с лучшим разделением. Применение ионообменной хроматографии в биологии позволило наблюдать за образцами непосредственно в биосредах, уменьшая возможность перегруппировки или изомеризации, что может привести к неправильной интерпретации конечного результата. Интересно использование данного метода для контроля изменений, происходящих с биологическими жидкостями. Применение пористых слабых анионообмеников на силикагелевой основе позволило разделить пептиды. |
