Биосинтез аминокислот. Использование мутантов микроорганизмов
 Скачать 103.5 Kb. Скачать 103.5 Kb.
|
|
Содержание
Введение Аминокислоты - это органические кислоты, содержащие одну или несколько аминогрупп, с биологической - важнейшие азотсодержащие вещества в живой клетке. К настоящему времени в природе обнаружено более 300 аминокислот (к началу века их было открыто 17, к середине - 60, а к 1965 году уже больше 170). Все -аминокислоты (кроме глицина) имеют асимметрический -углеродный атом и существуют в двух зеркальных изомерных формах, называемых энантиомерами , L- и D-конфигурации. Энантиомеры обладают одинаковыми химическими свойствами. Их химический синтез завершается обычно получением D,L-изомеров, которые достаточно сложно разделить на индивидуальные изомеры химическим путем, что необходимо для дальнейшего использования аминокислот, поскольку все молекулы белков организма состоят из L- изомеров. Поэтому целесообразней использовать при производстве аминокислот биологический синтез, при котором используемые микроорганизмы образуют аминокислоты в биологически активной L-форме. В настоящее время больше всего разработок посвящено получению лизина (продуценты Brevibacterium lactofermentum и бактерии рода Corynebacterium), также предложены способы биотехнологического получения изолейцина, треонина (при использовании E. coli). Большинство исследованных штаммов микроорганизмов независимо от их систематического положения преимущественно накапливают α-аланин и глутаминовую кислоту. Значительно меньше штаммов и в меньшем количестве выделяют аспарагиновую кислоту, лейцин, валин, изолейцин, лизин. Использование мутантов микроорганизмов Обычные микроорганизмы не способны синтезировать необходимые аминокислоты в нужном количестве, поэтому работы по микробному синтезу аминокислот состояли в прямой селекции штаммов микроорганизмов, способных накапливать аминокислоты в значительных количестве при росте на средах с большим количеством углерода и меньшим количеством углерода. В этом случае аминокислоты накапливаются в результате нарушения равновесия между углеродным и метаболизмом и ассимиляцией азота. Впоследствии были использованы мутанты микроорганизмов. Многие из них продуцируют одни аминокислоты, но являются дефицитными по другим аминокислотам и витаминам. Для получения мутантов микроорганизмов используют химические и физические мутагены. К химическим мутагенам относятся этиленамин, новоэмбихин, диэтилсульфат, радиоактивные изотопы, тяжелый водород, сильные окислители (HNO3, KmnO4); к физическим – рентгеновские лучи, ультрафиолетовые лучи, температурное воздействие. Для получения любой аминокислоты путем микробного синтеза необходимо, чтобы выбранный микроорганизм обладал таким обменом веществ, который обеспечивал бы эффективное превращение источника углерода в одну аминокислоту. Обычно такая особенность микроорганизма настолько неблагоприятна для его выживания, что спонтанно возникающие в природных условиях мутанты неизбежно должны отсеяться в процессе естественного отбора. Поиски подходящих микроорганизмов идут по двум основным линиям. Во-первых, микроорганизмы разных видов – дрожжи, бактерии, грибы – проверяют на их способность накапливать желаемую аминокислоту в культуральной жидкости. Во-вторых, наиболее активные штаммы пытаются затем улучшить, применяя различные мутагенные факторы. В группу мутантов микроорганизмов с измененными биологическими свойствами входят ауксотрофные мутанты и продуценты биологически активных веществ. Ауксотрофными мутантами называют мутанты, потерявшие способность в связи с нарушением нормальных биосинтетических процессов самостоятельно синтезировать те или иные аминокислоты, пурины, пиримидины, витамины. Дефицитность ауксотрофных мутантов по определенным веществам связана с нарушением нормального хода биосинтетических реакций и блокированием отдельных этапов синтеза. В результате блокирования получение конечных продуктов становится невозможным и происходит накопление веществ, получаемых в реакциях, предшествующих блоку. Ауксотрофные мутанты являются патологическими формами, неспособными существовать в обычных условиях, поэтому их культивирование требует поддержания особых условий. Промышленный синтез аминокислот. Способность микроорганизмов выделять в культуральную жидкость продукты обмена, в том числе и аминокислоты, известна с конца прошлого столетия, однако интенсивное изучение внеклеточного накопления аминокислот микроорганизмами, как указывалось выше, началось в 60-е годы нашего века. Состав аминокислот, накапливаемых различными микроорганизмами в средах, довольно однообразен. Это — глутаминовая и аспарагиновая кислоты, аланин, лейцин, изолейцин, глицин, серин, фенилаланин, лизин. Чаще всего встречаются продуценты глутаминовой кислоты и аланина. Свежевыделенные из естественных субстратов штаммы микроорганизмов чаще всего выделяют аланин и глутаминовую кислоту. ли гл кислоту и аланин, из 310 аШтаммы, образующие лизин, встречаются редко, триптофан — еще реже. Возможны три способа промышленного получения незаменимых аминокислот: гидролиз белков растительного и микробного происхождения, микробиологический и химический синтез. Более 60% всех производимых промышленностью чистых препаратов аминокислот получают путем микробиологического синтеза. На втором месте по объему производства находится химический синтез. Основным недостатком химического синтеза является получение смеси аминокислот, состоящих из изомеров D- и L-ряда, тогда как биологической активностью в организме человека и животных обладают лишь L-изомеры. D-изомеры аминокислот не перерабатываются их ферментными системами, а некоторые из них токсичны. Исключением является аминокислота метионин, у которой биологически активными является и D- и L- изомеры, поэтому данную аминокислоту производят преимущественно путем химического синтеза. Технологии получения аминокислот за счет гидролиза белков экономически менее выгодны, поэтому не получили широкого распространения. При микробиологическом синтезе образуются L-аминокислоты, являющиеся продуктами жизнедеятельности специально подобранных и отселектированных штаммов микроорганизмов, которые способны накапливать в культуральной жидкости не менее 60 г/л синтезируемой аминокислоты. Чаще всего для микробиологического синтеза аминокислот используют ауксотофные мутантные штаммы, которые получают методами обычной селекции и генной инженерии. С помощью мутагенных факторов у таких ауксотрофных штаммов индуцируется мутация, в результате которой прекращается или ингибируется синтез одного из продуктов, оказывающих регуляторное влияние на ферментные системы, катализирующие образование данной аминокислоты в клетках мутанта и в культуральной жидкости повышается. На основе культивирования микроорганизмов с целью получения чистых препаратов аминокислот применяют промышленные технологии, включающие одно- и двухступенчатый синтез аминокислот. При одноступенчатом синтезе в промышленных культиваторах выращивают ауксотрофные регуляторные мутанты, являющиеся сверхпродуцентами тех или иных аминокислот. После завершения рабочего цикла их выращивания культуральную жидкость отделяют от клеток микроорганизмов, сгущают и получают из нее товарной продукт с высокой концентрацией синтезированной микробами аминокислоты. В процессе двухступенчатого синтеза аминокислоты вначале получают ее предшественник, а затем с помощью ферментов микроорганизмов превращают предшественника в аминокислоту, при этом образуются только L- изомеры. В качестве источника фермента могут быть использованы либо суспензия клеток микроорганизмов, либо полученный после разрушения этих клеток ферментный раствор. Микробиологический синтез глутаминовой кислоты. Глутаминовая кислота в значительных количествах присутствует в микробных клетках и принимает участие в образовании различных продуктов их метаболизма. Глутамат натрия широко используют в качестве приправы к пище, а глутаминовую кислоту применяют для лечения трофических нарушений обмена веществ. Для производства L-глутомата используют культуры Brevibacterium. Оптимальным является использование среды, содержащей 10% глюкозы, накоплению L-глутомата способствуют энергичная аэрация и перемешивание, средняя температура инкубации 300, рН 6,0 – 8,0. В культуральную жидкость периодически добавляют мочевину. В качестве источников сахара используют сырой гидролизат древесины и мелассу. Все бактерии нуждаются в биотине как факторе роста и выход L-глутомата в их культурах зависит от концентрации биотина в среде. Схема биосинтеза L-глутомата 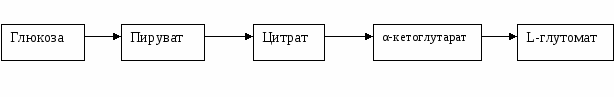 Глутаминовая кислота играет весьма важную роль в обмене веществ организмов, так как лежит на путях синтеза различных соединений. Микробиологический синтез лизина, метионина, треонина и изолейцина. Белки зерна, пшеницы, ячменя, кукурузы и других злаковых культур не сбалансированы по содержанию незаменимых аминокислот и, прежде всего, лизина. Поэтому для удовлетворения потребностей животноводства в лизине в нашей стране и ряде других стран организовано его крупномасштабное производство. В основу производства положены технологии с использованием одноступенчатого микробиологического синтеза, которые включают промышленное культивирование ауксотрофных мутантов бактерий из рода Corynebacterium, способных к сверхсинтезу этой аминокислоты. Обычно у диких штаммов, из которых получены ауксотрофные мутанты, сверхсинтеза лизина не наблюдается, так как у них действуют механизмы саморегуляции. В клетках бактерий аминокислота лизин синтезируется из аспарагиновой кислоты через ряд промежуточных этапов, связанных с образованием полуальдегида аспарагиновой кислоты, дигидропиколиновой кислоты и α,ε-диаминопимелиновой кислоты, являющейся непосредственным предшественником лизина. Полуальдегид аспарагиновой кислоты является также одним из предшественников в синтезе аминокислот – треонина, метионина и изолейцина (схема 1). Процесс синтеза аминокислот (лизина, треонина, метионина и изолейцина) начинается фосфорилированием аспарагиновой кислоты с участием аллостерического фермента аспартаткиназы, активность которого ингибируется совместным действием двух аминокислот – лизина и треонина, если они накапливаются в клетках бактерий в избыточной концентрации. Если понизить концентрацию одной из этих аминокислот, то синтез другой будет осуществляться даже при условии, когда она накапливается в довольно высокой концентрации. Лизин Изолейцин     Схема 1 Схема 1 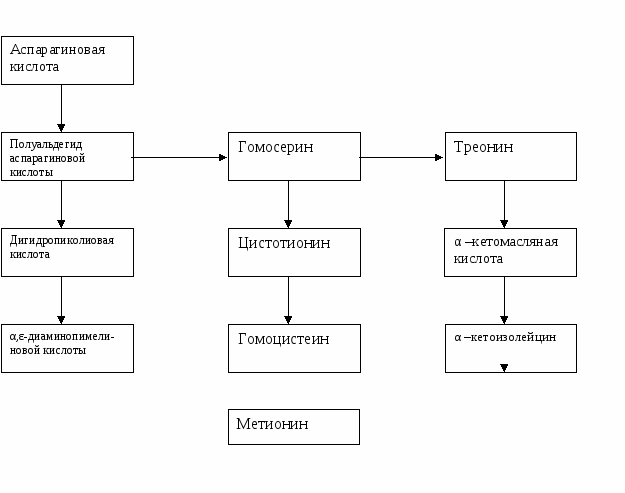 Для снятия регуляции синтеза лизина необходимо прекратить образование треонина на стадии превращения полуальдегида аспарагиновой кислоты в гомосерин, катализируемое ферментом гомосериндегидрогеназой. Последнее достигается посредством мутагенеза. Опыты показывают, что мутантные клетки, не образующие гомосериндегидрогеназы, при их культивировании на искусственной питательной среде обеспечивают высокий выход лизина. Дефицитные аминокислоты, которые не синтезируются мутантными клетками (гомсерин, треонин, метионин), вводятся в состав питательной среды в таком количестве, чтобы они не были регуляторами синтеза лизина. В процессе приготовления питательной среды для культивирования производственных штаммов ауксотрофных мутантов, обладающих способностью к сверхсинтезу аминокислоты лизина, в качестве источника углерода обычно используют смеси, включающие уксусную кислоту и свекловичную мелассу, в качестве источника азота – соли аммония, мочевину, кукурузный экстракт, гидролизаты дрожжей. Кроме дефицитных аминокислот, которые не синтезируются клетками мутантов, в питательную среду также добавляют необходимые для жизнедеятельности микроорганизмов макро- и микроэлементы и витамины. В процессе культивирования микроорганизмов обеспечивается подача стерильного воздуха с помощью специальных турбинных мешалок, для предотвращения вспенивания субстрата и клеточной суспензии в среду культивирования добавляют пеногаситель. Посевной материал, предназначенный для производственной ферментации, вначале выращивают в посевных аппаратах при 28 – 32ºС, рН 7 – 7,2 в течение 18 – 24 ч, а затем полученная таким путем суспензия клеток подается в производственные ферментеры емкостью 50 – 100 м3, в которых поддерживается постоянный режим аэрации, необходимое давление, контроль за всеми компонентами и параметрами среды. Время ферментации 55 – 72 ч. Накопление в культуральной жидкости лизина начинается после 25 – 30 ч выращивания промышленной культуры и к концу ферментации достигает 40 – 50 г/л. Культуральную жидкость отделяют от культуры клеток продуцента фильтрованием и используют для получения препаратов лизина. На основе промышленной культуры синтезирующих лизин бактерий организовано производство нескольких видов товарной продукции: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), высококонцентрированные кормовые и высокоочищенные кристаллические препараты для пищевой и медицинской промышленности. Жидкий концентрат лизина получают путем упариванием культуральной жидкости на вакуумной установке до концентрации сухого вещества 40%. Для предотвращения деградации лизина в процессе нагревания в культуральную жидкость добавляют бисульфит натрия и соляную кислоту до рН 4,5 – 5,0, в результате чего образуется соль – монохлоргидрат лизина. Для получения сухого концентрата лизина сушат горячим воздухом на распылительной сушилке при 90ºС до влажности препарата 4 – 8 %. В целях снижения гигроскопичности препарата в него добавляют наполнители: мясокостную муку, негашеную известь, бентонит, пшеничные отруби. Чаще всего в качестве наполнителя используют отруби, которые добавляют в ЖКЛ после упаривания. Полученную в результате тщательного перемешивания пасту высушивают на вальцово-ленточной сушилке и гранулируют. Гранулированный препарат ККЛ негигроскопичен, содержит 7 -10% лизина. Для получения очищенного высококонцентрированного препарата лизина культуральную жидкость после фильтрования подкисляют соляной кислотой до рН 1,6 – 2,0. Образовавшийся в результате взаимодействия с соляной кислотой раствор монохлоргидрата лизина направляют на колонки с катионитом, где происходит сорбция аминокислоты и отделение ее от культуральной жидкости. Затем проводят десорбцию аминокислоты путем элюирования 0,5 – 5%-ным раствором аммиака. Элюат упаривают под вакуумом при 60ºС до концентрации сухого вещества 30 – 50%, после чего подкисленный соляной кислотой раствор монохлоргидрата высушивают и используют как кормовой концентрат. Путем перекристаллизации полученной соли можно получить препараты лизина с содержанием монохлоргидрата 97 – 98%. В процессе производства лизина кроме основного продукта применение находят также побочные продукты и отходы. Так, после отделения культуральной жидкости в осадке остаются клетки бактерий – продуцентов, фосфаты и другие компоненты питательной среды, которые после высушивания могут быть использованы в качестве кормовой белковой добавки. Технологические стоки и промывные воды после выделения монохлоргидрата лизина, содержащие в растворенном состоянии аминокислоты, другие ценные компоненты культуральной жидкости, остаточный лизин, объединяют и полученную смесь упаривают, а затем высушивают с наполнителем до влажности 10%, в результате получают кормовой препарат с высоким содержанием белков (до 40%) и незаменимых аминокислот. В ряде стран (Япония, США) для получения лизина применяется химико-энзиматический метод, позволяющий создать высокоэффективные технологии, сочетающие достоинства химического и микробиологического синтеза. Эти технологии основаны на ферментативной конверсии в лизин α-амино-ε-капролактама, который получают путем химических реакций из циклогексана. В результате химического синтеза образуется рацемическая смесь D- и L-капролактама. Эта смесь направляется в реактор с ферментом гидролазой α-амино-ε-капролактама, который катализирует превращение L- капролактама в L-лизин. D-изомер капролактама далее превращается в L-изомер с помощью специфической рацемазы. При такой технологии получения лизина его содержание в реакционной смеси по завершении рабочего цикла достигает свыше 150 г/л. Продуцентами гидролазы α-амино-ε-капролактама служат некоторые штаммы дрожжей из родов Cryptococcus, Candida, Trichosporon. Дрожжи выращиваются в щелочной среде на оптимизированной для синтеза фермента питательной среде, содержащей активаторы – Mn2+, Mg2+, Zn2+. Для ферментативной реакции превращения капролактама в лизин может использоваться клеточная суспензия дрожжевых клеток с активным ферментом, клеточный экстракт (после разрушения и отделения клеток) или очищенный фермент. Рацемазу, катализирующую превращение D-капролактама в L-изомер, получают из бактерий Achromobacter, Flavobacterium и др. Процессы изомеризации D-капролактама в L-изомер и превращение L –капролактама в лизин можно проводить одновременно. Для этого в водный раствор D,L-капролактама вводится необходимое количество дрожжевых и бактериальных клеток, задаются оптимальные режимы температуры, рН, аэрации. На выходе из реактора образуется преимущественно один продукт - L-лизин, который выделяют из смеси и далее выделяют и сушат. Кроме изложенной выше технологии получения чистых препаратов лизина разрабатываются и другие, сочетающие в себе использование химического синтеза для получения предшественников лизина и энзиматическое превращение их в лизин на конечной стадии производства, что позволяет значительно интенсифицировать производственный процесс и снизить себестоимость продукции. Для снятия регуляции синтеза лизина необходимо прекратить образование треонина на стадии превращения полуальдегида аспарагиновой кислоты в гомосерин, катализируемое ферментом гомосериндегидрогеназой. Последнее достигается посредством мутагенеза. Опыты показывают, что мутантные клетки, не образующие гомосериндегидрогеназы, при их культивировании на искусственной питательной среде обеспечивают высокий выход лизина. Дефицитные аминокислоты, которые не синтезируются мутантными клетками (гомсерин, треонин, метионин), вводятся в состав питательной среды в таком количестве, чтобы они не были регуляторами синтеза лизина. В процессе приготовления питательной среды для культивирования производственных штаммов ауксотрофных мутантов, обладающих способностью к сверхсинтезу аминокислоты лизина, в качестве источника углерода обычно используют смеси, включающие уксусную кислоту и свекловичную мелассу, в качестве источника азота – соли аммония, мочевину, кукурузный экстракт, гидролизаты дрожжей. Кроме дефицитных аминокислот, которые не синтезируются клетками мутантов, в питательную среду также добавляют необходимые для жизнедеятельности микроорганизмов макро- и микроэлементы и витамины. В процессе культивирования микроорганизмов обеспечивается подача стерильного воздуха с помощью специальных турбинных мешалок, для предотвращения вспенивания субстрата и клеточной суспензии в среду культивирования добавляют пеногаситель. Посевной материал, предназначенный для производственной ферментации, вначале выращивают в посевных аппаратах при 28 – 32ºС, рН 7 – 7,2 в течение 18 – 24 ч, а затем полученная таким путем суспензия клеток подается в производственные ферментеры емкостью 50 – 100 м3, в которых поддерживается постоянный режим аэрации, необходимое давление, контроль за всеми компонентами и параметрами среды. Время ферментации 55 – 72 ч. Накопление в культуральной жидкости лизина начинается после 25 – 30 ч выращивания промышленной культуры и к концу ферментации достигает 40 – 50 г/л. Культуральную жидкость отделяют от культуры клеток продуцента фильтрованием и используют для получения препаратов лизина. На основе промышленной культуры синтезирующих лизин бактерий организовано производство нескольких видов товарной продукции: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ), высококонцентрированные кормовые и высокоочищенные кристаллические препараты для пищевой и медицинской промышленности. Жидкий концентрат лизина получают путем упариванием культуральной жидкости на вакуумной установке до концентрации сухого вещества 40%. Для предотвращения деградации лизина в процессе нагревания в культуральную жидкость добавляют бисульфит натрия и соляную кислоту до рН 4,5 – 5,0, в результате чего образуется соль – монохлоргидрат лизина. Для получения сухого концентрата лизина сушат горячим воздухом на распылительной сушилке при 90ºС до влажности препарата 4 – 8 %. В целях снижения гигроскопичности препарата в него добавляют наполнители: мясокостную муку, негашеную известь, бентонит, пшеничные отруби. Чаще всего в качестве наполнителя используют отруби, которые добавляют в ЖКЛ после упаривания. Полученную в результате тщательного перемешивания пасту высушивают на вальцово-ленточной сушилке и гранулируют. Гранулированный препарат ККЛ негигроскопичен, содержит 7 -10% лизина. Для получения очищенного высококонцентрированного препарата лизина культуральную жидкость после фильтрования подкисляют соляной кислотой до рН 1,6 – 2,0. Образовавшийся в результате взаимодействия с соляной кислотой раствор монохлоргидрата лизина направляют на колонки с катионитом, где происходит сорбция аминокислоты и отделение ее от культуральной жидкости. Затем проводят десорбцию аминокислоты путем элюирования 0,5 – 5%-ным раствором аммиака. Элюат упаривают под вакуумом при 60ºС до концентрации сухого вещества 30 – 50%, после чего подкисленный соляной кислотой раствор монохлоргидрата высушивают и используют как кормовой концентрат. Путем перекристаллизации полученной соли можно получить препараты лизина с содержанием монохлоргидрата 97 – 98%. В процессе производства лизина кроме основного продукта применение находят также побочные продукты и отходы. Так, после отделения культуральной жидкости в осадке остаются клетки бактерий – продуцентов, фосфаты и другие компоненты питательной среды, которые после высушивания могут быть использованы в качестве кормовой белковой добавки. Технологические стоки и промывные воды после выделения монохлоргидрата лизина, содержащие в растворенном состоянии аминокислоты, другие ценные компоненты культуральной жидкости, остаточный лизин, объединяют и полученную смесь упаривают, а затем высушивают с наполнителем до влажности 10%, в результате получают кормовой препарат с высоким содержанием белков (до 40%) и незаменимых аминокислот. В ряде стран (Япония, США) для получения лизина применяется химико-энзиматический метод, позволяющий создать высокоэффективные технологии, сочетающие достоинства химического и микробиологического синтеза. Эти технологии основаны на ферментативной конверсии в лизин α-амино-ε-капролактама, который получают путем химических реакций из циклогексана. В результате химического синтеза образуется рацемическая смесь D- и L-капролактама. Эта смесь направляется в реактор с ферментом гидролазой α-амино-ε-капролактама, который катализирует превращение L- капролактама в L-лизин. D-изомер капролактама далее превращается в L-изомер с помощью специфической рацемазы. При такой технологии получения лизина его содержание в реакционной смеси по завершении рабочего цикла достигает свыше 150 г/л. Продуцентами гидролазы α-амино-ε-капролактама служат некоторые штаммы дрожжей из родов Cryptococcus, Candida, Trichosporon. Дрожжи выращиваются в щелочной среде на оптимизированной для синтеза фермента питательной среде, содержащей активаторы – Mn2+, Mg2+, Zn2+. Для ферментативной реакции превращения капролактама в лизин может использоваться клеточная суспензия дрожжевых клеток с активным ферментом, клеточный экстракт (после разрушения и отделения клеток) или очищенный фермент. Рацемазу, катализирующую превращение D-капролактама в L-изомер, получают из бактерий Achromobacter, Flavobacterium и др. Процессы изомеризации D-капролактама в L-изомер и превращение L –капролактама в лизин можно проводить одновременно. Для этого в водный раствор D,L-капролактама вводится необходимое количество дрожжевых и бактериальных клеток, задаются оптимальные режимы температуры, рН, аэрации. На выходе из реактора образуется преимущественно один продукт - L-лизин, который выделяют из смеси и далее выделяют и сушат. Кроме изложенной выше технологии получения чистых препаратов лизина разрабатываются и другие, сочетающие в себе использование химического синтеза для получения предшественников лизина и энзиматическое превращение их в лизин на конечной стадии производства, что позволяет значительно интенсифицировать производственный процесс и снизить себестоимость продукции.Микробиологический синтез триптофана. Наряду с лизином разработаны промышленные технологии получения кормовых и высокоочищенных препаратов другой незаменимой аминокислоты – триптофана. Для производства этой аминокислоты применяют как одноступенчатый синтез с помощью бактериальных ауксотрофных мутантов с нарушенной регуляцией синтеза аминокислот, так и двухступенчатый синтез, включающий вначале получения предшественника триптофана, а затем его ферментативное превращение в конечный продукт – триптофан. У бактерий и многих других организмов аминокислота триптофан образуется из эритрозо-4-фосфата и фосфоенолпировиноградной кислоты через ряд последовательных реакций, включающих образование шикимовой и хоризмовой кислот, а непосредственным предшественником триптофана в процессе его синтеза является антраниловая кислота. Синтез триптофана аллостерически ингибируется конечными продуктами, которые действуют на ферменты, катализирующие начальные этапы превращений, связанные с образованием хоризмовой кислоты. Для смещения метаболических реакций по пути преимущественного образования триптофана необходимо блокировать превращение хоризмовой кислоты в префеновую( схема 2). Это достигается действием мутагенных факторов. У мутантов с пониженной активностью ферментов, катализирующих превращение хоризмовой кислоты в префеновую, наблюдается повышенный синтез аминокислоты триптофана, однако для нормального развития этих мутантов в питательную среду необходимо добавлять дефицитные аминокислоты – фенилаланил и тирозин – в количествах, не вызывающих регуляторное ингибирование ферментов синтеза триптофана. Для промышленного получения триптофана разработаны технологии на основе использования ауксотрофных мутантов бактерий Basccillus sibtilis с нарушенным синтезом фенилаланина и тирозина. Схема 2  Фосфопируват 5-дигидрохинная кислота Шикимовая кислота Хоризмовая кислота Префеновая кислота Фенилпировиноградная кислота Фенилаланин Эритрозо-4-фосфат Антраниловая кислота n-оксифенилпирови-ноградная кислота Тирозин Триптофан              Все технологические организованы примерно по такой же схеме, как и получение лизина с помощью мутантов коринебактерий. Ферментация длится 48 часов при 37°С, концентрация триптофана в культуральной жидкости достигает 10 г/л. После отделения культуральной жидкости от клеток бактерий она упаривается и высушивается при 110-120°С. Высушенный продукт называют кормовым концентратом триптофана (ККТ). При получении высококонцентрированных препаратов триптофана культуральную жидкость подвергают дополнительной очистке. Вначале ее подкисляют соляной кислотой до рН 1,0 и затем центрифугированием отделяют образовавшийся осадок. Далее цетрифугат, содержащий триптофан, пропускают через ионо-обменные колонки с катионитом, в результате происходит связывание аминокислоты и, таким образом, отделение ее от культуральной жидкости. После промывки колонок производят десорбцию триптофана 5%-ным раствором аммиака в смеси изопропанола и воды. Элюат направляют на вакуумный выпариватель, после чего кристаллизуют аминокислоту при 4 – 8ºС. Выделенную в кристаллическом виде соль триптофана промывают этанолом и высушивают под вакуумом при 60ºС. Высушенный кристаллический препарат содержит не менее 99% триптофана в виде его хлорида. Осадок после отделения культуральной жидкости, содержащий клетки культуры бактерий, также высушивают и используют как высокобелковую кормовую добавку, содержащую, кроме того, повышенное количество триптофана. Синтез триптофана в нашей стране производится преимущественно по двухступенчатой схеме. Вначале методом химического синтеза получают предшественник триптофана – антраниловую кислоту, которую затем с участием ферментов микробного происхождения превращают в триптофан. Биохимическое превращение антраниловой кислоты в триптофан проходит в три этапа. На первом этапе из антраниловой кислоты с участием фосфорибозилфосфата образуется аминогликозид – N- (5´-фосфорибозил) – антраниловая кислота, которая в результате внутримолекулярной перегруппировки и декарбоксилирования превращается в индол-3-глицерофосфат. На последнем этапе под действием фермента триптофансинтетазы из индол-3-глицерофосфата и аминокислоты серина образуется триптофан. В связи с тем, что в качестве активной группы у фермента триптофансинтетазы служит пиридоксальфосфат, от наличия в среде этого кофермента зависит скорость превращения антраниловой кислоты в триптофан. В качестве источника ферментов для указанных реакций используются дрожжи C. Utilis. Производственный процесс биохимического превращения антраниловой кислоты в триптофан проводится в две стадии. На первой стадии производится наращивание биомассы дрожжей, являющихся продуцентами ферментов. Питательная среда для выращивания дрожжей готовится из свекловичной мелассы, мочевины и минеральных солей. Ферментация продолжается в течение 24 ч при 30ºС. Далее в ферментер начинают вводить спиртовой 5%-ный раствор антраниловой кислоты и 50%-ный раствор мочевины. Через 3 – 4 ч после добавления антраниловой кислоты в ферментер дополнительно подается углеродный субстрат – меласса в виде 25%-ного раствора. На последующих этапах ферментации периодически производится подача антраниловой кислоты и мочевины через каждые 6 ч и раствора мелассы – через каждые 12 ч. Длительность ферментации около 120 ч, а с учетом времени наращивания биомассы дрожжей – 144 ч. Содержание триптофана в культуральной жидкости составляет 0,3 – 0,5 % или примерно 6 г/л. Все технологические организованы примерно по такой же схеме, как и получение лизина с помощью мутантов коринебактерий. Ферментация длится 48 часов при 37°С, концентрация триптофана в культуральной жидкости достигает 10 г/л. После отделения культуральной жидкости от клеток бактерий она упаривается и высушивается при 110-120°С. Высушенный продукт называют кормовым концентратом триптофана (ККТ). При получении высококонцентрированных препаратов триптофана культуральную жидкость подвергают дополнительной очистке. Вначале ее подкисляют соляной кислотой до рН 1,0 и затем центрифугированием отделяют образовавшийся осадок. Далее цетрифугат, содержащий триптофан, пропускают через ионо-обменные колонки с катионитом, в результате происходит связывание аминокислоты и, таким образом, отделение ее от культуральной жидкости. После промывки колонок производят десорбцию триптофана 5%-ным раствором аммиака в смеси изопропанола и воды. Элюат направляют на вакуумный выпариватель, после чего кристаллизуют аминокислоту при 4 – 8ºС. Выделенную в кристаллическом виде соль триптофана промывают этанолом и высушивают под вакуумом при 60ºС. Высушенный кристаллический препарат содержит не менее 99% триптофана в виде его хлорида. Осадок после отделения культуральной жидкости, содержащий клетки культуры бактерий, также высушивают и используют как высокобелковую кормовую добавку, содержащую, кроме того, повышенное количество триптофана. Синтез триптофана в нашей стране производится преимущественно по двухступенчатой схеме. Вначале методом химического синтеза получают предшественник триптофана – антраниловую кислоту, которую затем с участием ферментов микробного происхождения превращают в триптофан. Биохимическое превращение антраниловой кислоты в триптофан проходит в три этапа. На первом этапе из антраниловой кислоты с участием фосфорибозилфосфата образуется аминогликозид – N- (5´-фосфорибозил) – антраниловая кислота, которая в результате внутримолекулярной перегруппировки и декарбоксилирования превращается в индол-3-глицерофосфат. На последнем этапе под действием фермента триптофансинтетазы из индол-3-глицерофосфата и аминокислоты серина образуется триптофан. В связи с тем, что в качестве активной группы у фермента триптофансинтетазы служит пиридоксальфосфат, от наличия в среде этого кофермента зависит скорость превращения антраниловой кислоты в триптофан. В качестве источника ферментов для указанных реакций используются дрожжи C. Utilis. Производственный процесс биохимического превращения антраниловой кислоты в триптофан проводится в две стадии. На первой стадии производится наращивание биомассы дрожжей, являющихся продуцентами ферментов. Питательная среда для выращивания дрожжей готовится из свекловичной мелассы, мочевины и минеральных солей. Ферментация продолжается в течение 24 ч при 30ºС. Далее в ферментер начинают вводить спиртовой 5%-ный раствор антраниловой кислоты и 50%-ный раствор мочевины. Через 3 – 4 ч после добавления антраниловой кислоты в ферментер дополнительно подается углеродный субстрат – меласса в виде 25%-ного раствора. На последующих этапах ферментации периодически производится подача антраниловой кислоты и мочевины через каждые 6 ч и раствора мелассы – через каждые 12 ч. Длительность ферментации около 120 ч, а с учетом времени наращивания биомассы дрожжей – 144 ч. Содержание триптофана в культуральной жидкости составляет 0,3 – 0,5 % или примерно 6 г/л. Заключение В настоящее время в животноводстве стоит проблема балансирования кормовых рационов по полноценному протеину. Натуральные корма, используемые в животноводстве, имеют не оптимальный аминокислотный состав. Для доведения концентрации аминокислот в кормовом рационе до оптимума требуется добавление препаратов чистых аминокислот, особенно незаменимых, полученных промышленным способом. В мире ежегодно производится не менее 300 тыс.т. кормовых препаратов незаменимых аминокислот. В пищевой промышленности также используются аминокислоты, полученные путем микробиологического синтеза, например, глутаминовая кислота. Некоторые аминокислоты, например метионин, используются в фармацевтической промышленности для производства диетических пищевых добавок. Метионин в последнее время применяется в качестве подкормке в птицеводстве. Список используемой литературы
|
