Электрохим. ОНЛАЙН УЧЕБНИК_ЭЛЕКТРОХИМИЯ_ПЕРЕВОД САЙТА (1). Исследование окислительновосстановительных реакций Практика с окислительновосстановительными реакциями
 Скачать 3.58 Mb. Скачать 3.58 Mb.
|
|
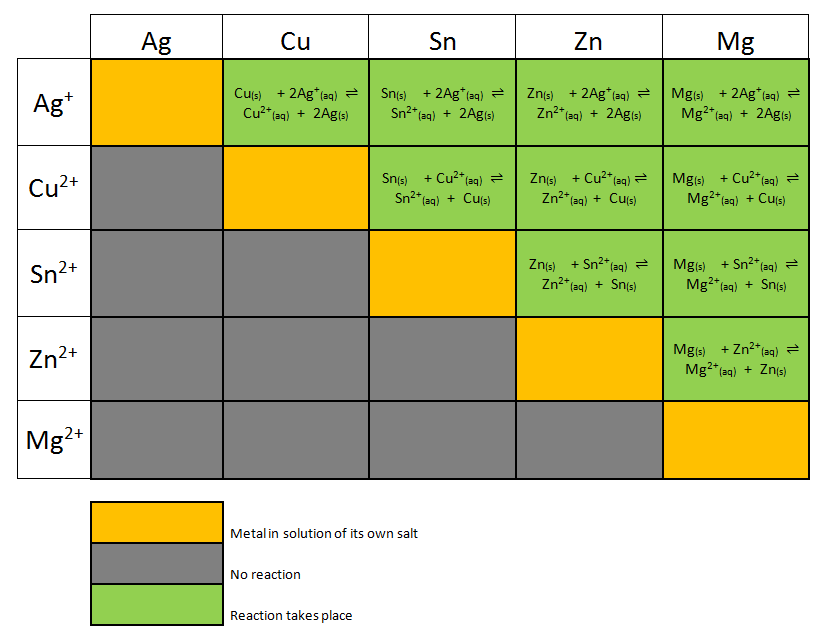
http://chemcollective.org/chem/electrochem/index.php Электрохимия-Введение Этап 1: - Исследование окислительно-восстановительных реакций - Практика с окислительно-восстановительными реакциями - Восстановительные тенденции ионов металлов Этап 2: -Перенос электронов -Электрохимическая ячейка - Практика с ячейками - Cнабжение энергией секундомера Этап 3: - Измерение потенциалов - Вычисление потенциалов - Практика с потенциалами - Применение потенциалов Этап 4: - Нестандартные условия - Практика с нестандартными ячейками форма обратной связи: - Скачать Форму Активности Электрохимия: гальванические элементы (ячейки) и уравнение Нернста Введение  В этом эксперименте цель состоит в том, чтобы исследовать, как генерировать электрический ток из самопроизвольной окислительно-восстановительной химической реакции. Устройство, в котором химическая энергия преобразуется в электрическую называется гальваническим элементом (ячейкой)*. Батарейки являются повседневным примером гальванических элементов (ячеек). В этом эксперименте цель состоит в том, чтобы исследовать, как генерировать электрический ток из самопроизвольной окислительно-восстановительной химической реакции. Устройство, в котором химическая энергия преобразуется в электрическую называется гальваническим элементом (ячейкой)*. Батарейки являются повседневным примером гальванических элементов (ячеек).Договоримся о терминах: Электрохимическая ячейка (элемент) = это устройство, способное либо генерировать электрическую энергию в результате химических реакций, либо использовать электрическую энергию для возникновения химических реакций. Электрохимические ячейки, которые генерируют электрический ток, называются гальваническими элементами или Вольтовой цепью, а те, которые генерируют химические реакции, например, посредством электролиза, называются электролизерами. В этом эксперименте: Мы построим и исследуем несколько гальванических элементов (ячеек). Мы будем исследовать химические реакции, происходящие в различных гальванических элементах (ячейках) и измерять потенциалы ячеек*. Мы будем изучать электроды, которые могут быть объединены различными способами для того, чтобы образовывать множество различных гальванических элементов (ячеек). Мы определим потенциал этих ячеек в стандартных условиях . Мы исследуем, как изменяется потенциал гальванического элемента (ячейки), когда мы отходим от условий, определенных как "стандартные", и используем уравнение Нернста для прогнозирования этих изменений. Договоримся о терминах: Потенциал ячейки = Электродвижущая сила (ЭДС) гальванического элемента (ячейки) = Напряжение гальванического элемента = [Вольт] = Потенциал катода минус Потенциал Анода Экспериментальная стратегия показана ниже в следующих 4 этапах: Этап 1  Действие: окуните полоску металла в солевой раствор другого металла. Повторите с различными комбинациями металла/соли. Действие: окуните полоску металла в солевой раствор другого металла. Повторите с различными комбинациями металла/соли.Результат: полученные наблюдения свидетельствуют о том, имеет ли место самопроизвольная реакция или нет. Если реакция наблюдается, мы можем использовать наши знания об участвующих в реакции химических частицах для понимания химической реакции. Этап 2 Действие: создать несколько полуячеек*, каждая из которых состоит из металлической полоски (электрода), погруженной в раствор соли того же металла (раствор электрода). Объединить различные полуэлементы в пары (гальванические элементы) и попробовать их, чтобы снабдить энергией («запитать») секундомер. Результат: мы определяем гальванические элементы, которые обеспечивают достаточное напряжение для питания секундомера. Договоримся о терминах: Полуячейка = Полуэлемент = Один электрод, опущенный в электролит Две полуячейки образуют ячейку или элемент Этап 3 Действие: объедините различные полуэлементы в пары (гальванические элементы) и измерьте напряжение различных пар полуэлементов. Результат: создайте серию электродных потенциалов, расположенных в порядке убывания склонности иона металла к восстановлению. (Примечание: от самых активных к самым пассивным). Этап 4 Действие: мы измеряем напряжение тока ячейки при стандартных условиях (концентрация 1,0 M или 1,0 моль/л). Мы меняем концентрацию одной из полуячеек (полуэлементов) и наблюдаем эффект (влияние) на напряжение тока всей ячейки. Мы повторяем с различными комбинациями полуячеек. Результат: мы определили значения напряжения ячейки в нестандартных условиях. На следующих страницах содержатся упражнения, которые помогут вам понять и применить некоторые концепции, необходимые для выполнения описанных выше этапов. Пожалуйста, нажмите кнопку «Далее», чтобы продолжить онлайн работу. Этап 1: исследование окислительно-восстановительных реакций Электрохимия: гальванические элементы и уравнение НернстаЭтап 1: - исследование окислительно-восстановительных реакций некоторых металлов и растворов солей металловЭлектрохимия часто определяется как изучение взаимообмена химической и электрической энергии. На этом этапе мы рассмотрим один из аспектов этого процесса: образование электрического тока из самопроизвольной окислительно-восстановительной (редокс) реакции (ОВР). На этом этапе мы будем исследовать окислительно-восстановительные реакции между металлами и растворами солей. В следующем фильме показан эксперимент, который говорит нам, существует ли окислительно-восстановительная реакция между металлом (Zn) и ионом металла (Cu 2+ ). СМ. ВИДЕО В следующем упражнении показаны результаты ряда экспериментов, аналогичных тем, которые проводились в вышеупомянутом фильме. Из результатов этих экспериментов вы будете: Определять, происходит ли самопроизвольная реакция. Если самопроизвольная реакция происходит, используйте выпадающие меню, чтобы создать уравненное окислительно-восстановительное уравнение, соответствующее этой реакции. Наконец, вы напишете полуреакции, соответствующие этой общей реакции. Полуреакции разбивают реакцию на окислительную и восстановительную части. Например, реакция между Zn и Cu 2+ соответствует следующим полуреакциям:
Это разделение окислительно-восстановительной реакции на полуреакции является одной из самых важных идей в области окислительно-восстановительной (редокс) химии и является основой для большей части того, что мы будем делать в оставшейся части этой работы. Задание: исследование окислительно-восстановительных реакций. СМ. Мультимедийный элемент «Эксперимент 11. Энергия ОВР (редокс реакций)». Примечание. Для этого действия требуется проигрыватель Flash Player . Чтобы убедиться, что моделирование выполняется правильно, пожалуйста, убедитесь, что у вас установлен flash player. Электрохимия: гальванические элементы и уравнение НернстаЭтап 1: - практика с окислительно-восстановительными реакциямиПосле завершения действия на предыдущей странице вы увидели, что нижеследующая таблица данных была собрана из экспериментов. 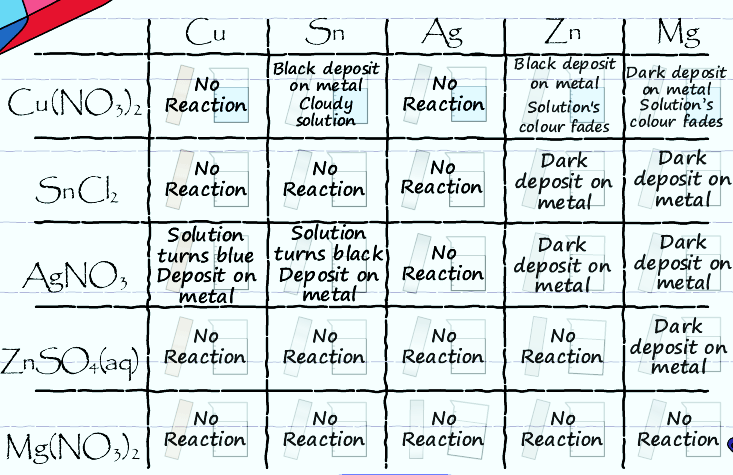 Используйте данные в этой таблице, чтобы ответить на следующие вопросы о том, как реагировали ионы металлов. 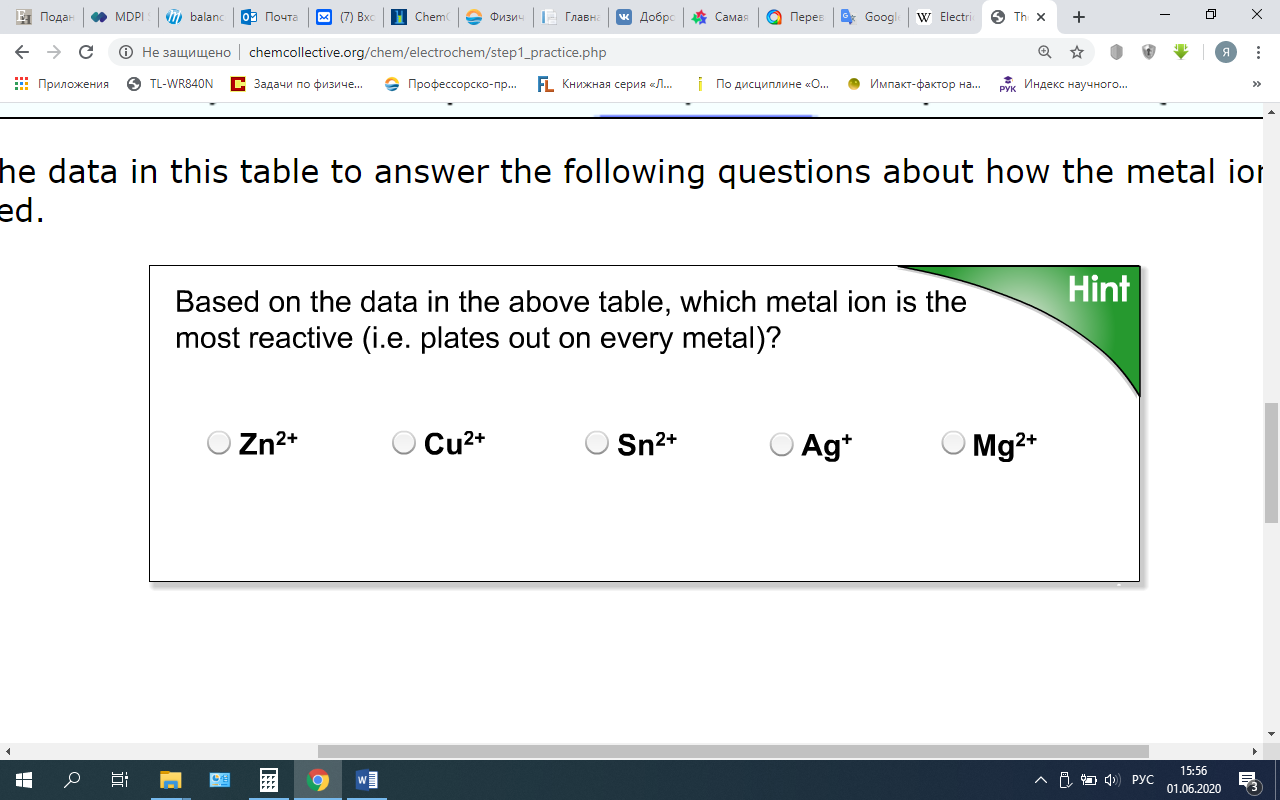 Основываясь на таблице данных, расположите ионы металлов в приведенном ниже списке от иона, имеющего наибольшую склонность к восстановлению, к иону, имеющему наименьшую склонность к восстановлению? Самая высокая тенденция подвергнуться восстановлению Самая низкая тенденция подвергнуться восстановлению Zn2+ Cu2+ Sn2+ Mg2+ Ag+ Подсказка Проверить
Этап 2: объяснение процесса переноса электронов Электрохимия: гальванические элементы и уравнение НернстаЭтап 2: объяснение процесса переноса электроновНа следующем видео с веб-сайта McGraw-Hill показано, что происходит во время редокс-реакции на молекулярном уровне. СМ. ВИДЕО © Макгроу-Хилл. Фильм открывается в отдельном окне и требует наличия проигрывателя Flash player. Чтобы понять, как окислительно-восстановительная реакция (ОВР) может быть использована для получения электрического тока, рассмотрим одну из реакций, которую мы только что исследовали. Вы заметили, что когда полоска Zn помещалась в медный раствор, на поверхности цинка образовывался черный осадок металлической меди. (См. рисунок ниже).  Давайте вернемся к реакции Zn и Cu 2+ из предыдущего фильма: СМ. ВИДЕО В условиях, показанных в фильме, т.е. путем погружения металла Zn в раствор нитрата меди, никакая полезная работа не может быть получена от химической энергии, участвующей в реакции. Энергия выделяется в виде тепла. В следующем разделе мы увидим, как использовать эту энергию для выполнения электрической работы, т.е. мы узнаем, как сделать гальванический элемент (или ячейку) (т.е. батарею). Этап 2: электрохимическая ячейка Электрохимия: гальванические элементы и уравнение НернстаЭтап 2: Электрохимическая ЯчейкаВ фильме на предыдущей странице, когда цинковую полоску помещают в раствор с ионами Cu 2+, происходит следующая самопроизвольная окислительно-восстановительная реакция:
В этой окислительно-восстановительной реакции электроны передаются от Zn к Cu 2+ . Ранее мы писали полуреакции, иллюстрирующие природу этого электронного потока:
Электрохимическая ячейка заставляет электроны течь через провод, поскольку они идут от Zn к ионам Cu 2+. Электрохимическая ячейка (элемент) состоит из двух "полуячеек", которые соответствуют каждой из указанных выше реакций полуячеек (полуэлементов). Для полуячейки, соответствующей реакция окисления, полоска металла Zn помещается в раствор ионов Zn 2+. Для восстановительной полуячейки, полоска металла Cu помещается в раствор ионов Cu 2+. Затем мы соединяем эти ячейки вместе (используя провод и соляной мост), чтобы создать электрическую цепь. Следующее видео объясняет эту установку и детализирует процесс на молекулярном уровне: СМ. ВИДЕО После просмотра видео, пожалуйста, заполните диаграмму ниже, чтобы определить ключевые компоненты в электрохимической ячейке: Начало формы Ниже приведена схема электрохимической ячейки для реакции, показанной в фильме выше: Zn (т) + Cu 2+ (р-р) --> Zn> 2+ (р-р) + Cu (т) . Сопоставьте следующие метки (лейблы) с их расположением на диаграмме. Вы не будете использовать все метки.  Окислительная полуячейка Восстановительная полуячейка Направление потока анионов в соляном мостике >>>>>> Направление потока анионов в соляном мостике <<< Направление потока электронов>>> Направление потока электронов <<< Подсказка Проверить Имейте в виду, что в электрохимической ячейке только ионы перемещаются в растворе. Электроны перемещаются между электродами на проводе и никогда не попадают в раствор. Поток электричества в цепи поддерживается электронами, движущимися по проводам, и ионами, движущимися через раствор. 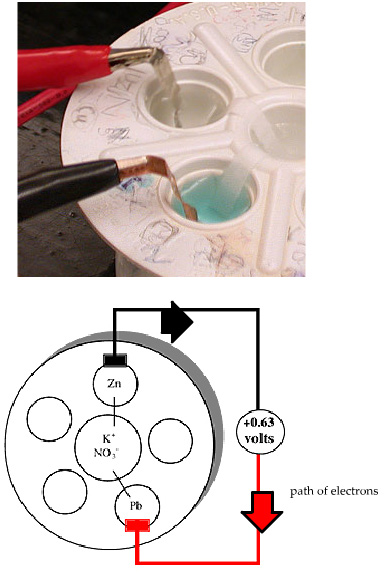 В нашей лаборатории мы будем использовать ячейку Carrou, которая обеспечивает более удобные средства для проведения экспериментов на электрохимических ячейках (элементах). Ячейка Carrou имеет некоторое количество углублений (лунок), которые служат в качестве вышеуказанных химических стаканов. Каждое из углублений (лунок) с краю содержит полуячейку. Соляной мост, соединяющий два из этих внешних углублений (лунок), проходит через центральное углубление (лунку). Это делается путем заполнения центрального углубления (лунки) солевым раствором и с помощью бумаги для соединения каждого из углублений (лунок) по краям с центральным углублением (лункой). Бумага смочена раствором соли, чтобы обеспечить поток ионов через бумагу. (Пожалуйста, смотрите на изображение выше). В нашей лаборатории мы будем использовать ячейку Carrou, которая обеспечивает более удобные средства для проведения экспериментов на электрохимических ячейках (элементах). Ячейка Carrou имеет некоторое количество углублений (лунок), которые служат в качестве вышеуказанных химических стаканов. Каждое из углублений (лунок) с краю содержит полуячейку. Соляной мост, соединяющий два из этих внешних углублений (лунок), проходит через центральное углубление (лунку). Это делается путем заполнения центрального углубления (лунки) солевым раствором и с помощью бумаги для соединения каждого из углублений (лунок) по краям с центральным углублением (лункой). Бумага смочена раствором соли, чтобы обеспечить поток ионов через бумагу. (Пожалуйста, смотрите на изображение выше).Изображения выше показывают, как ячейка Carrou выглядит в лаборатории, и как мы ее схематично изображаем. На схеме показана ячейка, собранную для самопроизвольной реакции между металлическим Zn и ионами Pb2+:
Мы можем понять направление потока электронов, разбив реакцию на полуреакции:
Электроны покидают полуячейку Zn и направляются к полуячейке Pb. Удобное сокращенное условное обозначение для этого: Zn (т) | Zn 2+ (р-р) || Pb 2+ (р-р) / Pb (т) В этой условной записи анод или окислительная полуячейка (полуэлемент) находится слева, а катод или восстановительная полуячейка (полуэлемент) находится справа. Двойная вертикальная линия,||, представляет солевой мост, и одиночная вертикальная линия, |, представляет собой границу раздела фаз между твердым металлом и его солевым раствором. Вольтметр используется для того, чтобы измерить потенциал, или напряжение тока электрохимической ячейки. Вольтметры имеют положительную и отрицательную клеммы и, по согласно Конвенции, красный провод подключен к положительной клемме, а черный провод подключен к отрицательной клемме. Знак показаний на вольтметре говорит нам о самопроизвольном направлении электронного потока. В ячейке: Zn (т) | Zn 2+ (р-р) | / Pb 2+ (р-р) / Pb (т), самопроизвольная окислительно-восстановительная реакция соответствует потоку электронов от Zn к Pb-получейке. Если черный провод подключен к Zn-электроду, а красный провод подключен к Pb-электроду, то вольтметр покажет положительное значение. Если мы сделаем это наоборот путем подсоединения черного провода к электроду Pb и красного провода к электроду Zn, тогда вольтметр покажет отрицательное значение. Помните: если вольтметр показывает положительное значение, то самопроизвольное направление электронного потока идет от черного провода к красному проводу. Обычно используемые термины в электрохимии - это анод и катод. Электроны движутся («текут») от анода (поставщика электронов или источника электронов) к катоду (приемнику электронов или приемнику электронов). Если вольтметр имеет положительные показания, то черный провод находится на аноде, а красный провод - на катоде. Этап 2: практика с электрохимическими элементами Электрохимия: гальванические элементы и уравнение НернстаЭтап 2: практика с электрохимическими элементамиВ моделировании ниже вам будет показана ячейка Carrou, которая уже была настроена. Под ячейкой находится выпадающее меню, в котором вы можете выбирать реакцию, которая представляет эту установку. Используйте раскрывающееся (выпадающее) меню, чтобы выбрать реакцию, описывающую конфигурацию ячейки Сarrou, и нажмите кнопку Проверить. (Примечание: Вы можете использовать кнопки подсказки (Hint) в задании ниже ячейки для дополнительной помощи в определении реакции и анода/катода для этой ячейки.) 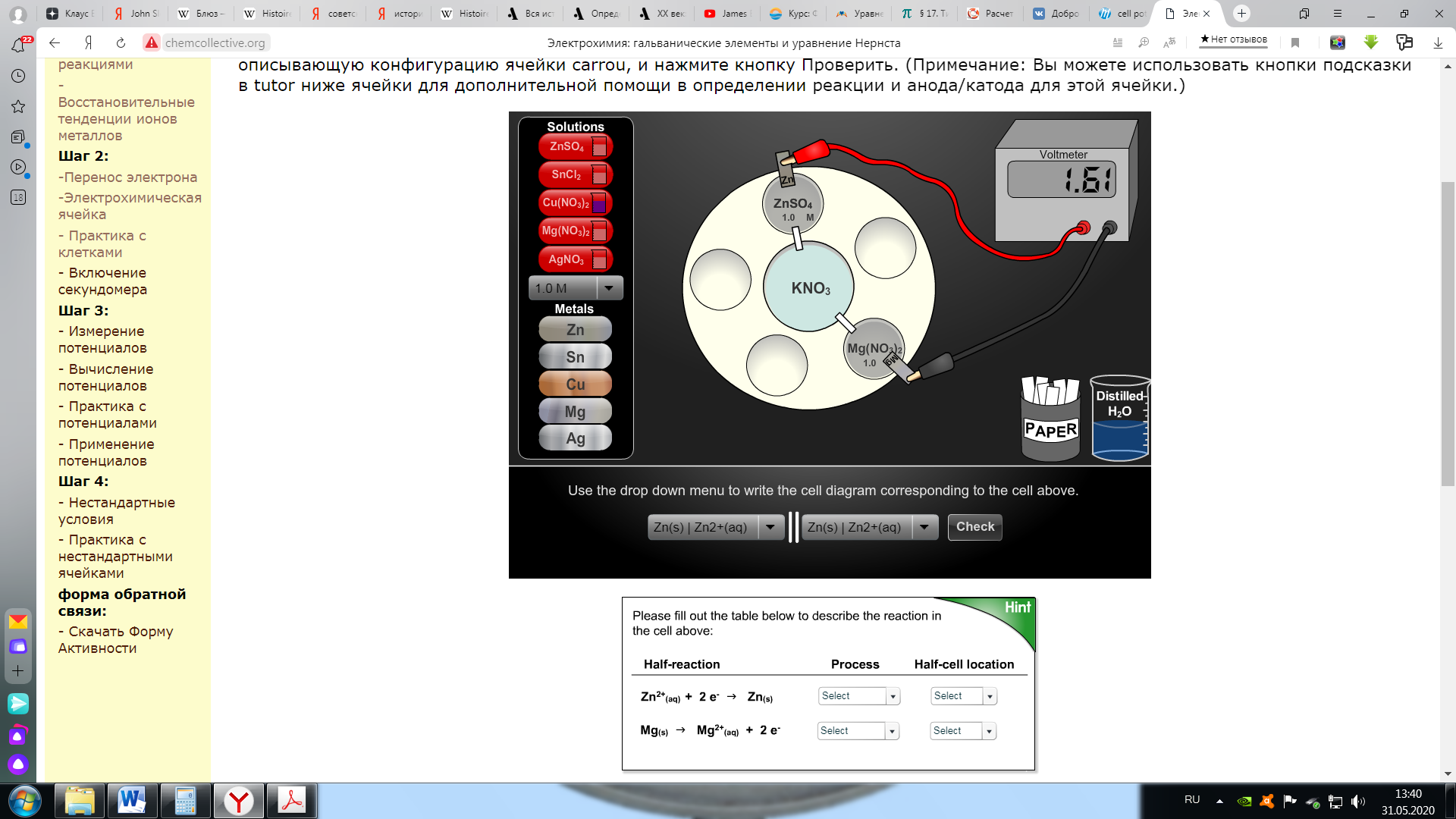 Теперь попробуйте построить свою собственную ячейку. В нижеследующем модулировании вам будет дана реакция. Настройте ячейку, чтобы она соответствовала этой реакции, а затем нажмите кнопку "Проверить". 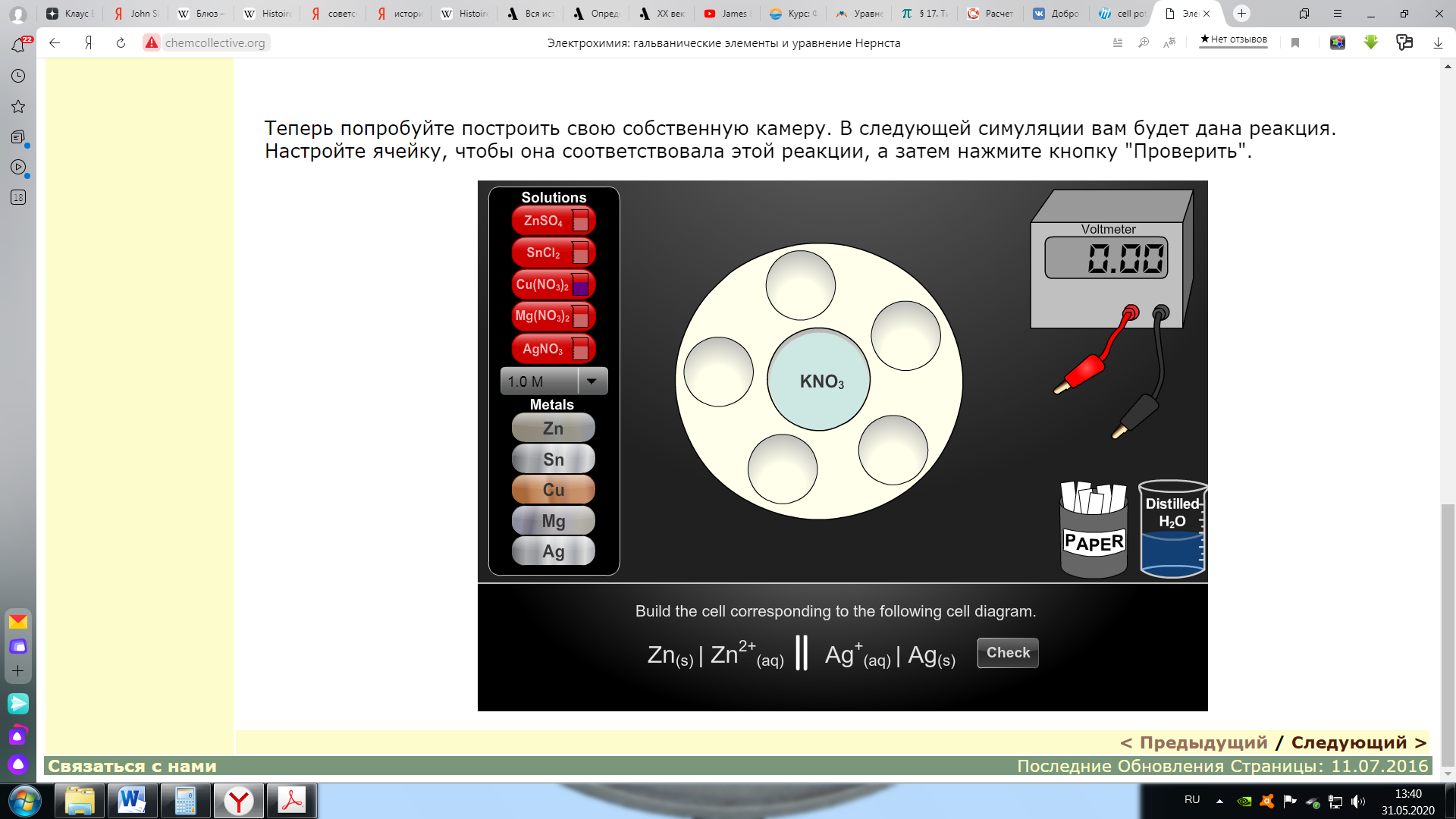 Этап 2: запитывание секундомера Электрохимия: гальванические элементы и уравнение НернстаЭтап 2: включение секундомераПодводя итог всему вышесказанному: чтобы создать гальванический элемент (ячейку), мы физически отделили окислитель от восстановителя и соединили их проволокой, заставляя перенос электронов происходить через проволоку. Чтобы поддерживать поток электронов, нам нужно поддерживать нейтральность заряда в ячейке, используя солевой мост. Теперь вы создали электрическую цепь, и следующий этап-заставить ее сделать некоторую работу. Давайте посмотрим, можно ли использовать эти реакции для питания работы секундомера. СМ. ВИДЕО Вы можете заметить, что в приведенном выше фильме только некоторые из реакций «запитали» (снабдили энергией) секундомер. Почему вы думаете, что некоторые гальванические элементы приводили в действие секундомер, а другие нет? В следующем разделе мы рассмотрим это более подробно. Этап 3: Измерение потенциалов элементов Электрохимия: гальванические элементы и уравнение НернстаЭтап 3: Измерение потенциалов ячеекНа предыдущем этапе мы использовали энергию химической реакции, создав гальванический элемент для питания секундомера. В этом разделе мы рассмотрим, как измерить энергию, производимую в гальваническом элементе. Используя эту информацию, мы можем понять, почему некоторые из реакций привели в действие («запитали») секундомер, а другие нет. Для измерения энергии, вырабатываемой в гальваническом элементе, мы будем использовать вольтметр, помещая его на пути движения электронов (на провод). В следующем фильме мы покажем, как измерить напряжение для цинкового/медного гальванического элемента, как это было бы в лаборатории. СМ. ВИДЕО Существует два аспекта потока электронов в электрохимической ячейке, которые относятся к энергии: (Электрический) ток: число электронов, протекающих в секунду. (Электрический) потенциал: энергия, связанная с каждым электроном. Мы можем понять различие между этими аспектами, проводя аналогии с водой. Рассмотрим очень высокий водопад, по которому течет тонкая струйка воды. Это соответствует низкому току (не так много воды течет), но высокому потенциалу (каждая капля воды имеет много энергии, когда она попадает на землю). Чем больше разница в уровне воды в верхней и нижней части водопада, тем больше энергия, стоящая за потоком воды. Большая река, текущая вниз по постепенному уклону, имеет большой ток с низким потенциалом. Ниагарский водопад, например, имеет как высокий потенциал, так и большой ток. Когда мы подключаем («цепляем») вольтметр к электрохимической ячейке, мы измеряем только потенциал, или энергию электронов. Единицей напряжения ячейки, вольт (В), является энергия на единицу заряда; 1 Вольт = 1 Джоуль/Кулон. Разность потенциалов 1,63 В, измеренная вольтметром в приведенном выше фильме, означает энергию 1,63 Дж для каждого заряда в 1 Кулон, проходящего через электрическую цепь. Напряжение ячейки также называется потенциалом ячейки и представлено символом Е ячейки. Помните, как мы обсуждали выше, что когда направление самопроизвольного потока электронов находится от черной (-) клеммы вольтметра к красной (+) клемме, то вольтметр покажет положительное напряжение. Отрицательное напряжение указывает на то, что самопроизвольное направление электронного потока идет от красной (+) клеммы к черной (-) клемме. В этом следующем упражнении вы будете использовать электрохимическое моделирование ячейки для измерения напряжений реакций в таблице ниже.   Этап 3: вычисление потенциалов ячеек Электрохимия: гальванические элементы и уравнение НернстаЭтап 3: вычисление потенциалов ячеекВ предыдущих моделированиях вы измеряли потенциалы ячеек (элементов) нескольких ячеек (элементов), состоящих из различных комбинаций полуячеек (полуэлементов). Это была бы монументальная задача, чтобы собрать список всех возможных ячеек и сообщить напряжение ячейки для каждой. Более полезно составить список потенциалов полуячеек, а затем рассчитать потенциалы необходимых комбинаций. Здесь мы сначала узнаем, как использовать потенциалы полуячейки, а затем рассмотрим, как определить потенциалы полуячейки из экспериментов. Напряжение электрохимической ячейки зависит от протекающей в ней окислительно-восстановительной реакции. Выше мы видели, что часто полезно разбить окислительно-восстановительную реакцию, такую как: Zn(т) + Pb2+(р-р) --> Zn2+(р-р) + Pb(т) на следующие полуреакции.
Учитывая, насколько полезны потенциалы полуячейки (вы можете использовать их для расчета потенциала любой полной ячейки), неудивительно, что они широко представлены в справочниках и в интернете. Эти таблицы, по международному соглашению, содержат потенциалы полуячейки для восстановления. Потенциал восстановления, тенденция к приобретению электронов, представляет собой относительную склонность для данного иона металла к восстановлению. Для вышеприведенной ячейки таблица будет содержать (следующие данные):
Реакция Pb в таблице и в ячейке протекает в одном и том же направлении (т. е. восстановление). Это всегда будет иметь место в случае катода, потому что в таблице перечислены потенциалы восстановления, а восстановление всегда происходит на катоде. Однако реакция Zn происходит в противоположном направлении. Это всегда будет иметь место для анода, потому что в таблице перечислены потенциалы восстановления, а окисление происходит на аноде. Из-за этого потенциал ячейки – это разность между потенциалом ячейки катода и анодом: Eºячейки = Еº катод - Еº анод Единственный потенциал, который мы можем экспериментально измерить, - это потенциал полной ячейки (процесс восстановления всегда должен быть связан с процессом окисления, иначе будут накапливаться свободные электроны). Таким образом, все измерения соответствуют разницам между числами в таблице потенциалов полуячеек. Это аналогично высотам расположения городов. Все, что нас действительно волнует – это разница в высотах между городами. Все таблицы определяют высоту относительно уровня моря, но, если бы мы вместо этого создали таблицу, которая давала бы высоты городов относительно вершины Эвереста (или центра Земли), мы все равно получили бы те же значения для разницы в высотах между городами. Уровень моря является "эталонным" для высоты, что означает, что уровень моря имеет высоту ноль. Для потенциалов полуячейки нам также нужно решить, что такое "эталон". Условность среди химиков состоит в том, чтобы взять в качестве стандарта следующую полуреакцию и назначить ей нулевой потенциал полуячейки:
Электрод, соответствующий этой полуреакции, называется "стандартным водородным электродом". Здесь обозначение Eº используется для представления стандартного электродного потенциала водорода (объявленного равным нулю при всех температурах). Измеренное напряжение тока ячейки, с использованием стандартного водородного электрода в качестве одной из полуячеек, является таким образом потенциалом другой полуреакции. Стандартный водородный электрод состоит из водородного газа при 1 атмосфере и поэтому нам неудобно работать с ним в лаборатории. Вместо этого вы создадите свою собственную таблицу потенциалов восстановления, используя в качестве стандарта оловянную полуячейку вместо водородной полуячейки. Используя информацию из таблицы стандартных потенциалов восстановления (см. ссылку ниже), стандартный потенциал ячейки для элемента цинк/свинец тогда определяется: Eº ячейка = Еº катод - Еº анод = -0,13 - (- 0,76) = 0,63 В В следующем примере показано, как использовать таблицу стандартных восстановительных потенциалов [например, тот, который доступен в интернете по адресу: <="" a="" >http://hyperphysics.phy-astr.gsu.edu/hbase/tables/electpot.html ] чтобы предсказать потенциалы элементов (ячеек), которые вы измерили в моделировании на предыдущей странице: 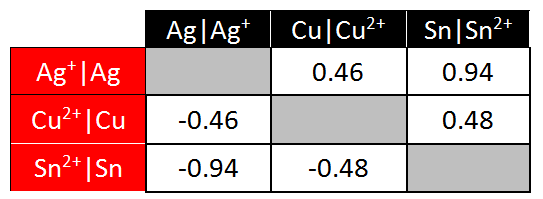 Для реакции между Cu и Sn, мы можем выполнить следующее вычисление:
Поскольку медный полуэлемент является катодом (это место, где происходит восстановление), а оловянный полуэлемент является анодом (где происходит окисление), наш расчет будет: Eº ячейка = Еº катод - Еº анод = 0,34 - (- 0,14) = 0,48 В Для реакции между Cu и Ag, мы можем выполнить следующее вычисление:
Поскольку серебряный полуэлемент является катодом (здесь происходит восстановление), а медный полуэлемент - анодом (где происходит окисление), наш расчет будет: Eº ячейка = Еº катод - Еº анод = 0,80-0,34 = 0,46 В Обратите внимание, что мы умножили реакцию полуячейки Ag на 2, чтобы сбалансировать (уравнять) электроны. Однако мы не умножили потенциал всей ячейки на 2. Когда мы умножаем реакцию полуэлемента на константу, нам не нужно изменять потенциал полуэлемента (полуячейки). Этап 3: Практика со стандартными потенциалами ячеек Электрохимия: гальванические элементы и уравнение НернстаЭтап 3: Практика со стандартными потенциалами ячеекНа предыдущей странице мы использовали потенциалы полуячеек для предсказания потенциала электрохимической ячейки. В этом упражнении вы будете измерять потенциал полной ячейки, и использовать это для определения потенциала полуячейки неизвестного металла X. (Это тип эксперимента, который химики делают, чтобы создать таблицу потенциалов восстановления полуячеек.) Задание: определить потенциал полуячейки для неизвестного металла Х. Используйте моделирование ниже, чтобы определить потенциал полуячейки для металла "X". [Примечание Вы можете использовать таблицу стандартных потенциалов полуячеек в своем учебнике или доступный онлайн: http://hyperphysics.phy-astr.gsu.edu/hbase/tables/electpot.html ] приведенные ниже вопросы помогут вам определить это значение. Пожалуйста, распечатайте форму обратной связи и ответьте на следующие вопросы. Используйте моделирование ниже, чтобы определить потенциал полуячейки для металла "X". Какова уравненная реакция для полуячейки, соответствующая восстановлению металла X? Какие потенциалы ячеек вы измерили, чтобы помочь определить потенциал восстановления полуячейки металла X, и какие значения вы получили (перечислите две разные ячейки и измеренный потенциал)? Какое значение вы получили для потенциала восстановления полуячейки металла X? В качестве проверки Вашего ответа используйте приведенное выше значение для потенциала восстановления полуячейки X, чтобы вычислить потенциал двух ячеек, которые вы измерили в части Б. Ваши предсказанные значения должны соответствовать тому, что вы измерили в части Б.  Этап 3: применение стандартных потенциалов ячеек Электрохимия: гальванические элементы и уравнение НернстаЭтап 3: применение стандартных потенциалов ячеекРанее в этом задании вы ранжировали ионы металлов по их склонности к восстановлению, где эта склонность означала способность иона металла принимать электроны от металла. Ряд, который вы установили, был следующим: 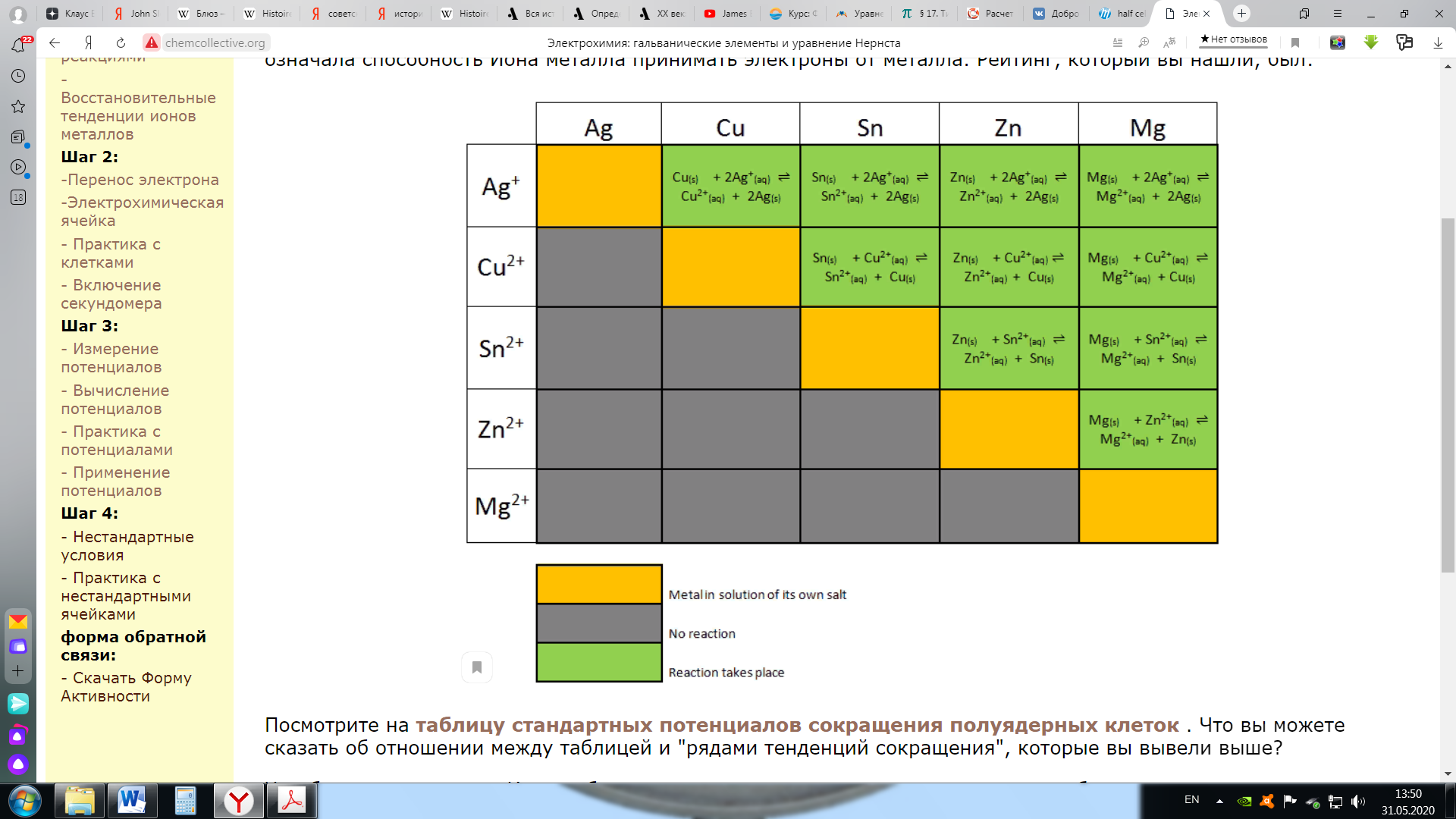 Посмотрите на таблицу стандартных потенциалов восстановления полуячеек . 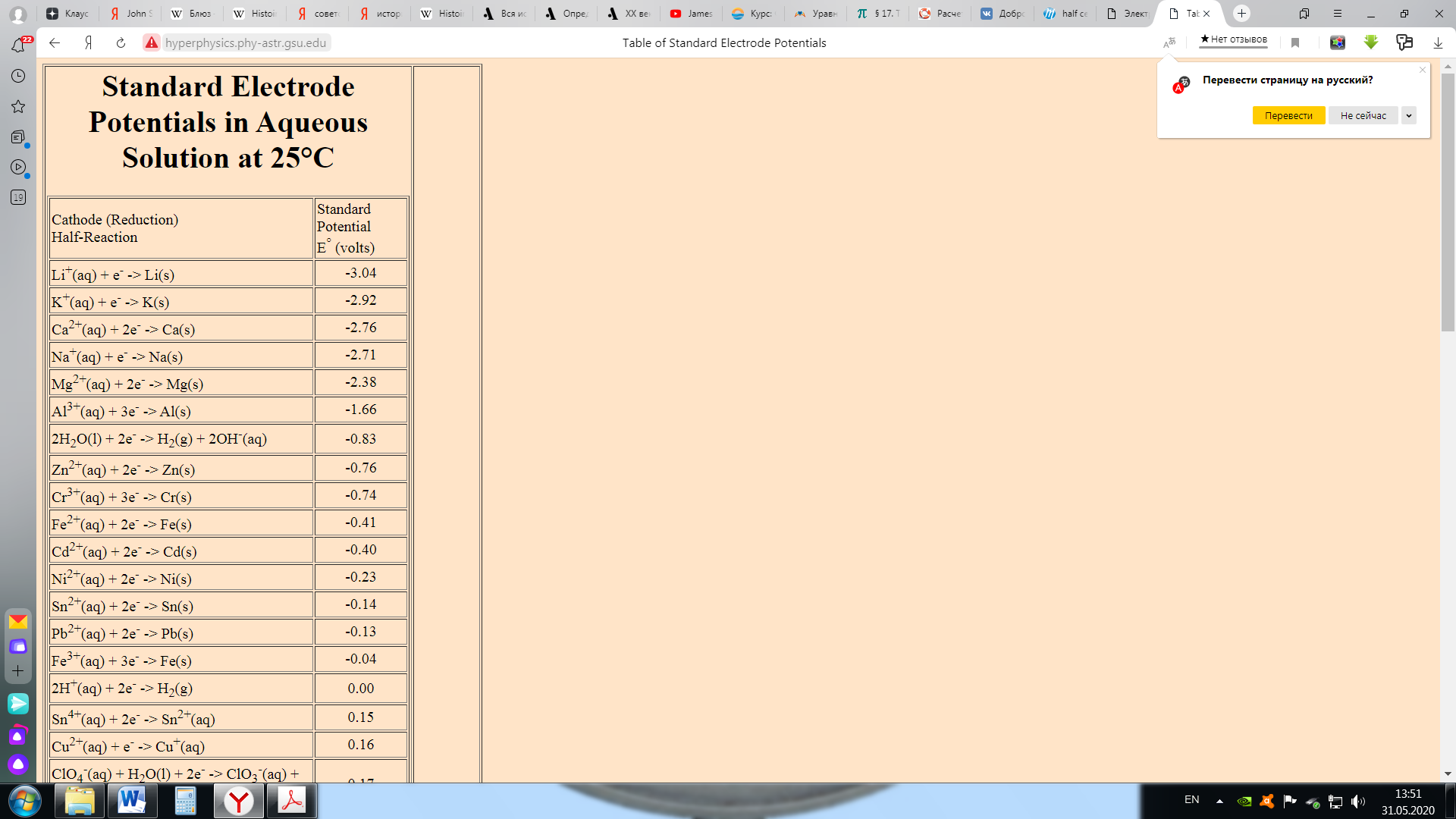 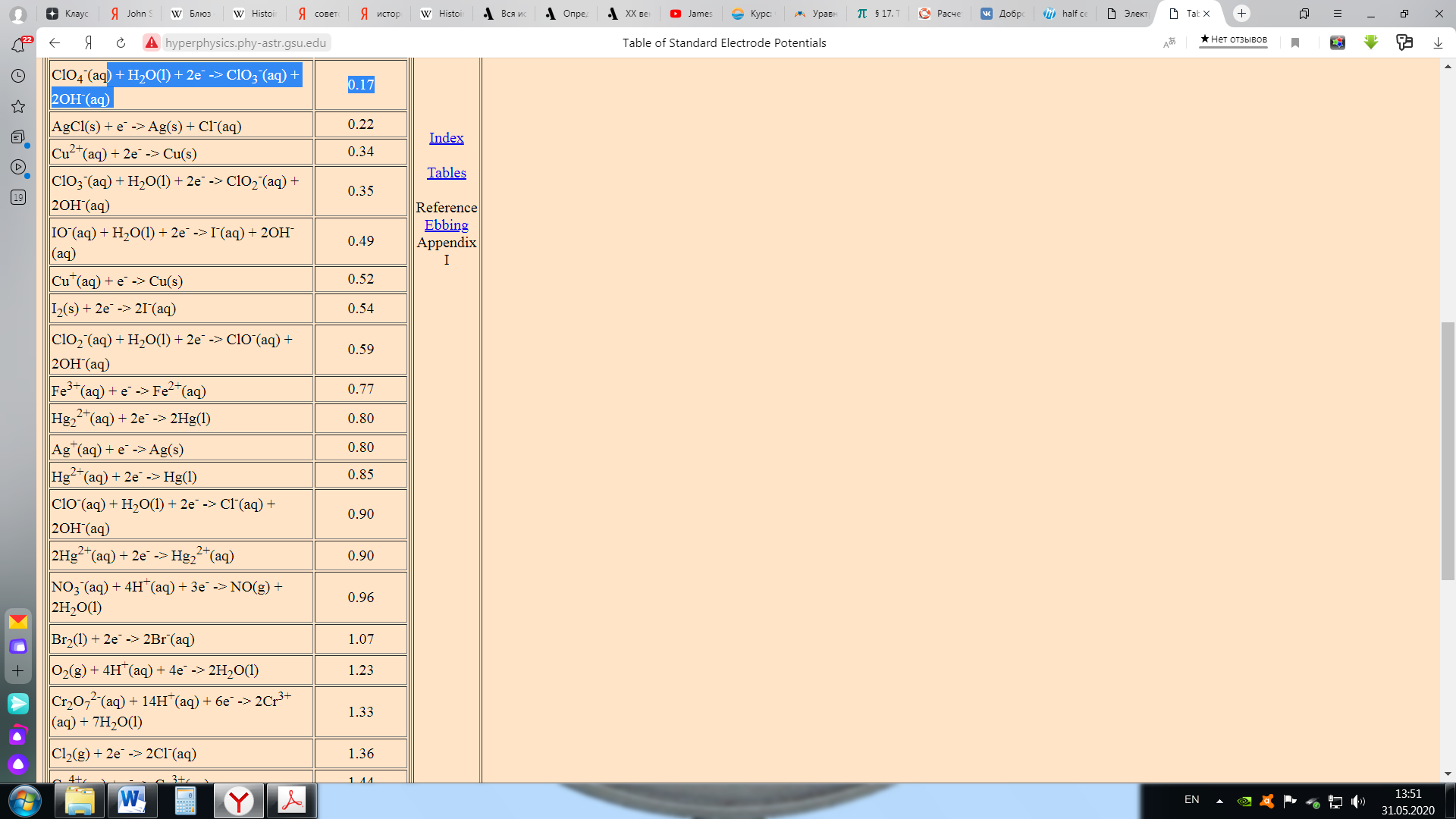 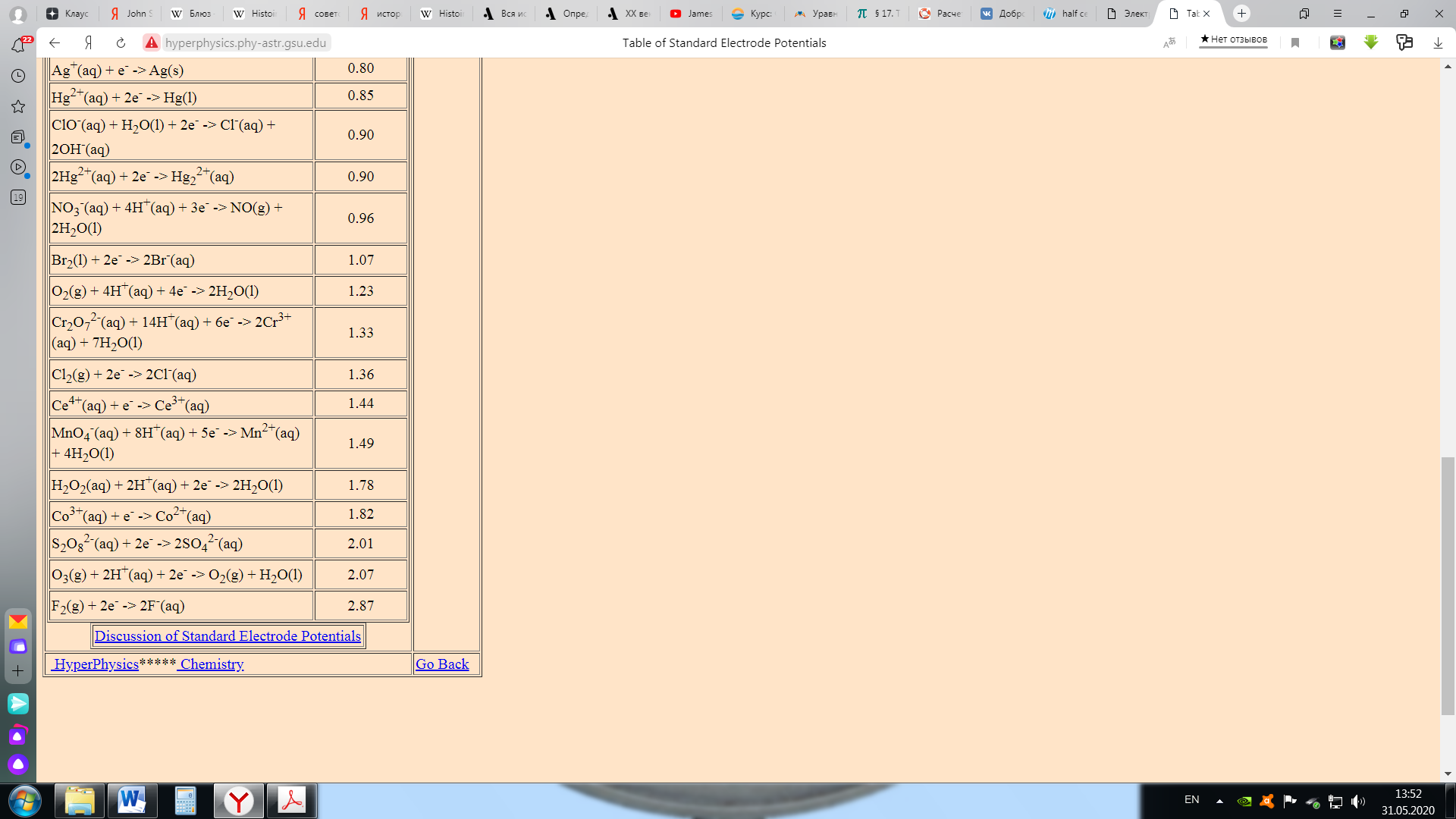 Что вы можете сказать о связи между таблицей и "рядами склонности к восстановлению", которые вы вывели выше? Чем больше склонность иона приобретать электроны и подвергаться восстановлению, тем более положительным является восстановительный потенциал иона. Когда мы помещаем полоску металла в раствор другого иона металла, металлические ионы осаждаются на полоске, если ее потенциал восстановления больше (более положительный), чем потенциал восстановления иона другого металла. Вспомним первую реакцию, которую мы исследовали в этом онлайн-учебнике: ион меди имеет больший (более положительный) потенциал восстановления, чем цинк, металлическая медь осаждается на цинке. Мg2+ имеет самый отрицательный потенциал (среди наших примеров) и металлический магний не осадится на любом из металлов в "серии склонностей к восстановлению". Чем более положительным будет стандартный потенциал восстановления, тем более активным будет ион металла. Созданная вами "серия склонностей к восстановлению" следует точно в том же порядке, что и таблица стандартных потенциалов восстановления полуячеек. Этап 4: элементы в нестандартных условиях Электрохимия: гальванические элементы и уравнение НернстаЭтап 4: ячейки в нестандартных условияхПотенциалы ячейки, которые мы рассчитывали на предыдущих страницах, были все для электрохимической ячейки в "стандартных" условиях. По определению, стандартный условия означают, что любые растворенные частицы имеют концентрацию 1 М (моль/л), любой газообразные частицы имеют парциальное давление 1 атм, а ячейка работает при 25ºC. В этом разделе мы рассмотрим ячейки в нестандартных условиях. Давайте начнем с рассмотрения электрохимической ячейки, которая самопроизвольно «перемещает» электроны по проводу, а ионы через солевой мост. 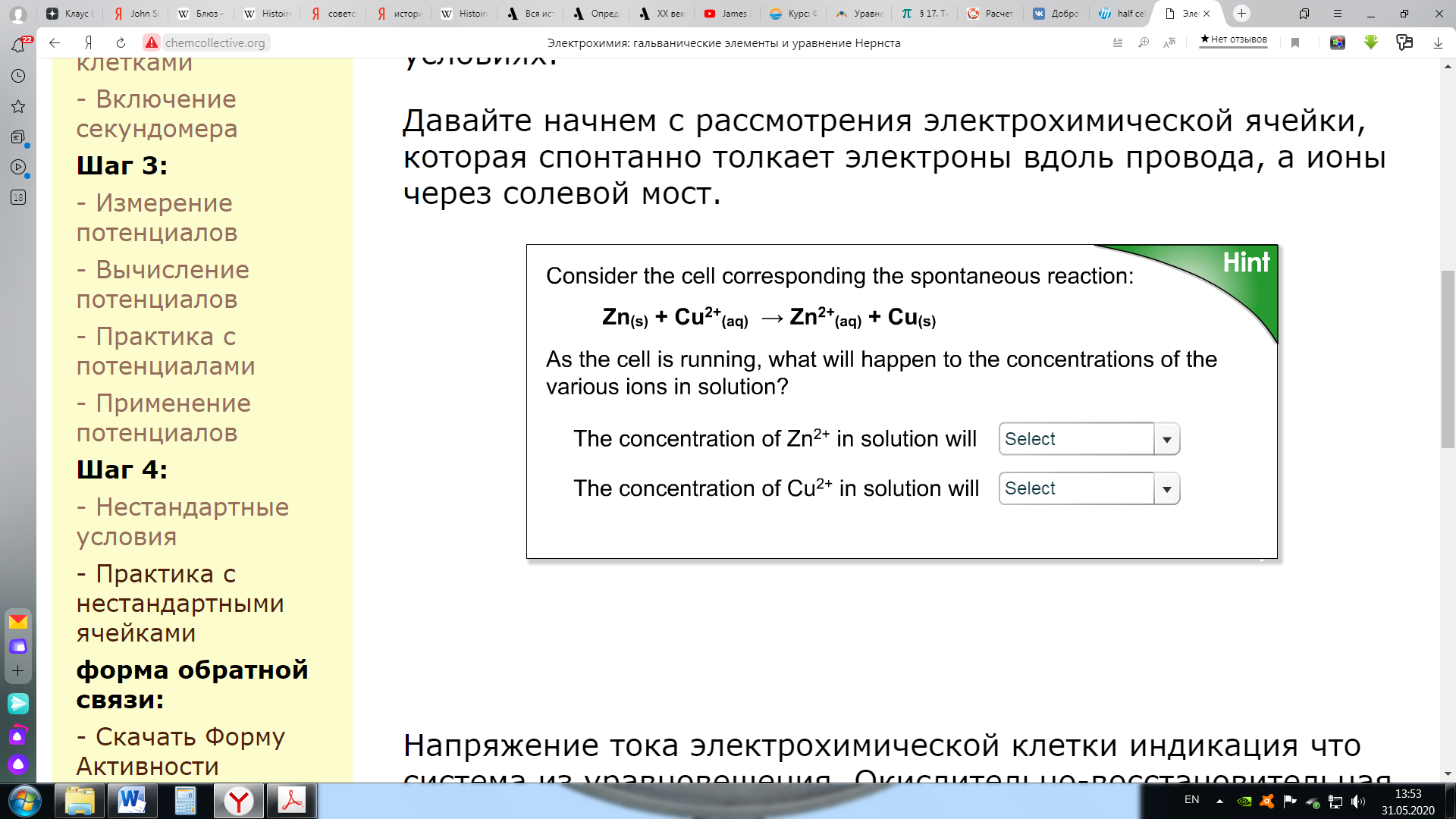 Напряжение тока электрохимической ячейки указывает на то, что система вышла из равновесия. Окислительно-восстановительная реакция самопроизвольно приближается к равновесию, и по мере протекания реакции электроны движутся внутри ячейки. При равновесии напряжение падает до нуля и ток прекращается. (Батарея в состоянии равновесия - это разряженная батарея.) Если мы вносим изменения в систему, которая сдвигает ее дальше от состояния равновесия, потенциал повышается. Если мы совершим изменение, которое сдвинет систему к равновесию, потенциал пойдет вниз. В этом примере самопроизвольная реакция увеличивает концентрацию [Zn 2+] и уменьшает концентрацию [Cu 2+]. Если мы разбавляем полуячейку Zn (ниже [Zn 2+]), мы сдигаем реакцию от равновесия, и поэтому потенциал ячейки повышается. Если мы разбавляем Cu-полуячейку (ниже [Cu 2+]), мы смещаем реакцию к равновесию, и поэтому потенциал ячейки снижается. Для случаев, когда мы изменяем как [Zn 2+], так и [Cu 2+], мы должны уточнить, что мы имеем в виду, смещая систему ближе или дальше от равновесия. Способ сделать это - рассмотреть фактор реакции, Q, для окислительно-восстановительной реакции. Для этой реакции Q = [Zn 2+] / [Cu 2+]. На стандартных условиях, все концентрации 1M и поэтому Q=1. Поскольку реакция самопроизвольна, как указано, константа равновесия K >>> 1. Когда ячейка работает, Q приближается к K, и потенциал ячейки падает. Поэтому в тех случаях, когда оба [Zn 2+ ] и [Cu 2+ ] изменяются, нам нужно рассмотреть влияние на их соотношение (т.е. Q=[Zn 2+ ]/[Cu 2+]) при принятии решения о влиянии на потенциал ячейки. Этап 4: практика с элементами в нестандартных условиях Электрохимия: гальванические элементы и уравнение НернстаЭтап 4: практика с ячейками в нестандартных условияхПожалуйста, используйте форму обратной связи, чтобы ответить на следующие вопросы. Задание: определить влияние изменения концентрации полуячейки на потенциал всей ячейки. Используйте приведенное ниже моделирование для изучения эффектов изменения концентрации веществ полуячейки и ответа на следующие вопросы. Разбавьте раствор Sn 2+ в следующих двух гальванических элементах. Что происходит с напряжением в каждом из них? Объясните свои результаты. Реакция 1: Sn (т)+ Cu 2+ (р-р)--> Sn> 2+ (р-р)+ Cu (т) Реакция 2: Zn (т)+ Sn 2+ (р-р)--> Zn> 2+ (р-р)+ Sn (т) Рассмотрим ячейку: Zn (т) + Cu 2+ (р-р) --> Zn> 2+ (р-р) + Cu (т), в которой концентрация [Cu 2+ ] и [Zn 2+ ] равна 2M. [Обратите внимание, что моделирование предоставляет растворы с концентрацией больше 1 М. Пожалуйста, сделайте предроложения о ячейках с концентрацией 2M на основе экспериментов, которые вы выполняете с концентрациями растворов, которые у вас есть.] Будет ли потенциал ячейки больше, равен или меньше стандартного потенциала ячейки? Сможет ли ячейка запускать секундомер в течение более длительного времени, равного времени или более короткого времени, чем стандартная ячейка?  Это завершает деятельность электрохимии, пожалуйста, не забудьте заполнить форму активности. |