Итоговый контроль 7. Обмен и функции липидов. Основные вопросы темы
 Скачать 2.25 Mb. Скачать 2.25 Mb.
|
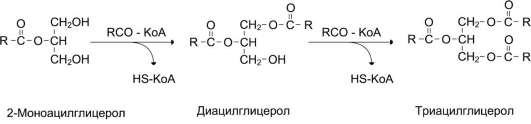
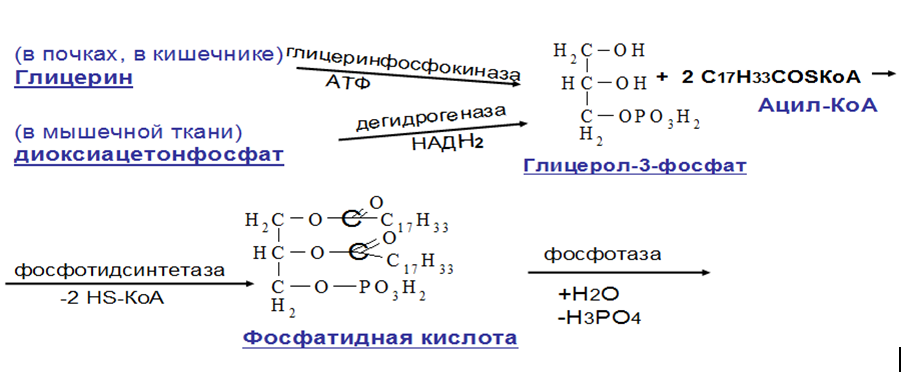
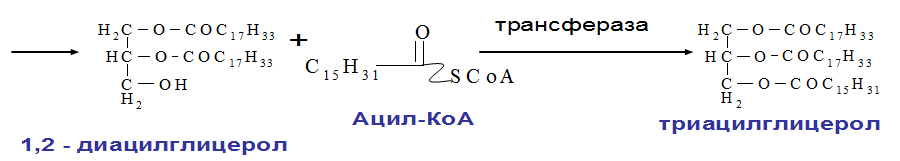
КоА участвует в реакции этерификации 2-МАГ с образованием сначала ДАГ, а затем ТАГ. Реакции ресинтеза жиров катализируют ацилтрансферазы.HS КоА + RCOOH + АТФ → R-CO |
| |
В реакциях ресинтеза жиров участвуют, как правило, только жирные кислоты с длинной углеводородной цепью. В ресинтезе жиров участвуют не только жирные кислоты, всосавшиеся из кишечника, но и жирные кислоты, синтезированные в организме.
В клетках слизистой оболочки кишечника происходит активный синтез глицерофосфолипидов, необходимых для формирования структуры липопротеинов - транспортных форм липидов в крови.
7. Транспортные формы липидов, строение. Функции хиломикронов и ЛПОНП.
КОРОТКО: Поскольку липиды явл. гидрофобными молекулами, то они транспортируются по крови в составе особых частиц – липопротеинов (ЛП).
Б
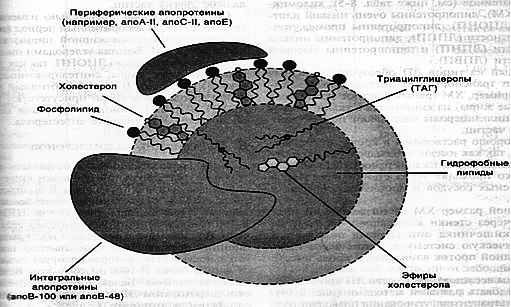 елки в ЛП наз. апобелками, выделяют типы: А,В,С,Д,Е. В каждом классе ЛП находятся соответствующие ему апобелки, фун-и которых:
елки в ЛП наз. апобелками, выделяют типы: А,В,С,Д,Е. В каждом классе ЛП находятся соответствующие ему апобелки, фун-и которых:1) структурная: формирует форму ЛП;
2) кофакторная: взаимодействуют с рецепторами на пов. клеток и т.о. определяют, какими тканями будет захватываться данный тип липопротеинов;
3) служат ферментами или их активаторами, действующих на ЛП.
Типы ЛП: ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП.
Жиры, образовавшиеся в результате ресинтеза в клетках слиз. оболочки кишечника, упаковываются в ХМ. Транспорт ТАГ из кишечника в ткани (экзогенные ТАГ) осущ. в виде ХМ, от печени к тканям (эндогенные ТАГ) – в виде ЛПОНП.
В крови ХМ подвергаются действию ЛП-липазы эндотелия, которая отщепляет ВЖК от ТАГ. ВЖК соединяются с альбуминами (ЛПОВП) и транспортируются в различные ткани. В результате кол-во ТАГ в ХМ резко снижается и образуются остаточные ХМ, которые поступают в гепатоциты.
В жировой ткани в абсорбтивный период ВЖК депонируются в виде ТАГ, в сердечной мышце, работающих скелетных мышцах исп-ся как источник энергии.
В печени образуются ЛПОНП (из эндогенных липидов), которые поступают в кровь, где также взаимодействуют с ЛП-липазой эндотелия, расщепляющая ТАГ. ВЖК переходят в ткани или, связываясь с альбуминами (ЛПОВП) разносятся по организму. В результате образуются остаточные ЛПОНП, который поступают либо в печень, либо превращ. в ЛПНП.
ПОДРОБНО: ТАГ и ХС нс растворяются в воде. Именно поэтому они перемещаются в водной среде в составе сложных белков - липопротеинов. В молекулах липопротеинов ТАГ и эфиры холестерола погружены в оболочку, состоящую из ФЛ, свободного ХС и белка.
Синтез липопротеинов начинается с трансляции белков — апопротеинов на рибосомах. Затем апопротеины в ЭПР соединяются с ТАГ. Образовавшиеся прелипопротеновые частицы транспортируются в аппарат Гольджи, где к ним присоединяются ФЛ, а также молекула свободного холестерола и холестеридов. Окончание формирования липопротеинов сопровождается образованием секреторных везикул, которые сливаются с ЦПМ и высвобождения липопротеиновых частиц в кровь.
Каждому липопротеину соответствует свой набор аполипопротеинов. В целом роль аполипопротеинов (апо) сводится к следующему
• Белки апо В-48 в ХМ и апоВ-100 в ЛПОНП нужны для формирования липопротеиновых частиц.
• Являются активаторами ферментов. Так, апо С-II активирует ЛП-липазу, а апо A-I в ЛПВП активирует фермент лецитин-холестеролацилтрансферазу (ЛХАТ).
• Аполипопротеины отвечают за связывание с рецепторами на поверхности клеток-мишеней, что является сигналом к запуску эндоцитоза. Это позволяет избирательно связываться липопротеинам с определенными клетками. Так, в гепатоцитах апо В-100 связывается с рецепторами к ЛПНП, а апо Е позволяет распознать остатки ХМ.
• Определенные белки участвуют в транспорте липидов между липопротеинами. Например, апо D переносит холестериды от ЛМВП на другие липопротеины.
• Структура и концентрация каждого аполипопротеина регулируется генетически, тогда как содержание различных липидов липопротеинах зависит от особенностей питания и других факторов.
Все липопротеины отличаются по размеру, количественному составу белков и липидов.
 |  |
ХМ и ЛПОНП осущ-ют транспорт липидов в различные ткани, в том числе жировую. Их синтез происходит в клетках эпителия кишечника. Большая часть ЛПОНП на самом деле синтезируется в гепатоцитах. Синтезированные липопротеины в энтероцитах кишечника транспортируются в лимфатические сосуды, после чего попадают в кровь. В процессе их циркуляции в в крови на незрелые ХМ с ЛПВП-и переносятся по апо С-II и апо Е, что заканчивается появлением зрелых ХМ.

8
 . Мобилизация триацилглицеролов (липолиз). Регуляция.
. Мобилизация триацилглицеролов (липолиз). Регуляция.Мобилизация ТАГ (липолиз). Активируется:
1) при физиолог. ситуациях: стресс, мыш. работа, голодание.
2) при пат. состояниях: СД 1-го типа, Базедова болезнь.
В жировой ткани содержится несколько липаз, из которых наибольшее зн-е имеют триглицеридлипаза (гормоночувств. липаза), диаглицеридлипаза и моноглицеридлипаха.
Под влиянием гормоночувств. ТАГ-липазы происходит отщепление ВЖК от ТАГ с образованием ДАГ. ДАГ под влиянием ДАГ-липазы расщепляется до МАГ, являющегося субстратом для МАГ-липазы. В результате образуются ВЖК и глицерол.
Связанные с альбуминами плазмы крови в виде комплекса свободные ж. к-ты с током крови попадают в органы и ткани, где комплекс распадается, а ж. к-ты подвергаются либо β-окислению, либо частично исп-ся для синтзеа ТАК, СЛ и т.д., а также на этерификацию ХС.
Глицерол с кровью доставляется в печень и почки, где фосфорилируется и окисляется в метаболит гликолиза диоксиацетофосфат (ДАФ).
Регуляция: 1) Усиление:
-катехоламины, глюкагон, тироксин – активация аденилатциклазы;
- глюкокортикоиды – синтез ТАГ-липазы по внутр. механизму;
-СТГ, АКТГ – активация синтеза аденилатциклазы;
-стресс, физ. нагрзука, голодание, охлаждение – увел. секреция катехоламинов и уменьш. инсулина.
2) Угнетение: -инсулин – активация фосфодиэстеразы, снижение активности аденилатциклазы;
- простагландины, никотиновая к-та – уменьш. активности аденилатциклазы.
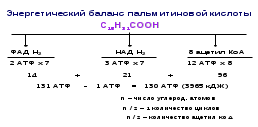
9. β- окисление высших жирных кислот. Энерг. баланс окисления пальмитиновой кислоты.
β-окисление – специфический путь катаболизма жирных кислот, при котором происходит отщепление по 2 углеродных атома в виде ацетил-КоА. Называется так потому, что реакции окисления происходят у β-углеродного атома.
I этап – подготовительный, протекает в цитоплазме. В результате чего происходит активирование высшей жирной кислоты (ацил-SКоА).
II этап - ацил-SКоА соединяется с витаминопободным вещ-вом карнитином, транспортирующий ацетил-S-КоА в митохондрии, где ВЖК подвергается 4м превращениям за один цикл.
Карнитин синтезируется в печени почках и затем транпортируется в остальные органы. Во внутриутр. периоде и в первые годы жизни зн-е карнитина для организма чрезвычайно важно. Энергообеспечение нервной системы детского организма и в частности головного мозга осущ. за счёт 2х параллельных процессов карнитинзависимого окисления ВЖК и аэробного окисления глюкозы.
Существуют исследования, связывабшие с недостатком карнитина детский церебральный паралич и феномен «смерти в колыбели».
В цитоплазме:

Процесс собственно β-окисления сост. из 4х реакций, повторяющихся циклически. В митохондриях последовательно происходят: дегидрирование, гидратация, второе дегидрирование и тиолиз.
В последней реакции от ВЖК отщепляется ацетил-S-Коа. К оставшейся (укороченной на 2 углевода) ВЖК присоед. HS-KoA, и она возвращ. в 1-ую реакцию. Всё повторяется, пока в последнем цикле не образуются 2 молекулы ацетил-SKoA.

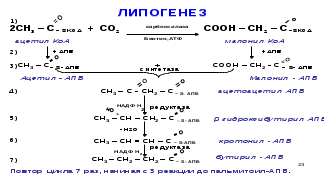
10. Синтез высших жирных кислот (липогенез). Особенности. Регуляция.
Липогенез наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани, в состоянии покоя или после еды. Особенности:
1) Протекает в цитоплазме.
2) У человека происходит синтез только пальмитиновой кислоты.
3) Принимает участие АПБ (ацилпереносящий белок) – полиферментный комплекс из 6 ферментов.
4) Необходимо участие реакций карбоксилирования, СО2, АТФ, НАДФ∙Н2.
Удлинение пальмитиновой кислоты происходит с участием ацетил-КоА, с образованием стеариновой кислоты. В печени и в тканях мозга из стеариновой кислоты образуются ВЖК с длинной углеродной цепью от С20 до С24, необходимых для образования глико- и сфинголипидов. Из ненасыщенных жирных кислот в организме синтезируется только олеиновая в результате дегидрирования стеариновой кислоты (десатурация) – под влиянием ферментов десатураз, которые могут образовывать двойные связи только у 9 углеродного атома, ω-3 и ω-6 не синтезируются в организме и обязательно должны поступать с пищей.
Гормональная регуляция. Ключевым ферментом синтеза ВЖК явл. карбоксилаза, активность которого регулируется:
1) Глюкагон, адреналин по мембранному механизму вызывают её фосфорилирование, она становится неактивной и липогенез тормозится.
2) Инсулин вызывает дефосфорилирование карбоксилазы, которая становится активной, и стимулируется липогенез: по внутриклеточному механизму инсулин - индуктор синтеза карбоксилазы.
11. Синтез нейтральных жиров.
Нейтральные жиры – в их состав входит 3хатомный спирт глицерин и ВЖК: олеиновая кислота 55%, пальмитиновая 20%, линолевая 10%.
12. Ожирение. Первичное и вторичное. Причины.
Ожирение – полигенное заболевание, сопровождающееся накопление ТАГ в адипоцитах, которое явл. фактором риска развития инфаркта миокарда, инсульта, СД, гипертонической и желчнокаменной болезни.
1) Первичное – оно развивается в результате алиментарного дисбаланса – избыточное калорийное питание по сравнению с расходованием энергии. Причины:
- генетические нарушения до 80% - состав и количество потребляемой пищи
- система питания в семье - уровень физической активности
- психологические факторы
Генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми. У людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм. Возможно разное соотношение аэробного и анаэробного гликолиза. Анаэробный гликолиз (как менее эффективный) «сжигает» гораздо больше глюкозы, в результате снижается переработка в жиры.
У человека обнаружен ген ожирения. Продуктом экспрессии этого гена служит белок лептин, который содержит 167 аминокислотных остатков, взаимодействует с рецептором гипоталамуса, в результате снижается секреция нейропептида У, стимулируя пищевое поведение. У 80% больных концентрация лептина в крови тучных людей больше в 4 раза чем у нормы. У 80% лиц с первичным ожирением гипоталамус нечувствуителен к лептину, у 20% - дефект стуктуры лептина.
2) Вторичное ожирение – ожирение в результате основного заболевания, чаще эндокринного.
Болезнь Иценко-Кушинга – гиперф-я глюкокортикоидов. Гипергликемия, снижение толерантности к глюкозе, обусловленные стимуляцией глюкогеногенезе («стероидный диабет»), усиление катаболизма белков, уменьш. мыш. масса, своеобразное отложение жира (лунообразное лицо, выступающий живот). Гипернатриемия, гипокалиемия, гипертензия, истончение кожи.
Микседема – гипофун-я щит. железы. Слиз. отёк, пат. ожирение, резкое снижение основного обмена, выпадение волос и зубов, псих. расстройства, сухая кожа, гипергликемия, t снижена, агрессия.
СД 2-го типа.
Болезни гипофиза, гипоталамуса.
13. Распад фосфолипидов. Пути превращения арахидоновой кислоты. Роль эйкозаноидов в норме и в патогенезе атеросклероза, бронхиальной астмы. Жировое перерождение печени. Причины.

От ФЛ мембран под действием фосфолипазы А2, отщепляется арахидоновая кислота, которая используется для синтеза эйкозаноидов. Активация фосфолипаз происходит под действием различных факторов: гормонов, гистамина, цитокинов, в условиях гипоксии, иммунных воздействий и др.
В клетках имеется 2 основных пути превращения арахидоновой кислоты:
1) циклооксигеназный, приводящий к синтезу простагландинов – предшественников ТХ и PgI;
2) липооксигеназный, заканчивающийся образованием лейкотриенов.
| Простагландины : 1) Влияют на сокращение гл. мышц. 2) Способствуют секреторной функции желудка. 3) Участвуют в воспалительных реакциях. 4) Модулируют действие гормонов. 5) Влияют на гемодинамику почек. 6) Автономно регулируют нервное возбуждение. | Простациклины – образуются в стенках кровеносных сосудов сердца, матки, слизистых желудка. 1) Расслабляют гладкую мускулатуру 2) Способствуют фибринолизу, и тем самым препятствует свертыванию крови. |
| Тромбоксаны являются антагонистами простациклинов, образуются в тромбоцитах, в мозге, способствуют свертыванию крови 1) Вызывая агрегацию тромбоцитов 2) Оказывают сосудосуживающее действие. Накопление служит причиной тромбоза, атеросклероза | Лейкотриены в лейкоцитах, макрофагах. 1) Вызывают сокращение гладких мышц дыхательных путей 2) Стимулируют секрецию гликопротеинов, увеличивают количество слизи в дыхательных путях 3) Участвуют в аллерг. и иммунолог. реакциях. 4) Повышают проницаемость сосудов. 5) Затрудненное дыхание при бронхиальной астме связано с действием лейкотриенов. Ревматоидные артриты также обусловлены действием лейкотриенов. |
Жировое перерождение (инфильтрация) печени. Гепатоциты переполняются нейтральным жиром (ТАГ), разрушаются, образуются кисты, вокруг них разрастается соединительная ткань, развивается жировая дистрофия.
Эта патология возникает вследствие нарушения синтеза фосфолипидов, связанный с недостатком липотропных фактров: метионина, полиеновых ненасыщенных жирных кислот, холина, В12, В15, фолиевой кислоты, липокаина (вырабатывается в ПЖЖ), поступающей только в составе пищи. ФЛ входят в состав ЛПОНП, которые транспортируют эндогенные ТАГ из печени тканям. Следовательно, нарушение образования ЛПОНП приводит к нарушению их выведения и накопления в печени.
Т.к. ЛПОНП вкл-ют разнообр. соединения, то блок может возникнуть на разных уровнях синтеза:
1) Недостаток апобелков – нехватка белка или незаменимых аминок-т в пище, воздействие токсинов и ингибиторов синтеза белка.
2) Снижение синтеза ФЛ – отсуствтие липотропных факторов (витаминов В12, В15, метионина, ПНЖК, холина), вследствие чего не формируется оболочка ЛП.
3) Нарушение секреции ЛП в крови – патология мембран гепатоцитов при активации ПОЛ (перекисное окисление липидов) вследствие недостаточности антиоксидантных систем (авитаминозы А,С,Е, нехватка цинка и железа).
14.Синтез холестерола. Регуляция метаболизма холестерола.
Реакция синтеза ХС происходит в цитолизе клеток, это один из самых длинных метаболических путей в организме человека, включает около 100 последовательных реакций.
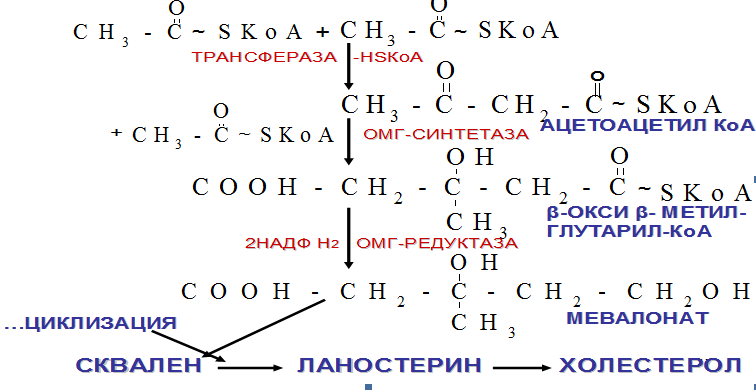
Регуляция метаболизма холестерола. Регуляторным ферментом явл. ОМГ-редуктаза, активность которой может изменяться в 100 и более раз.
1) Метаболическая регуляция - по принципу обратной связи фермент ингибируется конечным продуктом реакции – ХС. Это помогает поддерживать внутриклет. содержание ХС постоянным. Избыток ХС по принципу обратной связи подавляет образование новых рецепторов к ЛПНП, их кол-во уменьш. и клетка связывает меньше ЛПНП.
2) Гормональная регуляция. Глюкагон и адреналин по мембранному мезанизму активируеют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму, синтез ХС тормозится. Глюкагон подавляет кол-во рецепторов к ЛПНП.
Инсулин дефосфорилирует ОМГ-редуктазу, способствуя переходу в активное состояние, синтез ХС стимулируется. Инсулин, Т3, половые гормоны увел. кол-во рецепторов.
15.Пути превращения и выведение холестерола.
Пути превращения ХС:
1) Основной путь превращения ХС – это его окисление. 80% от всего количества окисляется в печени в желчные кислоты, 3% в стероидные гормоны. В результате – в молекуле ХС появл. полярные группы, гидроксилы, карбоксилы, повышается его растворимость в воде, что способствует выведению из организма.
2) Второй путь превращения ХС в организме – это образование эфиров ХС (эстерификация). Эфиры ХС составляют около 10% от общего количества ХС в организме. При этом растворимость уменьшается и это приводит к накоплению в организме. У новорожденных относительно низкий коэффициент эстерификации по сравнению с более старшим возрастом детей = 0,58-1 ммоль/л, что связано с дефицитом полиненасыщенных жирных кислот.
3) Дегидрирование. В положении 7, 8 образуются двойные связи, что приводит к образованию 7-дегидрохолестерола (предшественника витамина Д3).
 | 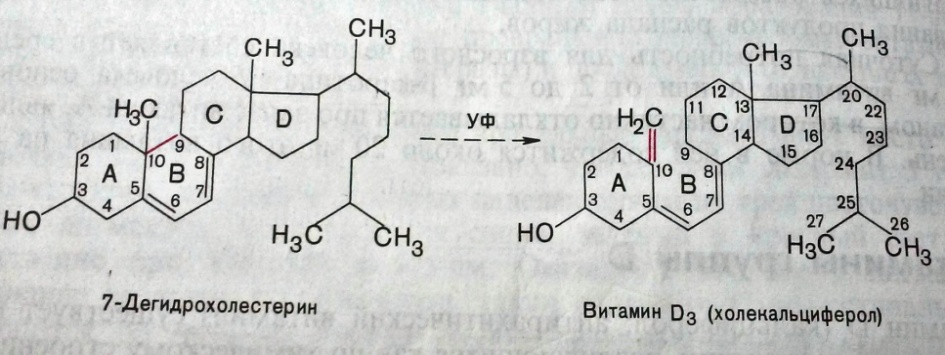 |
  | Прогестерон    |
Выведение холестерола.
Чтобы поддерживать постоянный уровень его в организме необходимо выводить 1,5г в сутки. 1г в сутки окисляется в желчные кислоты, 200-300мг в сутки с калом в виде копростанола, 100мг со слущенным эпителием, 40 мг идет на синтез стероидных гормонов, с мочой 1-2мг в сутки.
16.Роль ЛПНП и ЛПВП в обмене холестерола.
Транспорт ХС и ЭХС осущ-ся ЛПНП-и и ЛПВП-и. ЛПНП:
1) Образуются в гепатоцитах и в сосуд. системе печени под воздействием печёночной ТАГ-липазы из ЛПОНП.
2) Основным апобелком явл. апоВ-100.
3) Самые атерогенные.
Фун-и:1) Транспорт ХС в клетки половых желёз, коры надпочечников, кожи, печени.
2) Транспорт ПНЖК в виде эфиров ХС в некоторые клетки РВСТ, почек, в нейроциты и др.
Клетки РВСТ активно синтезируют эйкозаноиды. Поэтому им необходим постоянные приток ПНЖК, что осущ-ся переходом ФЛ от оболочки ЛПВП в мембраны клеток, либо поглощением ЛПНП, которые несут ПНЖК в виде ЭХС. Особенностью всех этих клеток явл. наличие лизосомальных кислых гидролаз, расщепляющих ЭХС.
Обмен ЛПНП:
1) В крови первые ЛПНП взаимодействуют с ЛПВП, отдавая свободный ХС и получая ЭХС. в результате в них происходит накопление ЭХС, увел-е гидрофобного ядра и «выталкивание» белка апоВ-100 на поверхность частицы.
2) На всех клетках, использующих ЛПНП с рецептором, они поступают в клетку путём эндоцитоза. В клетке ЛПНП распадаются на ФЛ, белки (аминок-ты), глицерол, ВЖК, ХС, ЭХС,
3) ХС превращ. в гормоны или вкл. в состав мембран.
4) При невозможности удалить ХС часть его этерифицируется с олеиновой к-той ферментом ацетилхолестеролацилтрансферазой (АХАТ).
5) ПНЖК, образованные при распаде ЭХС исп. для синтеза эйкозаноидов или ФС.
6) Остаточный ХС удаляется из клеток в составе ЛПВП.
ЛПВП.
1) Образуются в печени, в плазме крови при распаде ХМ, некоторое кол-во в ственке кишечника.
2) Основным апобелком явл. апоА1.
Фун-и: 1) Осущ. транпорт ХС от тканей к печени.
2) ФЛ ЛПВП явл. источником ПНЖК для синтеза клеточных ФЛ и эйкозаноидов.
В регуляции синтеза рецепторов ЛПНП участвуют: инсулин, Т3, половые гормоны, которые увел. их кол-во, а глюкагон – подавляет.
Эффекты инсулина и Т3 могут объяснить механизм гиперхолестеринемии, риск атеросклероза при СД и при гипотиреозе.
17.Гиперхолистеролемия: атеросклероз, желчекаменная болезнь. Дислипопротеинемии.
Гиперхолестеринемия – повышение уровня ХС в крови при норме 3,9-5,2 ммоль/л. Факторы риска:
1) Гиперкалорийное питание (избыточное поступление углеводов, жиров).
2) Гиподинамия.
3) Курение.
4) Сопутствующие заболевания (гипертоническая болезнь, сахарный диабет, гипотиреоз, ожирение).
5) Стресс (адреналин приведет к синтезу ацетилКоа → ХС).
АТЕРОСКЛЕРОЗ - Заболевание, связанное с накоплением холестерола и его эфиров, в ЛПНП, в эндотелии сосудов.
В
 области бляшки часто образуются тромбы, суживающие просвет сосуда, что приводит к острому нарушению кровообращения и развитию инфаркта миокарда, инсульта.
области бляшки часто образуются тромбы, суживающие просвет сосуда, что приводит к острому нарушению кровообращения и развитию инфаркта миокарда, инсульта.Непосредственной биохим. причиной атеросклероза явл. модификация ЛП в зоне воспаления, в основном окислением, гликозилирование. Окисление ЛПНП нарастает при недостаточной активности антиоксидантных систем – гиповитаминозах Е и С, нехватке металлов (Fe, Se, Cu, Zn), входящих в состав антиокисдантных ферментов каталазы, пероксилазы, СОД.
Гликозилирование белков ЛПНП ускоряется при Сд. Также модифицированные ЛП теряют способность связываться с апо-В-100-рецептором и проникать в клетки-мишени и, в результате, накапливаются в крови и интиме сосудов.
ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ. Патологический процесс, при котором в желчном пузыре образуются камни, основу которых составляет ХС. Выделения ХС в желчь должно сопровождаться пропорциональным выделением желчных кислот и ФЛ, удерживающих гидрофобные молекулы ХС в желчи в мицеллярном состоянии. Если эти пропорции нарушены, то ХС начинает осаждаться в желчном пузыре, образуя вязкий осадок, который постепенно становится твердым. Камни могут состоять не только из холестерола (белого цвета), но и из смеси ХС, билирубина, белков, кальция – смешанные (коричневого цвета).
Причины: гиперкалорийное питание, избыток ХС в пище, застой желчи, нарушение энтерогепатической циркуляции желчных кислот, а также их синтеза, инфекции желчного пузыря.
ДИСЛИПОПРОТЕИНЕМИИ – нарушения обмена ЛП крови и, следовательно, нарушения обмена липидов, транспортируемых ЛП. Они проявляются чаще всего повышением концентрации либо одного типа ЛП, либо сочетанным увел-ем нескольких типов ЛП.
I тип – наследств. недостаточность ЛП-липазы – дефект структуры ЛП-липазы – увел-е в крови ХМ и ЛПОНП, нет риска атеросклероза, гиперглицеролемия.
II тип – семейная гиперхолестеролемия – дефект рецепторов ЛПНП или мутация гена апоВ-100 – увел. конц-и ЛПНП, гиперхолестеролемия, ранний атеросклероз, ксантоматоз.
III тип – семейная комбинированная гиперлипидемия, нарушение удаления остаточных липопротеинов из крови – дефект в структуре аоЕ. Синтез изоформы апо Е2, которая не взаимодействует рецепторами – увел. конц. остаточных ХМ, ЛПНП, ЛППП, ЛПНП. Гиперхолестеролемия, гипертриглицеролемия, ранний атеросклероз, ксантоматоз.
IV и V тип – семейная гипертриглицеролемия – генетич. гетерогенная группа заболеваний. Избыточная продукция ЛПОНП как результат гиперинсулинемии – увел. кон-и ЛПОНП, ЛПНП, гипертриглицеролемия, умеренная гиперхолестеролемия. Атеросклероз, уменьш. толерантности к глюкозе, ксантоматоз.
18.Кетоновые тела. Синтез. Биологическая роль. Кетонемия, кетонурия, причины.
Кетоновые тела – группа продуктов обмена вещ-в, которые образуются в печени из ацетил-Коа: ацетоуксусная кислота, β оксимасляная (β окси-бутират), ацетон.
